 |
Молекулярно-кинетическая, гравитационная и градиентная коагуляция
|
|
|
|
Реагентные методы очистки воды (коагуляция, флокуляция). Принципиальная технологическая схема реагентного умягчения воды.
Дать понятия: коагулянт, коагуляция: гетерокоагуляция и взаимная коагуляция, молекулярно-кинетическая, гравитационная и градиентная коагуляция; флокуляция, флокулянт, классификация флокулянтов. Описать технологическую схему. Остальное – на случай вопросов.
Коагуляция используется для очистки природных и промышленных сточных вод в основном от загрязняющих веществ, которые находятся в коллоидном взвешенном состоянии. Суть её заключается в том, что в воду добавляют вещества – коагулянты. Чаще всего – это соли алюминия и железа, а также их смеси, но можно использовать и соли других многовалентных катионов – магния, титана. Коагулянты – это соли сильных кислот и слабых щелочей. Они гидролизуются с образованием солей гидрооксидов, которые имеют развитую поверхность и которые сорбируют на ней различные примеси. При этом частички увеличиваются (коагулируют) и осаждаются вместе с коллоидными и взвешенными вещества.
Гидролиз сульфата алюминия, гидроксохлорида алюминия и хлорида железа можно представить в виде суммарных реакций:
Al2(SO4)3 + 6HOH ↔ 2Al(OH)3 + 3H2SO4 Al3+: H+ = 1:3 (1)
2Al3+ + 6HOH ↔ 2Al(OH)3 + 6H+
Al2(OH)5Cl + HOH ↔ 2Al(OH)3 + HCl Al3+: H+ = 1:0.5 (2)
[Al2(OH)5]+ + HOH ↔ 2Al(OH)3 + H+
FeCl3 + 3HOH ↔ Fe(OH)3 + 3HCl Fe3+: H+ = 1:3 (3)
Fe3+ + 3HOH ↔ Fe(OH)3 + 3H+
В уравнении (2) приведена реакция гидролиза высокоосновного гидроксохлорида алюминия, который как коагулянт имеет ряд преимуществ перед сульфатом алюминия. Одним из них является то, что он имеет высокую коагулирующую способность в более широком интервале рН, так как при одинаковой дозе коагулянта выделяется меньшее количество протонов. Гидроксохлорид алюминия обеспечивает образование больших хлопьев, которые быстро осаждаются. Благодаря содержанию в своём составе хлорид-ионов, гидроксохлорид алюминия при гидролизе образует стойкие коагуляционные структуры, которые не разрушаются при перемешивании. Кроме того, хлориды снижают водоудерживающую способность частиц золя гидрооксида, что способствует коагуляции. Расход гидроксохлорида алюминия на 25...30% ниже при одинаковом эффекте очистки по сравнению с сульфатом алюминия. Следует отметить, что использование сульфата алюминия при высокой жесткости воды приводит к отложению сульфатов кальция и магния. Сульфат ионы связываются с катионами алюминия в стойкие комплексы, при этом происходит большой расход коагулянта.
|
|
|
1.Гетерокоагуляция и взаимная коагуляция
2. Молекулярно-кинетическая, гравитационная и градиентная коагуляция
3.Гидролиз коагулянтов
4.Влияние реакции среды и концентрации ионов на процесс коагуляции
Гетерокоагуляция и взаимная коагуляция
Реальные водные растворы, суспензии содержат коллоидные частицы с разными размерами и поверхностными потенциалами и являются полидисперсными системами. Эти воды являются гетерофазными системами, содержат несколько твердых или нерастворимых в воде редких фаз, которые характеризуются разными степенями дисперсности и поверхностными потенциалами частиц.
Коагуляция в таких гетерофазных полидисперсных системах называется гетерокоагуляцией.
Стабильность коллоидных систем зависит от соотношения сил межмолекулярного притяжения и сил электростатического взаимодействия.
Электростатические силы могут быть силами отталкивания, если знаки зарядов коллоидных частиц одинаковые, или силами притягивания - если знаки противоположные.
Если знаки зарядов коллоидных частиц одинаковые, а величины зарядов этих частиц разные, то стабильность коллоидной системы определяется величиной поверхностного потенциала частицы с меньшим значением заряда (с низшим поверхностным потенциалом).
|
|
|
На процесс гетерокоагуляции в значительной мере влияет энергия взаимодействия коллоидных частиц с растворителем. Если энергия взаимодействия незначительная, что характерно для большинства лиофобных золей, то основными силами, которые определяют стабильность систем, будут силы Ван-дер-Ваальса.
В том случае, если энергия взаимодействия коллоидных частиц с растворителем высока, именно она в значительной степени определяет стабильность коллоидных систем. При этом в данном растворе возможно изменение знака сил взаимодействия коллоидных частиц на противоположный. При одинаковых знаках зарядов и при высокой энергии взаимодействия с растворителем сила отталкивания может изменяться на силу притяжения. Такое бывает редко.
Одним из видов гетерокоагуляции является взаимная коагуляция. Взаимная коагуляция - это взаимодействие коллоидных частиц с противоположными знаками зарядов. В этом случае происходит быстрая коагуляция, так как и силы Ван-дер-Ваальса и электростатические силы направлены на притяжение частиц между собою.
Взаимная коагуляция, являющаяся отдельным процессом, состоит в агрегации разноименно заряженных частиц. Теория гетерокоагуляции создана Б.В.Дерягиным на основе общего подхода теории ДЛФО, то есть учета баланса сил притягивания и отталкивания между частичками. Основные выводы этой теории. Электростатические силы взаимодействия разноименно заряженных поверхностей изменяют знак и при всех расстояниях между частицами становятся силами притяжения. Последние прибавляются к силам молекулярного притяжения и служат причиной быстрой коагуляции при любых концентрациях электролита. Этот процесс широко применяют на практике для разрушения дисперсных систем, например, во время очищения воды.
Взаимная коагуляция наиболее эффективно проходит при равенстве зарядов и концентраций противоположно заряженных коллоидных частиц. Из-за отсутствия этого равенства процесс коагуляции проходит неэффективно или вообще не наступает. При большой разности в знаках зарядов частиц коагуляция остановится при образовании определенных конгломератов (агрегатов).
|
|
|
Молекулярно-кинетическая, гравитационная и градиентная коагуляция
Большинство естественных коллоидов заряжены отрицательно. Это кремниевая кислота, мелкие глинистые и грунтовые частички, гумусовые вещества. Глинистые грунтовые взвеси состоят из гидроалюмосиликатов общей формулы xAl2O3· ySiO3· zH2O. Глинистые и гуминовые вещества лучше коагулируют при снижении рн среды.
Большинство веществ, которые определяют мутность и цветность воды, являются гидрофобными или слабо гидрофильными коллоидами. При гидролизе коагулянтов также получаются гидрофобные или слабогидрофильные коллоиды.
Сближение частиц на расстояние, при котором они коагулируют, достигается за счет броуновского движения, или направленного перемещения частиц, которые двигаются с резкой скоростью под действием силы тяготения, а также за счет разной скорости движения частиц в разных направлениях при перемешивании воды.
Если сближение частиц происходит по счет броуновского движения, то процесс коагуляции называют молекулярно-кинетической коагуляцией. Молекулярно-кинетическая коагуляция ускоряется при несимметричной форме частиц, при полидисперсности золя. По мере укрупнения частиц скорость коагуляции снижается.
Коагуляция за счет направленного перемещения частиц с разной скоростью под действием силы тяготения называется гравитационной коагуляцией. Скорость процесса увеличивается при полидисперсности систем, при развитой поверхности частиц золя коагулянта.
Градиентная коагуляция наблюдается в моно- и полидисперсных системах при условии, что размер некоторых частиц превышает критический размер 2-3 мкм. В этом случае перемешивание, которое приводит к неравномерному движению отдельных потоков воды, обуславливает столкновение и слипание частиц на границе макро- и микропотоков.
При увеличении интенсивности перемешивания скорость градиентной коагуляции возрастает до определенного предела. За этим пределом скорости перемешивания макро- и микропотоков такие, что разность в скоростях движения разных потоков приводит к разрушению хлопьев. Скорость перемешивания оптимальна, когда образование и разрушение хлопьев происходит с одинаковой интенсивностью. При этом достигаются оптимальные размеры хлопьев. Для природной воды – это 30-60 актов за 1 с. Аналогично влияет и продолжительность перемешивания.
|
|
|
Гидролиз коагулянтов
Реальные природные и сточные воды содержат сложные смеси растворенных и нерастворенных примесей, часть из которых существует в виде коллоидных систем. При применении коагулянтов процесс очистки воды осуществляется в основном за счет адсорбции растворенных веществ на поверхности гидроксидов металлов, за счет адсорбции и коагуляции коллоидных примесей при взаимодействии с гидроксидами металлов.
Как правило, коагулянты используются в значительно больших концентрациях, чем концентрации коллоидных примесей. Поэтому процесс взаимной коагуляции реализуется очень редко.
Чаще всего при внесении коагулянта в раствор происходит гидролиз металла с формированием хлопьев гидроксида металла. Хлопья гидроксида металла способны к сорбции разнообразных примесей, которые находятся в воде. Укрупнение частиц гидроксидов металлов происходит по счет агрегации (коагулирующего действия частиц) или за счет ориентации (за счет роста кристаллической решетки), когда отдельные молекулы присоединяются к частицам гидроксида.
При агрегации площадь частиц гидроксида металла значительно больше, чем при ориентации, так как получаются аморфные вещества, а при ориентации получается кристаллическая структура, которая имеет большую плотность и меньшую площадь поверхности на единицу массы гидроксида.
Как правило, способность к ориентации уменьшается с увеличением валентности металла.
Следует отметить, что при гидролизе металлов поверхностный заряд частиц гидроксидов металлов в значительной мере зависит от реакции среды. При уменьшении рн среды, как правило, увеличивается положительный поверхностный заряд, или ζ- потенциал (рис.1).
При увеличении рн положительный поверхностный заряд уменьшается и при определенных значения рн начинает увеличиваться отрицательный поверхностный заряд.
Это характерно для многих веществ: крахмалов, силикатов, глинистых минералов.

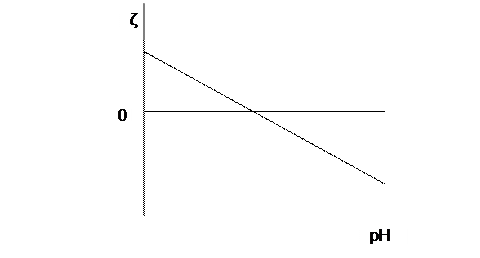
Рис.1. Зависимость электрокинетического потенциала от рн.
Скорость процесса гидролиза металлов зависит от концентрации металла:
Мn+ + nХ- + nН2О ↔Ме(ОН)n + nН+ + nХ-
|
|
|
Мn+ + nН2О ↔Ме(ОН)n + nН+
Тогда скорость процесса гидролиза:
υ = k [Мn+] [Н2О]n
υ = k' [Мn+]
константа равновесия будет описываться уравнением:
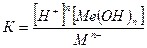
Эффективность процесса гидролиза зависит от растворимости металла в воде и произведения растворимости.
Таблица 1. Растворимость гидроксидов при 180С
| Гидроксид | ПР | Растворимость, гмоль/дм3 |
| Аl(ОН)3 | 1.9·10-33 | 2.9·10-9 |
| Fе(ОН)3 | 3.8·10-38 | 2.0·10-10 |
| Fе(ОН)2 | 6.3·10-16 | 4.9·10-6 |
Гидроксид алюминия амфотерное соединение:
АІ(ОН)3 + 3Н+↔АІ3+ + 3Н2О
АІ(ОН)3 + ОН-↔АІО2- + 2Н2О
Гидролиз FeCI3 проходит ступенчато. Ассоциация гидроксида железа с исходным FeCI3 приводит к образованию мицелл, строение которых схематически можно представить так:
mFeCI3+3nH2O↔[nFe(OH) (m-n)FeCI3]+3nHCI
Реакция среды, при которой гидроксид алюминия имеет минимальную растворимость, – рН=6,5÷7,5
Для Fe(OH)3 – рН=5÷7
Для Fe(OH)2 – рН=7÷9
Для нормального протекания коагуляции большую роль играют размеры и структура частиц гидроксидов. Размеры частиц зависят от степени пересыщения раствора. При водоочистке гидролиз проходит в разбавленных растворах, что создает условия слабого пересыщения, т.е. оказывает содействие образованию крупных частиц, при обеспечении необходимого времени их формирования.
Структура частиц, которые выделяются из раствора, зависит от скоростей процессов, которые протекают одновременно: безпорядочного слипания частиц при столкновении (агрегации) и роста кристаллов (ориентации). При незначительном пересыщении главную роль играет скорость ориентации, которая у гидроксидов снижается с увеличением числа гидроксидных ионов, связанных с атомом металла. Поэтому гидроксиды двухвалентных металлов кристаллические, а трехвалентных - аморфные.
Согласно современным представлениям процесс обесцвечивания воды проходит так. При гидролизе коагулянта на протяжении 30-180 с получаются коллоиды гидроксидов, которые имеют большую поверхность. Примеси сорбируются на поверхности коллоидов. При адсорбции различают два процесса - собственно адсорбцию и фиксацию (закрепление) адсорбированных коллоидов на поверхности. В первом процессе ведущую роль играют силы межмолекулярного взаимодействия. Адсорбция больше, чем меньше размеры частиц. Причины фиксации могут быть разные. В момент образования золи АІ(ОН)3 и Fe(OH)3 имеют наивысшую адсорбционную активность. По мере перехода их в гель и при уплотнении геля их площадь уменьшается, что приводит к уменьшению адсорбции.
Таким образом, коагулируют не частицы, диспергированные в воде, а гидроксиды металлов.
Характер осветления природных вод определяется свойствами взвеси: при наличии крупных частиц вода осветляется благодаря их оседанию под влиянием силы тяжести, а в случае частиц высокой степени дисперсности осветление воды определяется величиной их обменной катионной емкости. Если эта величина превышает 250 мг-экв/дм3, осветление воды осуществляется без введения коагулянта в результате сжатия двойного электрического слоя за счет обмена одновалентных ионов на двух- и трехвалентные. Природные воды содержат взвесь с значительно меньшей величиной обменной емкости. Поэтому эффективное хлопьеобразование наступает лишь при внесении коагулянта. Большое значение имеет также орто-кинетическая коагуляция вследствие захвата взвеси сеткой оседающих хлопьев гидроксида.
1. Влияние реакции среды и концентрации ионов на процесс коагуляции
Влияние коагулянтов на процесс осветления воды зависит от концентрации взвешенных веществ в воде.
Реальные природные и сточные воды редко содержат взвеси в таких больших концентрациях, чтобы эффективное осветление воды происходило лишь за счет отстаивания. В реальных природных водах их концентрация или обменная емкость взвеси на несколько порядков ниже значения 250 мг-экв/дм3. Поэтому, чаще всего, при очистке воды эффективность процесса определяется эффективностью коагуляции самого коагулянта. Этот процесс определяется стадиями гидролиза коагулянта и укрупнением хлопьев гидроксидов металлов.
Максимальная эффективная коагуляция золей гидроксидов металлов происходит при значениях потенциалов близких к нулю. Величина потенциала для гидроксидов металлов зависит от реакции среды. Из практики водоочистки определены оптимальные значения рн для разных коагулянтов, то есть при этих значениях рн достигается изоэлектрическая точка.
| Название реагента | Оптимальное значение рН |

| 6,5...7,5 |
| FeCI3 | 5...7 |
| FeSO4 | 7...9 |
Кроме реакции среды на процесс коагуляции гидроксида металла влияет концентрация противоионов, а именно - анионов.
Как известно из теории ДЛФО, при повышении концентрации противоионов эффективность коагуляции возрастает. В реальных водах не желательно вносить большое количество индифферентного электролита, поскольку он является загрязнителем воды. Тем не менее, при невысоких дозах коагулянтов, уже при незначительных концентрациях противоионов, эффективность процесса может возрастать. На сегодня эти процессы довольно изучены и имеются диаграммы, которые связывают эффективность коагуляции с концентрацией разных анионов.
Из этих диаграмм видно, что при коагуляции гидроксидов железа и алюминия оптимальная концентрация для сульфат-ионов составляет 0,001...0,002 Н, для хлорид-ионов эта концентрация достигает 0,07 Н, для гидрокарбонат-ионов - 0,005 Н.
Не всегда высокие концентрации противоионов оказывают содействие эффективной коагуляции. При определенных условиях (при низких значениях рн и высоких концентрациях противоионов) могут получаться очень мелкие кристаллы, которые будут плохо отстаиваться.
В отдельных случаях является уместным использование смесей противоионов ( ,
,  ), оптимальные концентрации которых определяются по диаграммам.
), оптимальные концентрации которых определяются по диаграммам.
Флокулянты
План
1. Классификация флокулянтов
2. Структура молекул флокулянтов и их состояние в водном растворе
3. Заряд макромолекул флокулянтов
Классификация флокулянтов
Флокулянты - высокомолекулярные соединения, которые используются для интенсификации процессов очистки воды и обезвоживания осадков.
Данные реагенты повышают эффективность укрупнения осадков, а также улучшают водоотдачу осадков за счет процессов флокуляции, то есть за счет укрупнения твердых частиц с помощью макромолекул флокулянтов.
Флокуляция получила практическое применение для отделения твердых частиц от жидкости в различных технологических процессах в 30-е годы. В настоящее время флокуляция широко используется в технологии очистки природных и сточных вод.
Флокулянты разделяют на:
- неорганические,
-органические природные и
-синтетические.
Неорганические флокулянты, чаще всего, представлены разными формами активированной кремниевой кислоты. Другие неорганические вещества редко используются как флокулянты.
АК представляет собой частично структурированный коллоидный раствор (золь) диоксида кремния и отвечает общей формуле xSiO2*yH2O. АК не является промышленным продуктом, ее приготовляют на месте применения. Сырьем служит силикат натрия (жидкое стекло) и активирующий агент – минеральные кислоты, хлор, диоксид углерода или серы, сульфат или оксихлорид алюминия, алюминат натрия и др.
АК является анионным полиэлектролитом и отрицательный заряд макроиона АК облегчает адсорбционное и адгезионное взаимодействие АК с положительно заряженными частицами.
Органические вещества, которые используются в качестве флокулянтов, могут быть природного происхождения или синтетические.
К природным флокулянтам относятся разнообразные полисахариды, такие как крахмалы, модифицированные целлюлозы, гуаровые смолы, хитозаны и т.п. вещества. Кроме полисахаридов из природных веществ как флокулянты используют лигносульфонаты, гуминовые кислоты, белки и др. вещества.
Растворимый в воде крахмал является смесью линейного полимера – амилозы и разветвленного полимера – амилопектина и относится к неионогенным флокулянтам. Флоккулирующая способность крахмала зависит от его молекулярной массы и содержания амилозы и амилопектина, которые определяются видом растения (например, картофель, кукуруза), из которого получен крахмал.
Декстрины получают кислотной обработкой крахмала при различных температурах, концентрациях кислоты и т.д. Получаемые анионные полиэлектролиты обладают значительной флоккулирующей способностью.
За рубежом выпускают флокулянты на основе крахмала: Виспрофлок 20, Виспрофлок 75, Флокгель, Азим и др.
Альгинат натрия – полиэлектролит анионного типа, получаемый из морских водорослей. Молекулярная масса 15-170 тыс. Применяют в Японии, Англии, США под названием: Велгум, Келкзоль, Келджин W.
Карбоксиметилцеллюлоза (КМЦ) – полиэлектролит анионного типа, получаемый путем обработки щелочной целлюлозы хлоруксусной кислотой. В воде растворяется со степенью этерификации более 40%. Молекулярная масса 40-110 тыс. За рубежом КМЦ выпускается под названиями: Флокулес, СМС.
Гуаровые смолы получают из семян бобовых растений. Флокулянты на основе гуаровых смол – неионогенные полимеры. Выпускаются за рубежом под названиями: Джагуар WP, MRL, Суперзоль.
Чаще всего в процессах водоочистки и обработки гидрофильных осадков используют высокомолекулярные синтетические флокулянты. К ним относятся разнообразные полимерные вещества, растворимые в воде. Как правило, это вещества с молекулярной массой  в.о. Чаще всего флокулянты представляют собою смеси молекул с разной массой, то есть они отличаются по степени полимеризации.
в.о. Чаще всего флокулянты представляют собою смеси молекул с разной массой, то есть они отличаются по степени полимеризации.
Полиакриламид (ПАА) получил наиболее широкое распространение. ПАА получают обработкой акрилонитрила 85% раствором серной кислоты с последующей полимеризацией акриламида. Выпускаемый ПАА имеет молекулярную массу (1-6)*106, хорошо растворяется в воде. Концентрированные растворы ПАА представляют собой гелеобразную массу; разбавленные водные растворы имеют значительную вязкость. ПАА в присутствии кислот и щелочей частично гидролизуется с образованием акриловой кислоты и ее солей.
Любые флокулянты, в том числе и синтетические, разделяют на: катионные, анионные, амфотерные и неионогенные.
Катионные - флокулянты, в структуру которых входят катионные группы, чаще всего, это аминные —NН2 или аммонийные группы (-NН4) (полиэтиленимин, сополимеры винилпиридина, ВА-212 и др.). К ним относят полиамины, полиаммонийные соли, включая и пиридиновые соединения. Аминные или аммонийные группы могут быть включены непосредственно в полимерную цепь, а могут быть включены в побочные ответвления полимерной молекулы при введении функциональных групп путем модификации полимеров.
Анионные - флокулянты, в структуру которых включены анионные группы, такие как карбоксильные: — СООН, сульфоновые -SО3Н, сульфатные =SO4, фосфатные ≡РО4 и т.п. группы (активная кремниевая кислота, полиакрилат натрия, альгинат натрия, лигносульфонаты и др.)). Чаще всего анионными флокулянтами являются поликарбоновые кислоты, полисульфаты и полисульфонати, фосфорированные полисахариды, карбоксицеллюлоза и т.п. вещества.
Амфотерные — полимеры, содержащие одновременно анионные и катионные группы: полиакриламид, белки и др.
При диссоциации полиэлектролитов (Полиэлектролиты, полимерные электролиты, т. е. полимеры, способные диссоциировать в растворах на ионы.) образуется сложный высокомолекулярный поливалентный ион и простой маловалентный ион. Флокулянты анионного типа дают сложный полимерный органический или неорганический анион, а флокулянты катионного типа – сложный полимерный органический катион. Флокулянты амфотерного типа в зависимости от рН среды диссоциируют по кислотному или основному механизмам.
Неионогенные - флокулянты, которые не содержат функциональных групп, способных к диссоциации в воде с образованием ионов. (полимеры, содержащие неионогенные группы: —ОН, >СО (крахмал, оксиэтилцеллюлоза, поливиниловый спирт, полиакрилонитрил и др.);) К неионогенным флокулянтам относятся полиспирты, полиамиды, полиэфиры.
|
|
|


