 |
Программа, методические указания и контрольные задания
|
|
|
|
ХИМИЧЕСКИЕ, ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
Специальность 150402 «Металлургия цветных металлов»
Автор: преподаватель Т.П. Титовцева
- Содержание учебного материала дисциплины.
Введение.
Задачи аналитического контроля. Аналитическая химия как наука о методах определения химического состава вещества и его структуры. Классификация методов: научная, производственная, целевая. Объекты аналитического контроля в металлургическом производстве. Проба – как объект анализа: отбор и усреднение пробы; взятие навески; разложение (вскрытие) пробы; разделение (выделение определяемого компонента); расчет результата анализа.
Охрана труда и окружающей среды, техника безопасности противопожарные мероприятия в лабораториях аналитического контроля.
Знать: цели и задачи аналитического контроля;
основные объекты аналитического контроля в металлургии;
правила безопасности работы в лаборатории
Иметь представление: о значение аналитических определений в управлении качеством продукции; о мероприятиях по охране окружающей среды.
Уметь: обеспечивать безопасность рабочего места
МЕТРОЛОГИЯ И СТАНДАРТИЗАЦИЯ АНАЛИТИЧЕСКОГО КОНТРОЛЯ.
Метрологические характеристики методов анализа.
Основные термины. Погрешности анализа. Метрологические характеристики:
Правильность, точность, воспроизводимость, сходимость. Статистические основы метрологии: стандартное отложение, дисперсия, среднеквадратичное отклонение, доверительный интервал и применение их при обработке результатов анализа.
Стандартизация и метрологическое обеспечение аналитического контроля.
Стандартизация методом анализа. Нормативно-техническая документация. Метрологическое обеспечение: средства измерения, их поверка, аттестация. Эталон, стандартные образцы, и назначение. Структура центральной заводской лаборатории в условиях металлургического производства.
|
|
|
Знать: виды и методом измерений: метрологические характеристики;
Классификация ошибок; структуру службы аналитического контроля на предприятие.
Иметь представление: о стандартизации методом аналитического контроля и аттестации лаборатории.
Уметь: определять и учитывать погрешности при обработке результатов анализ; пользоваться нормативно-технической документацией.
Вопросы самоконтроля
1.Дать определение метрологи
2. Виды измерений
3.как оценивается точность, правильность, воспроизводимость результатов анализа
4.Основные нормативно-технические документы, регламентирующие выполнение анализа
5. Правила поверки средств измерений
6. Стандартные образцы состава: назначения и требования к ним. Определение понятия СОП.
7.Составте структуру ЦЗЛ вашего предприятия
8. Основные объекты анализа в металлургическом производстве
9. Правила отбора и подготовки средней пробы
10. Дать классификацию методов анализа
1.3 ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ АНАЛИТИЧЕСКОЙ ХИМИИ.
1.3.1 Химическое равновесие и теория электрической диссоциации.
Закон действия масс (ЗДМ). Контакта химического равновесия (КС). Применение ЗДМ для регулирования направленности химических процессов. Сильные Электролиты. Ионная сила раствора. Активность ионов. Степень диссоциации. Константа диссоциации. Диссоциация воды. Водородный и гидроксидный показатель. Буферные растворы: состав; механизм действия, применение в аналитической практике. Гидролиз, константа гидролиза. Равновесие в системе «раствор-осадок». Произведение растворимости (ПР). Двойные и комплексные соли.
|
|
|
1.3.2 Реакции окисления-восстановления в анализе.
Роль окислительно-восстановительных реакций в аналитической химии.
Составления уравнений реакции и расчет молярной массы эквивалента окислителя
(восстановления). Понятие об окислительно-восстановительном потенциале.
Возможность и направление окислительно-восстановительной реакции.
1.3.3 Общие сведения о методах качественного анализа.
Основные принципы качественного анализа веществ. Анализ мокрым и сухим
путем. Чувствительность и предел определения концентрации. Систематический и
дробные химические методы качественного анализа. Классификация ионов.
Групповые реагенты Частичные реакции.
Знать: основные понятия и определения; положения теории электрической диссоциации.
Иметь представление: о значении теоретических положений в аналитических исследованиях.
Уметь: рассчитывать константу химического равновесия, составлять ионно-молекулярные уравнения реакций обмена, гидролиза, окисления-восстановления; пользоваться таблицей редокспотенциалов; выполнять анализ по обнаружению ионов в продуктах металлургического производства.
Вопросы самоконтроля.
1.Какая величина является выражением ЗДМ для обратимых процессов?
2.Что положено в основу делении электролитов на сильные и слабые?
3.Какими величинами можно охарактеризовать силу электролита?
4.Как рассчитать рН в растворе слабого электролита?
5.Объясните механизм действия аммиачной туферной смеси.
6.Что такое гидролиз соли и какие факторы на него влияют?
7.Сформулируйте ЗДМ для системы “осадок-раствор”
8.Произведение растворимости в анализе.
9.Какие соединения называются комплексными? В чем особенность их строения?
10.Приведите примеры применения комплексных соединений аналитической химии.
12.Приведите примеры сильных окислителей о восстановителей, применяемых в анализе.
13.Как определить возможность реакции окисления-восстановления без эксперимента?
14.Какие методы качественного анализа вы знаете?
15.Какие групповые реагенты вы знаете?
16.В чем отличие дробного и систематического анализа?
17.Какие физико-химические и физические методы качественного анализа вы
знаете?
1.4. ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА
|
|
|
1.4.1. Гравиметрический анализ.
Сущность и область применения. Основные операции метода. Методика проведения гравиметрических определений. Аналитические весы, устройства и правила работы. Расчеты результатов анализа. Аналитический фактор.
1.4.2., Титриметрический анализ.
1.4.2.1. Общие сведения.
Сущность и область применения. Способы выражения концентрации растворов. Рабочие тетрированные растворы: приготовление, установка точной концентрации. Методика и приемы тетрирования. Точка эквивалентности. Расчеты результатов анализа.
1.4.2.2. Метод кислотно–основного тетрирования (нейтрализация).
Сущность метода. Рабочие растворы и индикаторы метода. Расчеты pH в процессе тетрирования. Кривые тетрирования. Примеры тетрирования кислотных и щелочных растворов.
1.4.2.3. Методы окисления – восстановления (редоксометрия).
Сущность метода: классификация определений. Расчет окислительно–восстановительных потенциалов. Характеристика методов перманганатометрии, иодометрии, хроматометрии (рабочие растворы, приемы тетрирования, индикаторы); примеры их применения для анализа продуктов металлургии.
1.4.2.4. Методы комплексообразования.
Реакции комплексообразования и их применение для аналитических целей. Рабочие растворы и индикаторы метода. Трилонометрия и ее применение для анализа в металлургическом производстве.
Знать: классификацию и сущность химических методов анализа: основные операции методов и правила их выполнения; формулы для расчетов результатов анализа.
Иметь представление: о применении химических методов в анализе материалов алюминиевого производства и других металлургических объектов.
Уметь: выполнять операции гравиметрических и титрометрических определений, строить кривые титрирования, анализировать результаты определения.
Вопросы самоконтроля.
- Определите понятие гравиметрии: метод отгонки, выделения, осаждения. Приведите примеры.
- Какие способы разложения проб вы знаете?
- Осаждаемая и весовая (гравиметрическая) форма; требования к ним.
- Условия осаждения аморфных и кристаллических осадков.
- Какая точность взвешивания на аналитических весах?
- Расчеты навески, объема осадителя и результатов в гравиметрии.
- Требования к аналитическим реакциям.
- Дать понятие: «титр по рабочему веществу» и «титр по определенному веществу»
- Какие вещества называются исходными и как применяются в титриметрии. Приведите примеры.
- Приведите примеры определения методом нейтрализации, редоксометрии, комплексонометрии.
|
|
|
1.5 Физико-Химические методы АНАЛИЗА (ФХМА) страница 5.
1.5.1 Общие сведения.
Классификация ФХМА и их применение в аналитическом контроле металлургии;
Особенности и преимущества. Роль ФХМА в автоматизации и интенсификации и интенсификации аналитического контроля.
1.5.2 Фотометрический анализ.
Основные закономерности светопоглащения. Закон Бугера- Ламберта- Бера.
Светопропускание и оптическая плотность растворов. Фотоколориметрия и слектрофотометрия. Аппаратура методов(фотоэектроколориметриы и слектрофотометры); принципиальные схемы приборов, методика измерений.
1.5.3 Электрогравиметрия.
Сущность метода. Химические процессы при электролизе. Законы электролиза.
Напряжение разложения Плотность тока, и её значение при анализе.Электролиз с внешним источником токаи метод внутреннего электролиза. Аппаратура метода и техника выполнения анализа.
1.5.4 Потенциометрия и ионометрия.
Сущность метода и область применения. Электродный потенциал. Схема установки для потенциометрических изменений (компенсационный некомпенсационный метод).
Индикаторные электроды. Электроды сравнения. Ионоселетивные электроды. Прямая потенциометрия и потенциометрическое титрование. Кривые титрования (интегральная и дифференциальная).Аппаратура и техника выполнения анализа.
1.5.5 Вольтамперометрия (полярография)
Сущность метода. Вольтамперная кривая. Предельный ток Зависимость диффузного тока от концентрации. Способы получения результата анализа. Амперометрическо титрование.
1.5.6 Кондуктометрия.
Сущность метода и область применения. Аппаратура в кондуктометрии. Кондуктометрическое титрования. Высокочастотное титрование.
1.5.7 Хроматографический анализ.
Классификация методов.
Сорбционные процессыв динамических условиях. Газовая,жидкостная и газожидкостная хроматография. Бумажная и ионообменная хроматография.
Приципиальная схема хроматографа.
Знать: классификацию методов, основные теоретические основы; аппаратуру методов, основные теоретические основы; аппаратуру методов, их принципиальные схемы и методику выполнения измерений.
Иметь представление: о применении методов в аналитическом контроле объектов металлургического производства.
|
|
|
Уметь: составлять схемы приборов, объяснить правила работы на них.
Вопросы самоконтроля:
1 Значение и области применения физико-химических методов анализа.
2 Классификация методов. На чём она основана?
3 Какие величины связывает основной закон светопоглащения?
4 Физический смысл оптической плотности раствора и математическое выражение величины.
5 Способы получения окрашенных растворов.
6 Назначение светофильтров и правила выбора их.
7 В чём различие измерения оптической плотности на двух и однолучевом колориметре?
8 В чём принципиальное различие фотоэлектроколориметрии и спектрофотометрии?
9 На чём основаны электрогравиметрические измерения?
10 Законы Фарадея. Электрохимический эквивалент вещества.
11 Какие химические процессы происходят на электродах при электролизе водных растворов солей Na CL; Ag NO3; In SO4?
12 Какие методы проведения анализа применяются в электрогравиметрии?
13 Природа электродного потенциала и его зависимость от концентрации потенциалопределяющих ионов.
14 Записать уравнение Неранста для окислительно-восстановительных систем: I2/2I- ; [Fe(CN)6]-3 /[Fe(CN)6]4 ; Fl 3+ / Al; MnO4- / Mn 2+
15 Электроды потенциометрии и классификация и назначения. Конструктивные особенности электродов.
16 Прямая потенциометрия. Как рассчитать концентрацию вещества по значению ЭДС электродной пары?
17 Потенциометрическое титрование. Определение точки эквивалентности.
18 Измерение потенциала индикаторного электрода компенсационным и не компенсационным методом. Схемы измерения. Какие приборы используются для измерений?
19 В чем сущность полярографического анализа?
20 Принципиальная схема полярографической установки.
21 Электропроводность и ее зависимость от концетрации раствора.
22 Схема уравновешенного моста для кондуктометрических определений.
23 Кривые кондуктометрического титрования.
24 Высокочастотное титрование, преимущества и схема установки.
25 Какой метод анализа называется хроматографическим анализа.
26 Какие физические явления лежат в основе хроматографического анализа.
27 Сущность бумажной хроматографии.
28 Коэффициент распределения и его роль при хроматографическом разделении ионов.
29 Приведите схематически процесс ионного обмена на катионите и анионите.
30 В чем заключается регенерация ионитов.
1.6 Физические методы анализа
1.6.1 Атомно-эмиссионный спектральный анализ.
Сущность метода. Источники возбуждения спектров. Приборы для спектрального анализа. Качественный и количественный спектральный анализ. Уравнение Ломакина-Шайбе. Метод трех этолонов. Применение спектрального анализа для контроля состава руд, сплавов и металлов.
1.6.2 Атомно-абсорбционный спектральный анализ.
Сущность и область применение метода. Источники резонансного излучения,
Аппаратура и техника проведения анализа.
1.6.3 Рентгеноспектральный анализ.
Основы рентгеноспектрального анализа.Ренгеновские спектры.Источники ренгеновского излучения, Флуоресцентный анализ. Аппаратура и техника выполнения анализа.
Знать: теоретические основы и сущность физических методов анализа, метрологические характеристики, название и принцип работы приборов, их конструктивные особенности.
Иметь представление: о роли методов в совершенствовании аналитического контроля и управлении качеством продукции в условиях промышленного производства
Уметь: составлять схемы приборов и объяснять принцип действия и правила работы на них.
1.Как возникают спектры испускания? Написать уравнение для расчета энергии кванта света.
2.Составте принципиальную оптичесую схему спектрального прибора.
3.Основные узлы спектрального прибора их виды и значение.
4.Напишите уравнение Ломакина-Шайбе экспоненциальной и логарифмической форме.
5.Опишите кратко метод трех эталонов.
6.На каком принципе основан атомно-абсорбционный анализ?
7.Как связана оптическая плотность пламени с концентрацией анализуемого элемента в нем?
8.Какие источники излучения применяются в атомно-абсорбционных спектрофотометрах?
9.В чем состоит назначение автомизатора в атомно-абсорбционном спектрофотометре?
10.Каково назначение дифракционной решетки в атомно-абсорбционных установках?
11.В чем состоит сущность рентгеноспектрального анализа?
12.Что является качественной и количественной характеристикой элемента в рентгеноспектральном анализе?
13.Как возникает рентгеновское излучение?
14.Как выделяется аналитические линии определяемых элементов?
15.Как принципиально устроен локальный рентгеновский микроанализатор?
2. Методические указания.
Самостоятельное излучение дисциплины «Аналитический контроль в металлургическом проиводстве» рекомендуется вести следующим образом:
- прочитать по программе содержание изучаемой темы, уяснить ее объем и последовательность освещаемых вопросов.
-прочитать методические указания, относящиеся к данной теме.
- Внимательно ознакомиться по учебнику с материалом темы и разобраться в сущности излагаемых в учебнике вопросов,
При проработки материала студент-заочник должен изучить теоритические основы дисциплины. Теория аналитической химии представляет собой дальнейшее развитие и углубление теоретических основ общей химии для целей химического анализа. Поэтому перед излучением дисциплины необходимо повторить некоторые разделы общей химии: закон действующих масс, теория электролитической диссоциации, гидролиз, амфотерность, строение комплексных соединений, окислительно-восстановительные реакции. При изучение физико-химических и физических методов повторить разделы курсов физики и физической химии на теории которых эти методы базируются. В методических указаниях далее по разделам дисциплины после краткого теоритического введения приведены решения задач, которые помогут в выполнение контрольных заданий. При рассмотрение содержания дисциплины обратите внимание на вопросы самоконтроля. Составьте краткий конспект по разделам дисциплины, отвечая на вопросы. Конспект является формой отсчета о самостоятельной работе студента.
Выполняется одна контрольная работа, в которую включены задания по основанным разделам дисциплины. Номер варианта контрольной работы соответствует последней цифре присеваемого студенту шифра.
НАРИМЕР: шифр 9904 соответствует номерам заданий 4, 14, 24, 34, 44 … 124
Контрольная работа выполняется в отдельной тетради. Приводится полная и краткая форма записей условий заданий. При решение задач необходимо ссылаться на используемые формулы законов, уравнений, давать пояснения к отдельным этапам расчётов, делать выводы.
2.1 Теоретические положения.
Приступая к выполнению заданий данного раздела необходимо самостоятельно поработать по учебным пособиям, основные вопросы теории аналитической химии:
ионные равновесия в растворах кислот, основании, гидролизующихся солей, труднорастворимые соединения, процессы окисления-восстановления, комплексные соединения, выражение концентрации растворов.
Значение физико-химических констант, необходимых для решения задач приводятся в справочной литературе.
Свойство растворов, зависят от их состава, который принято выражать через пять основных видов концентрации
Молярная концентрация
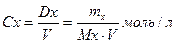
Где: Dx- количество веществ, моль
mx- масса веществ
Mx- молярная масса
V- объем
Молярная концентрация эквивалентности

Где: fэквx- фактор эквивалентности
М(fэквx) – молярная масса экивалента вещества
Молярная концентрация
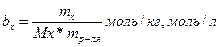
Где:mр-ля- масса раствортеля
Титр
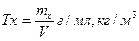
Массовая доля
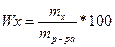
Где: mр-ра- масса раствора
ПРИМЕРЫ решений типовых заданий
ПРИМЕР 1. Рассчитать константу и степень диссоциации, водородный показатель 0,5 М раствора гидроксида с концентрацией ионов гидроксида 0,003 моль/л
Дано:
CNH4OH=0.5 моль/л
СOH=0.003 моль/л
Найти:
 NH4OH; KNH4OH; pH.
NH4OH; KNH4OH; pH.
Решение:
Уравнение диссоциации гидроксида аммония
NH4OH↔NH4++ OH-
Степень диссоциации рассчитывается по формуле
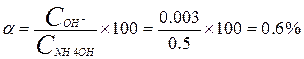
Выражение константы диссоциации
KNH4OH= 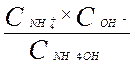
COH-= 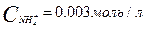
CNH4OH (равновесная) = CNH4OH (исходная) – СOH-=0.5-0.003=0.497 моль/л
KNH4OH= 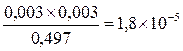
Водородный показатель рассчитывается по формуле
pH=14-pOH=14-(-LgCOH-)=14-(-0.477+2)=12.48
ПРИМЕР 2. Рассчитать pH и степень гидролиза 0,1М раствора нитрата серебра константа гидролиза по первой ступени равна 7,94*10-8
Дано:
Cpb(NO3)2=0.1 моль/л
K 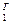 =7,94
=7,94 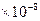
Найти:
pH, 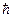
Решение
Соль Pb(NO3)2 в одном растворе нацело диссоциирована на ионы и подвергается гидролизу по катиону ступенчато
Pb2+ + HOH 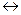 PbOH+ + H+ 1 cтупень
PbOH+ + H+ 1 cтупень
PbOH+ + HOH 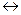 Pb(OH)2
Pb(OH)2 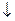 + H+ 2 ступень
+ H+ 2 ступень
Соли гидролизируются в основном по первой ступени. KI больше KII в 1000 раз, поэтому вторую ступень гидролиза можно не учитывать
CH+ = CpbOH+ = X
Cpb2+ = 0.1 – X
Подставим значение в выражения константы гидролиза
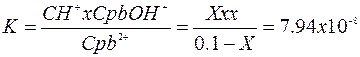
Из уравнения видно, что значение х очень мало, поэтому пример 0,1 –х=0,1
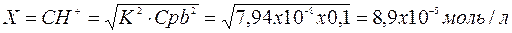
Рассчитаем водородный показатель раствора


Рассчитаем степень гидролиза
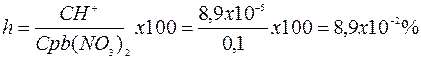
ПРИМЕР 3. Какой осадок выпадает раньше, если к раствору, содержащему ионы Cl и 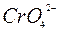 c концентрацией 0,1 моль/л добавлять по каплям раствор нитрата серебра?
c концентрацией 0,1 моль/л добавлять по каплям раствор нитрата серебра?
Решение:
Образованию осадков соответствуют ионно-молекулярные уравнения
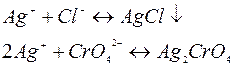
Очевидно, раньше выпадает осадок для образования, которого нужна меньшая концентрация ионов серебра.
Выпадение осадка начнется при достижении системой равновесного состояния.
Равновесие в системе<<осадок-раствор>> характеризуется постоянной величиной произведения растворимости (ПР), значение которой берется из справочной литературы.
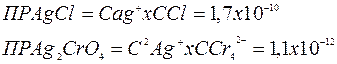
Рассчитаем концентрации ионов Ag+для образования осадков: для хлорида серебра:

Для хромата серебра
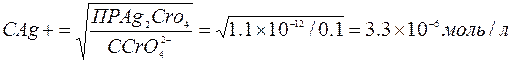
Первым выпадает осадок AgCl, т.к. для его образования нужна в 500 раз меньшая концентрация ионов серебра.
2.2 Химический качественный анализ
В данном разделе изученные теоретические положения необходимо применить при рассмотрение общих сведений о методах качественного химического анализа является установление химического состава анализируемого вещества, т. е. обнаружение катионов и анионов необходимо по учебной литературе изучить способы выполнения качественных определений, рассмотреть сущность аналитических (частных) реакций ионов, и требования к ним, содержание дробного и систематического анализа.
Классификация ионов по аналитическим группам основана на химических свойствах и их соединений и связанна с положением элементов в периодической системе Д. И. Менделеева.
Студентам предлагается изучить кислотно-щелочную схему качественного определения ионов.
Таблица 1 Аналитические группы катионов.
| Группа | Катион | Групповой реактив | Краткая характеристика |
| Первая | K+,Na+,NH+4 | отсутствует | |
| Вторая | Ag+,Hg22+,Pb2+ | HCL | Хлориды нерастворимы в воде |
| И разбавляемых кислот | |||
| Третья | Ba2+, Са2+ | H2SO4 | Сульфаты нерастворимых в воде и разбавленных растворах кислот |
| Четвёртая | Al3+, Cr3+, Zn2+ | NaOH Избыток | Гидроксиды растворимы в избытке щелочи |
| Пятая | Fe2+,Fe3+,Mn2+,Mg2+ | NaOH | Гидроксиды нерастворимы в избытке щелочи и аммиака |
| Шестая | Cu2+,Hg2+ | Водный раствор аммиака | Гидкроксиды нерастворимы в щелочи, но растворимы в избытке аммиака |
Кислотно-щелочные схема основана на различной растворимости хлоридов, сульфатов, гидроксидов и аммиаков металлов.
2.3 Химические методы количественного анализа.
Количественным анализам называют метод исследования вещества, который позволяет определить, в каких количественных соотношениях находятся входящие в него элементы. К химическим методам относятся гравиметрический (весовой) и титриметрический (объемный) методы анализа.
2.3.1 Гравиметрический метод анализа
Гравиметрическим анализом называют метод химического анализа. Основанный на точном измерении массы определяемого компонента пробы, выделяемого в химически чистом виде или в виде химического соединения точно известного постоянного состава.
Масса измеряется прямым взвешиванием на аналитических весах с точностью 0,0002г.
Методы гравиметрии делятся на три вида:
§ Метод выделения – анализируемую составную часть пробы выделяют в свободном состояние и взвешивают (определение золы, нерастворимых примесей и др.)
§ метод отгонки – анализируемую составную часть пробы количественно удаляют в виде летучего соединения и о его содержании судят по убыли массы вещества, взятой для анализа (определение влаги и др.)
§ Метод осаждения – анализируемую составную часть пробы количественно связывают в химическое соединение, в виде которого она отделяется от других компонентов и после соответствующей обработки взвешивается (определение серы в виде BaSO4, хлора в виде AgCL и др.)
В гравиметрии используются реакции обмена замещения, разложения, комплексообразования. Техника выполнения операции анализа и необходимое оборудование рассматривается по учебным пособиям.
Учение об осадке является центральным пунктом всего анализа. Различают кристаллические и аморфные аморфные осадки. Природа осадка определяет массу навески пробы и условия осаждения.
Химическое соединения, в виде которого анализирует компонент выделяется из пробы называется осаждаемой формой, а виде которого взвешивается---гравиметрической (весовой) формулой.
По химическому составу они могут совпадать (BaSO) или быть различными (Fe(OH)3uFe2O3)
При расчетах гравиметрии необходимо учитывать эквивалентное соотношения масс определяемой части, весовой и осаждаемой формы. Для этого в расчетах используют постоянную величину –анимистический фактор(множитель).
Аналитический фактор(F)---отношение молярных масс эквивалентов определяемой части(о.ч.)и весовой (в.ф.)
 В.Ф
В.Ф 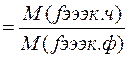
Где:Fo.Ч./в.ф.--аналитический фактор
M(fээкв х)-- молярная масса эквивалента, г/моль
Fээкв х – фактор эквивалентности
НАПРИМЕР-аналитический фактор определяемого компонента магния по весовой форме нирофосфата магния


Практически аналитический фактор находят делением молярной массы вещества
Определяемой части на молярную массу вещества весовой формы с учетом
Коэффициентов, уравнивающих число атомов в соединениях
НАПРИМЕР:
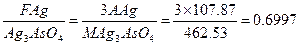
Примеры решения типовых задач:
ПРИМЕР 1: Расчет массы навески вещества
Рассчитать массу навески железного купороса для определения содержания железа в виде гравиметрической формы Fe2O3
Навеска - небольшое количество анализируемого вещества взятого для выполнения
аналитических операций.
Масса навески определяется методом гравиметрии и природой осадка.
В методах выделения и отгонки масса навески должна быть такой, чтобы масса
Выделенной или удаленной части составила 0,1г.
В методе осаждения масса навески должна быть такой, чтобы масса весовой
Формы для аморфных осадков составила 0,1 + 0,3г, для кристаллических осадков –
0,5г.
Дано:
FeSO4 ·7H2O
Найти:
mн. -?
Решение:
Железо осаждается в виде аморфного осадка Fe(OH)3
Примем массу весовой формы 0,2г.
Составим уравнение реакции
FeSO4 + 2NH4OH =Fe(OH)2 + (NH4)2SO4
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
На основании стехиометрических уравнений составим пропорцию
2мольFeSo4·1H2O_____________Fe2O3
2·271=_______________________159.7г
x 0.2г
X = 
Масса навески около 0,7г
ПРИМЕР 2: Расчет объема 0,25м раствора оксалата аммония для осаждения ионов
кальция из раствора полученного после растворения технического карбоната кальция массой 0,7г в кислоте
Дано:
C (NH4)2C2O4 = 0, 25 моль/ л
mн= 0.7г
Найти: V(NH4)2C2O4 = CaC2O4 + 2NH4Cl
На основании стехиометрических уравнений составим пропорцию
1мольCaCo3________________1моль(NH4)2C2O4
100.1г_____________________124.1г
0.7г______________________ X
X= 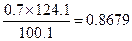
Рассчитаем, в каком объеме 0, 25м оксалата аммония содержится необходимая его масса.
Молярная концентрация вещества рассчитывается по формуле:
C(NH4)2C2O4= 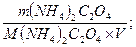
V(NH4)2C2O4= 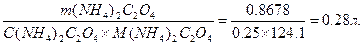
Осадитель всегда берётся в избытке:
Для летучих осадителей – 150,200%
Для летучих- 50%
V(NH4)2C2O4=1.5 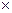 0.028=0.042л.
0.028=0.042л.
Пример 3:Расчёт результата анализа.
Вычислить массовые доли алюминия и магния в дуралюмине, если из массы навески 0,5г. получены прокаленные осадки 0,8937г. Al2O3 и 0,0091г. Mg2P2O7
Расчёты результата аналза сводятся к определению массы определяемого компонента весовой форме и соотношению с массой навески.
Wx= 
Где: mx – масса определяемого компонента
mн.ф.- Масса навески
Масса определяемого компонента рассчитывается через аналитический фактор
mx= mb.ф. 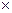 F оч/вф
F оч/вф
Общая формула расчёта
Wx= 
Дано:
m вфA2O3=0.8937
m вфM2P2O7=0,0091
mн=0,5г.
Найти:
WAl-?
WMg-?
Решение:
Рассчитаем аналитический фактор
F 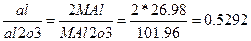
F 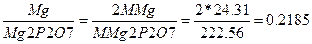
Рассчитаем массовые доли компонентов

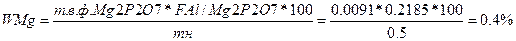
2.3.2 Титриметрический метод анализа.
Основан на точном измерение объемов растворов реагирующих веществ, один содержит
анализируемое вещество, а концентрация второго точно известна.
Раствор с точно известной концентрацией называется стандартным или
титрованным растворам (титрантом).
Для изучения данного раздела необходимо из курса общей химии повторить
понятия: молярная масса эквивалента, закон эквивалентов, способы выражения состава
растворов.
Методы титрического анализа разнообразны и могут быть классифицированы по
природе рабочего раствора:
- методы кислотно-основного титрования (нейтрализации)
- методы редоксидиметрии (перманганататометрия и др.)
- методы осаждения
- методы комплексообразования
При изучение отдельных методов объемного анализа, необходимо усвоить
растворы каких веществ используются в качестве рабочих, а также способы их
приготовления и хранения. Необходимо знать реакции, лежащие в основе изучаемых
методов, рабочие и исходные вещества, индикаторы методов.
Расчеты в титриметрическом методе анализа, как и в гравиметрическом,
основаны на законе эквивалентов, с тем лишь различием, что в расчеты вводятся
концентрации и объемы веществ.
При выполнение расчетов студенты сталкиваются с понятием «титр рабочего
раствора» и «титр рабочего раствора по определенному веществу».
Определим эти понятия.
Титр рабочего раствора- это масса вещества, содержащаяся в 1мл раствора

титр рабочего раствора по веществу показывает какой массе определяемого
вещества(г) эквивалентна масса рабочего вещества, содержащегося-в 1 мл раблчего
вещества.
НАПРИМЕР: при титровании соды соляной кислоты рассчитываем:


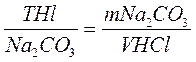
Рассчитать эту величину можно, зная молярную концентрацию эквивалента
(нормальность) раствора.

Где: Тр.р./о.в.- титр рабочего раствора по определенному веществу, г/мл
C(fэкв.р.р.)- молярная концентрация эквивалента определяемого вещества, моль/л
M(fэкв.о.в.)- молярная масса эквивалента определяемого вещества, г/моль
Приготовление растворов в объемном анализе связанно с расчетом количества
исходного вещества, необходимого для приготовления раствора заданной
концентрации. Для этого рассчитываем массу навески сухого вещества или объем
концентрированного раствора, из которого готовят требуемый раствор разбавлением.
ПРИМЕР4: РАССЧИТАТЬ МАССУ НАВЕСКИ СУЛЬФАТА меди для приготовления 250мл 2м раствора.
Дано:
Vp-pa=0.25л
С(1/2CuSO4 5H2O) = 2моль/л
Найти:
mCuSO4 5H2O
Решение:
С(1/2CuSO4 5H2O) = 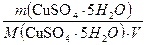
M(1/2CuSO4 5H2O) = 125г/моль
mCuSO4 5H2O = 2 0.25 = 62.5г
ПРИМЕР5: рассчитать объем концентрированный серной кислоты для приготовления 0,5н объемом 0,5л
Дано:
Vp – pa =0.5л
С(1/2H2SO4)=0.5моль/л
PH2SO4=1.84г/см3
W%H2SO4=96%
Найти:
VH2SO4 -?
Решение:
Расчет массы сухого вещества:
mH2SO4=C(1/2H2SO4) M(1/2H2SO4) V= 0.5 49 0.5 = 12.25г
Пересчитаем на объем 96% раствора:
VH2SO4= 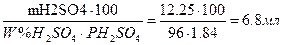
Точную концентрацию титрируемого (в частном случае стандартного) раствора рассчитывают по данным титрования, исходя из основного положения титриметрического анализа:
- объемы растворов веществ, нацело реагирующих между собой обратно пропорциональны молярным концентрациям эквивалентов этих веществ в растворах 
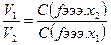
ПРИМЕР 6: навеска оксалоты натрия массой 1,2500г растворена в мерной колбе на 250мл. На титровании 25мл устанавливаемого раствора KMnO4 расходуется 21,2мл оксалата натрия (Na2C2O4)
Определить молярную концентрацию эквивалента перманганата
Дано:
mNa2С2О4 = 1.2500г
Vмм = 250мл
VaNa2C2O4 = 25мл
|
|
|


