 |
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
|
|
|
|
ЛЕКЦИЯ № 8
ТЕМА: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Вопросы:
Понятие ОВР.
Типы ОВР.
Типичные окислители и восстановители.
Окислительно-восстановительные свойства кислот.
Составление уравнений ОВР методом электронного баланса и методом полуреакций.
Понятие ОВР.
Все химические реакции можно разделить на два типа.
– к первому типу относятся реакции, которые идут без изменения степени окисления атомов реагирующих веществ. Это реакции обмена и некоторые реакции соединения и разложения. Например:
 |
В этих случаях степень окисления каждого из атомов до и после реакции остается без изменения.
– ко второму типу относятся реакции, которые идут с изменением степени окисления атомов реагирующих веществ.
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Это реакции замещения, а также некоторые реакции соединения и разложения. Например:
Например, в реакции:
| – замещения | 
|
медь н железо изменяют свои степени окислении: степень окисления меди понижается от + 2 до 0, степень окисления железа повышается от 0 до + 2. Ион меди (II) присоединяет два электрона – восстанавливается:
 – процесс восстановления
– процесс восстановления
Атом железа отдает два электрона – окисляется:
 – процесс окисления
– процесс окисления
| – соединения – разложения | 
|
Окислительно-восстановительная реакция — это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление - это процесс потери электронов атомом, молекулой или ионом.
|
|
|
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Окислителем называется вещество, атомы, молекулы или ионы которого присоединяют электроны:
 |
Окислитель восстанавливается в процессе восстановления. Восстановителем называется вещество, атомы, молекулы или ионы которого отдают электроны:
 |
Восстановитель окисляется в процессе окисления. Например:
 |
Так как электрон заряжен отрицательно, то при окислении степень окисления (окислительное число) атома изменяется в положительную сторону, а при восстановлении — в отрицательную.
При рассмотрении ОВР очень важным является понятие степень окисления атома.
Cтепень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что данный атом связан с другими ионной связью.
Это формальная величина, подсчитываемая исходя из формулы соединения при условном допущении, что данный атом связан с другими ионной связью. В силу формального подхода, можно не принимать в расчет действительный тип связи и не учитывать, переходят ли электроны с одного атома на другой или только смещается электронное облако общей электронной пары. В высших степенях окисления все элементы склонны образовывать соединения с ковалентной связью между атомами этого элемента и другими атомами, а не ионной. Так, в ионе МпО4- связь между атомами кислорода и марганца — ковалентная полярная, и заряд на атоме марганца отнюдь не +7 (как степень окисления, подсчитанная по формальным правилам), а гораздо меньше. Поэтому, говоря, что при восстановлении Мп(+7) до Мп(+2) атом этого элемента принимает 5 электронов, мы допускаем большую условность. Правильнее говорить, что ион МпО4- превращается в ион Мп2+, совершенно не касаясь при этом вопроса о том, каковы заряды на атомах Мп и О в ионе МпО4-. Число же электронов, которые переходят от восстановителя к окислителю при таком превращении, равно пяти - в этом мы убедимся позже. Таким образом, применяя заведомо условный, формальный подход (степень окисления), мы тем не менее получаем верный количественный результат (число электронов, переходящих от восстановителя к окислителю).
|
|
|
Типы ОВР
Различают четыре типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, реакции диспропорционирования и конпропорционирования.
1. Межмолекулярные ОВР - это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:
 |
ОВР такого типа встречаются чаще всего.
2. Внутримолекулярные ОВР - это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления.
Например:
 |
3.Реакции диспропорционирования (дисмутации) - это реакции, которые идут с изменением степени окисления одинаковых атомов в молекуле (или молекулах) одного и того же вещества.
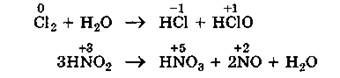 |
Такие реакции возможны для веществ, в которых данный элемент имеет промежуточную среди возможных для него степень окисления, и потому его атомы могут выступать в роли как окислителя, так и восстановителя.
4.Реакции конпропорционирования (конмутации) — это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей степени окисления, промежуточной между исходными степенями.
При этом атом, находящийся в более высокой степени окисления, выступает в роли окислителя, а находящийся в более низкой степени окисления – в роли восстановителя.
Реакции конпропорционирования могут быть как:
– межмолекулярными
 |
–  так и внутримолекулярными
так и внутримолекулярными
Реакции диспропорционирования и конпропорционирования иногда объединяют общим названием реакции самоокисления-самовосстановления.
|
|
|


