 |
Особый тип ММВ – водородные связи.
|
|
|
|
Межмолекулярное взаимодействие (ММВ).
Под термином межмолекулярное взаимодействие понимают любые процессы ведущие к образованию как агрегатов, состоящих из нескольких молекул исходных веществ, так и агрегатов, образованных огромным числом молекул. Первый тип взаимодействия приводит к образованию n-меров (ди-, три- и т.д.), другой определяет состояние и вероятность системы, состоящей только из молекул данного вещества. Механизмы ММВ отличны, но результат один – понижение внутренней энергии системы и уменьшение энтропии, т.е. любое взаимодействие при изобарном процессе определяется энтальпийным фактором.
Любая реальная газовая система отличается от модели идеального газа. Установлено, что реальные и идеальные системы могут быть согласованы, если предположить, что молекулы взаимодействуют друг с другом и энергия этого взаимодействия строго индивидуальна и значительно меньше энергии связей атомов в молекулах. Для согласования уравнений состояния идеальных и реальных газов Ван-дер-Ваальс вводит поправочное слагаемое в уравнения, учитывающие межмолекулярные взаимодействия и показывает, что последние играют существенную роль в процессах расширения газов, конденсации, адсорбции, растворении и т.д. Этот тип межмолекулярного взаимодействия получил название сил Ван-дер-Ваальса. В настоящее время показано, что они действуют в молекулярных веществах, находящихся в газообразном, жидком и твердом состояниях. Данные силы имеют электростатическую природу и являются результатом действия трех эффектов – ориентационного, индукционного и дисперсионного.
Ориентационный эффект.
Возникает только между полярными молекулами, которые обладают собственным дипольным моментом: молекулы вещества ориентируются друг к другу разноименными полюсами и возникает упорядоченная структура. Энергия ориентационного взаимодействия может:
|
|
|
Еор = – 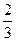

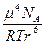 = –
= – 
где m – собственный дипольный момент молекулы, r – расстояние между центрами диполей, NА – число Авогадро, R – универсальная газовая постоянная, Т – абсолютная температура.
ЕОР тем больше, чем больше значение m и чем меньше величина r. При этом, с ростом Т ЕОР уменьшается, так как усиливающееся тепловое движение нарушает взаимную ориентацию диполей. Вклад Еор в суммарное межмолекулярное взаимодействие велик для молекул, обладающих большим дипольным моментом (H2O, NH3 и т.д.)
Индукционный эффект.
Этот эффект возникает также только в том случае полярных молекул (для индивидуальных веществ), когда диполь-дипольное взаимодействие приводит к увеличению μ взаимодействующих молекул. За счет взаимной деформации происходит смещение центров положительного и отрицательного заряда диполей. Как показал Дебай Еинд может быть рассчитана по формуле:
Еинд = – ( ) = –
) = – 

Где α – поляризуемость (деформируемость) молекулы.
Еинд возрастает с ростом μ и деформируемости молекул и быстро падает при увеличении расстояния между ними. В то же время Еинд от Т не зависит, так как наведение липолей происходит при любом пространственном расположении молекул. Еинд в 10-20 раз меньше Еор. Более или менее ощутимое влияние индукционного взаимодействия наблюдается только для частиц, обладающих большой поляризуемостью. Например, вклад Еинд в суммарную энергию межмолекулярного взаимодействия для NH3 выше, чем для H2O. Это объясняется тем, что поляризуемость молекул NH3 ше, чем молекул Н2О, хотя μ(NH3)<μ(H2O).
Дисперсионный эффект.
Этот эффект реализуется при взаимодействии любых атомов и молекул, независимо от строения и полярности, т.е. он является универсальным. В рамках квантовомеханических представлений дисперсионный эффект объясняется синхронизацией мгновенных диполей взаимодействующих частиц (Дебай 1920). Рассмотрим систему, состоящую из ядра и движущихся электронов. В любой момент времени вследствие несовпадения центров электронных облаков и ядра такая система представляет собой мгновенный диполь. Число таких диполей равно числу электронов системы. Электрическое поле мгновенных диполей атомов и молекул индуцирует мгновенные диполи в соседних частицах. Каждый из диполей будет влиять на ориентацию подобных мгновенных диполей, возникающих в близлежащих молекулах. В результате этого движение многих мгновенных диполей перестает быть независимым и становится синхронным. Их появление и исчезновение в разных молекулах происходит в такт друг другу. В результате частицы испытывают притяжение друг к другу и энергия системы снижается.
|
|
|
Едис = – 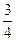
 = –
= – 
Где h – постоянная Планка, √о – частота колебаний, отвечающих
нулевой энергии, присущая каждому атому или молекуле при ОоК.
Приближенно һ√ о= I1, тогда
Едис = – 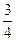
 = –
= – 
Складывая все три составляющие Ван-дер-Ваальсовых сил получим:
Е = - 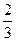
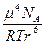 –
–  –
– 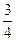
 = –
= – 
Где К = А+В+С.
Величина вклада отдельных составляющих в суммарном эффекте зависит от состава и структуры молекул. Причем, наиболее существенными для межмолекулярного взаимодействия являются такие их свойства как полярность и поляризуемость. Чем выше полярность молекул, тем значительнее роль ориентационных сил. В то же время с ростом поляризуемости возрастает дисперсионный эффект. Индукционный эффект зависит от обоих факторов, но сам по себе имеет лишь второстепенное значение.
Энергия межмолекулярного взаимодействия и ТкипоС
| вещество | μ (D) | Поляризу-емость | Эффект в ккал ⁄ моль | Е∑ | ТкипоС | ||
| Eop | Еинд | Едис | |||||
| H2 | 0,20 | 0,04 | 0,04 | 20,21 | |||
| Ar | 1,63 | 2,03 | 2,03 | ||||
| Xe | 4,00 | 4,40 | 4,40 | ||||
| HCl | 1,03 | 2,63 | 0,79 | 0,24 | 4,02 | 5,05 | |
| HBr | 0,78 | 3,58 | 0,26 | 0,17 | 6,80 | 7,23 | |
| HI | 0,38 | 5,40 | 0,14 | 0,075 | 14,47 | 14,56 | |
| NH3 | 1,5 | 2,21 | 3,18 | 0,37 | 7,07 | 7,07 | 239,6 |
| H2O | 1,84 | 1,48 | 8,69 | 0,46 | 11,30 | 11,30 |
Cуммарная энергия межмолекулярного взаимодействия очень мала по сравнению с энергией ковалентной связи – она, зачастую, меньше энергии ковалентной связи в 10–100 раз. Температуры плавления веществ, образованных неполярными молекулами возрастают по мере увеличения деформируемости образующих систему частиц. Например, при нормальных условиях F2, Cl2 – газы, Br2 – жидкость, J2 – твердое вещество. Учет межмолекулярных Ван-дер-Ваальсовых сил необходим и в других случаях, например, при расчете теплоты плавления, сублимации и т.д.
|
|
|
Особый тип ММВ – водородные связи.
|
|
|


