 |
Специфические свойства азотной кислоты
|
|
|
|
АЗОТ И ЕГО СОЕДИНЕНИЯ
Азот
Аммиак
Соли аммония
Оксиды азота
Азотистая кислота
Азотная кислота
Разложение нитратов
ПОДГРУППА АЗОТА
АЗОТ
N
:NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна s- и две p- связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Получение
1. Промышленный способ. Перегонка жидкого воздуха.
2. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°® N2 + 2H2O
Химические свойства
Молекула азота (:NºN:)
Очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью.
Восстановитель N20 ® 2N+2
Высокая температура (электрическая дуга, 3000°С)
N20 + O2 «2N+2O
(в природе - во время грозы)
Окислитель N20 ® 2N-3
1. c водородом (500°С, kat, p)
N20 + 3H2 «2N-3HЗ
2. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20 ® 2LiЗN-3
3Mg + N20 –t°® MgЗN2-3
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
АММИАК
NH3
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.

Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
r по воздуху = MNH3 / M ср.воздуха = 17 / 29 = 0,5862
t° кип.= -33,4°C; t°пл.= -78°C.
|
|
|
Молекулы аммиака связаны слабыми водородными связями

Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
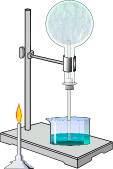
Получение
1. Промышленный способ
N2 + 3H2 ® 2NH3
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 –t°® CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH –t°® K2SO4 + 2NH3 + 2Н2O

Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.

1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
NH3 + Н2O «NH4OH «NH4+ + OH-
2. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl ® NH4Cl
2NH3 + H2SO4 ® (NH4)2SO4
NH3 + H2O + CO2 ® NH4HCO3
Аммиак - восстановитель (окисляется до N2+1O или N+2O)
1. Разложение при нагревании
2N-3H3 t°® N20 + 3H2
2. Горение в кислороде
a) без катализатора
4N-3H3 + 3O2 ® 2N20 + 6Н2O
|
|
|
b) каталитическое окисление (kat = Pt)
4N-3H3 + 5O2 ® 4N+2O + 6Н2O
3. Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3 ® 3Cu0 + N20 + 3Н2O
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 ® NH4NO3(нитрат аммония)
2NH4OH + H2SO4 ® (NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl «NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая
NH4Cl t°® NH3 + HCl
NH4HCO3 ® NH3 + Н2O + CO2
b) если анион проявляет окислительные свойства
NH4NO3 –t°® N2O + 2Н2O
(NH4)2Cr2O7 –t°® N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a)
(NH4)2CO3 + 2НCl ® 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- ® 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ ® Н2O + CO2
b)
(NH4)2SO4 + Ba(NO3)2 ® BaSO4¯ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- ® BaSO4¯ + 2NH4+ + 2NO3-
Ba2+ + SO42- ® BaSO4¯
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O «NH4OH + HCl
NH4+ + Н2O «NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH –t°® NaCl + NH3 + Н2O
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
ОКСИДЫ АЗОТА
N2+1O
ОКСИД АЗОТА (I)
ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ"
N+2O
ОКСИД АЗОТА (II)
ОКИСЬ АЗОТА
N2+3O3
ОКСИД АЗОТА (III)
АЗОТИСТЫЙ АНГИДРИД
N+4O2
ОКСИД АЗОТА (IV)
ДВУОКИСЬ АЗОТА, ДИОКСИД АЗОТА
N2+5O5
ОКСИД АЗОТА (V)
АЗОТНЫЙ АНГИДРИД
Оксид азота (I)
N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
NH4NO3 –t°® N2O + 2Н2O
Химические свойства
1. Разлагается при 700°C с выделением кислорода:
2N2+1O –t°® 2N20 + O20
поэтому он поддерживает горение и является окислителем
2. С водородом:
N2+1O + H2 ® N20 + Н2O
3. Несолеобразующий
Оксид азота (II)
|
|
|
N+2O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 ® 4NO + 6H2O
2.
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
3.
N2 + O2 ® 2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + O2 ® 2NO2
2NO + Cl2 ® 2NOCl(хлористый нитрозил)
2. Окислитель
2N+2O + 2S+4O2 ® 2S+6O3 + N20
3. Несолеобразующий
Оксид азота (III)
N2+3O3 азотный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO «N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH ® 2NaNO2(нитрит натрия) + H2O
Оксид азота (IV)
N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
1.
2NO + O2 ® 2NO2
2.
Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид
с водой
2NO2 + H2O ® HNO3 + HNO2
4NO2 + 2H2O + O2 ® 4HNO3
со щелочами
2NO2 + 2NaOH ® NaNO2 + NaNO3 + H2O
2. Окислитель
N+4O2 + S+4O2 ® S+6O3 + N+2O
3. Димеризация
2NO2(бурый газ) «N2O4(бесцветная жидкость)
Оксид азота (V)
N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1.
2NO2 + O3 ® N2O5 + O2
2.
2HNO3 +P2O5 ® 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид
N2O5 + H2O ® 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом):
2N2O5 ® 4NO2 + O2
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
АЗОТИСТАЯ КИСЛОТА
HNO2 Азотистая кислота
H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
AgNO2 + HCl ® HNO2 + AgCl¯
|
|
|
Химические свойства
1. Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH ® NaNO2 + H2O
2. Разлагается при нагревании:
3HNO2 ® HNO3 + 2NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4 ® 2K2SO4 + I2 + 2NO + 2H2O
| 2I- - 2ē ® I20 | |
| NO2- + 2H+ + 1ē ® NO + H2O |
2I- + 2NO2- + 4H+ ® I20 + 2NO + 2H2O
4. Сильный восстановитель:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
АЗОТНАЯ КИСЛОТА
HNO3 Азотная кислота
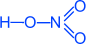
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3
Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) –t°® KHSO4 + HNO3
2. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt® 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2
2NO + O2 ® 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O «4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 «H+ + NO3-
Реагирует:
с основными оксидами
CuO + 2HNO3 ® Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- ® Cu2+ + 2NO3- + H2O
или CuO + 2H+ ® Cu2+ + H2O
с основаниями
HNO3 + NaOH ® NaNO3 + H2O
H+ + NO3- + Na+ + OH- ® Na+ + NO3- + H2O
или H+ + OH- ® H2O
вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 ® 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- ® 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- ® H2O + CO2
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании
4HNO3 –t°,hn® 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 ® соль азотной кислоты + вода + газ
| HNO3 | ||||
| / | \ | |||
| концентрированная | разбавленная | |||
| ¯ | ¯ | ¯ | ¯ | ¯ |
| Fe, Al, Cr, Au, Pt пассивирует (без нагревания) | с тяжелыми металлами NO2 | со щелочными и щел.зем. металлами N2O | с тяжелыми металлами NO | со щелочными и щел.зем. металлами, а также Sn и Fe NH3 (NH4NO3) |
| HNO3 + 4HCl | + Au ® H[AuCl4] + NO + 2H2O |
| "царская водка" (1:3 по объему) |
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 ® H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O ® 5NO + 3H3P+5O4
| НАЗАД | МЕНЮ | МЕНЮ: ПОДРАЗДЕЛ | ВПЕРЕД |
ПОДГРУППА АЗОТА
РАЗЛОЖЕНИЕ НИТРАТОВ
|
|
|


