 |
Особенности химических свойств
|
|
|
|
Железо и его соединения
План.
1) Особенности строения атомов. Железо как представитель переходных металлов.
2) Особенности физических свойств
3) Особенности химических свойств
4) Нахождение в природе
5) Получение
6) Применение железа
7) Соединения железа, их свойства и применение.
Особенности строения атомов. Железо как представитель переходных металлов.
Железо находится в 4 периоде, в 8 группе, побочной подгруппе, относится к d-элементам. Т.е. на внешнем 4-ом электронном слое находится два электрона, идет заполнение предпоследнего уровня, 3d-подуровня.
Электронная конфигурация железа 1s2 2s2 2p6 3s2 3p6 4s2 3d6
В химических процессах у атомов побочных металлов принимают участие не только s2-электроны последнего электронного уровня, но и электроны незавершенного d-подуровня. Такие электроны называют валентными. Как именно это происходит - зависит от конкретной конфигурации электронов (от энергии такой конфигурации).
Для железа, как и для почти всех d-элементов, возможна степень окисления +2. При этом атом железа «теряет» два электрона которые находятся у него на внешнем слое.
Т.е. у него остается 1s2 2s2 2p6 3s2 3p6 3d6
| 4s | 3d | 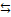
| 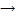
| 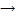
| 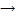
| 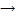
|
Такая конфигурация неустойчива. Напомним, максимально выгоден полностью заполненный слой (правило октета), потом - полностью заполненный подуровень, потом - наполовину заполненный подуровень). Значит степень окисления +2 будет для железа неустойчивой, нехарактерной. Потеряв еще один электрон железо приобретает наполовину завершенный подуровень 3d5 и стабильную степень окисления +3.
| 4s | 3d | 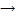
| 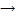
| 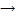
| 
| 
|
Возможны и другие степени окисления, но в школьном курсе такие соединения не изучаются, для железа они – экзотичны. Помните только, что железо может использовать при образовании соединений и остальные свои валентные электроны.
|
|
|
Физические свойства. Серебристо белый металл, проводит электрический ток и тепло, довольно мягкий, пластичный, ρ  7,8 г/см3, температура плавления около 1530
7,8 г/см3, температура плавления около 1530  (существуют несколько аллотропических модификаций железа обозначаемых греческими буквами), имеет магнитные свойства.
(существуют несколько аллотропических модификаций железа обозначаемых греческими буквами), имеет магнитные свойства.
Особенности химических свойств
Металл средней активности, восстановитель. Со слабыми окислителями железо окисляется до степени окисления +2, с сильными – до +3.
При нагревании (особенно в раздробленном состоянии) окисляется кислородом и другими неметаллами.
Fe + O2 → FeO∙Fe2O3 (Fe3O4 )
Fe + Cl2 → FeCl3
Fe + S → FeS
На воздухе в присутствии малейших следов влаги железо окисляется кислородом при обычной температуре. Этот процесс носит название «ржавление железа», а образовавшийся гидратированный оксид железа называют ржавчиной. А на химическом языке этот процесс, протекающий самопроизвольно при контакте железа с окружающей средой, принято называть коррозией.
Fe + H2O + O2 → Fe(OH)3 или Fe2O3∙nH2O
Окисляется железо и ионами водорода. Это может быть перегретый водяной пар или разбавленные растворы кислот. Обычно образуется смесь соединений со степенями окисления и +2 и +3. Можно сказать и иначе: образуются соединения со степенью окисления +2, которые кислородом воздуха легко окисляются до соответствующих соединений со степенью окисления +3.
Т.е. в отсутствие воздуха окисление разбавленными кислотами-неокислителями проходит по уравнению:
Fe + HCl → FeCl2 + H2
Концентрированные кислоты-окислители при нагревании окисляют железо до более высокой степени окисления
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Обратите внимание! Так эта реакция проходит при нагревании, а на холоду железо пассивируются, и с кислотами уже не взаимодействует. С растворами щелочей железо при н.у. тоже не взаимодействует.
|
|
|
Железо может окисляться ионами малоактивных металлов (Cu2+, Sn2+…):
Fe + Hg(NO3)2 → Hg+ Fe(NO3)2
Нахождение в природе
Содержание в земной коре – 5,1% по массе, второй после алюминия металл по распространенности. В свободном состоянии встречается только в составе метеоритов. А обычно - в виде соединений:
магнитный железняк (магнетит), Курская магнитная аномалия
красный железняк (гематит), Криворожский железно-рудный бассейн
бурый железняк,
шпатовый железняк, Керченское месторождение
железный колчедан (пирит)
Железо входит в состав живых организмов в виде сложных комплексных соединений с органическими веществами.
Получение

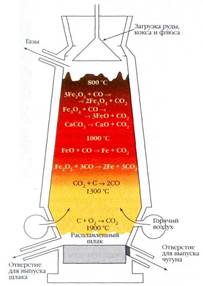
 1. Восстановлением из оксидов (доменный процесс). Суть процесса: Fe2O3 + С → Fe + СO2, т.е. восстановление оксида железа, содержащегося в железной руде, коксом. Третьим компонентом необходимым для доменного процесса являются флюсы (СаСО3), они переводят тугоплавкие пустые породы (SiO2) в легкоплавкие и легкие шлаки (силикаты). Процесс проводят в домнах (печи высотой обычн о около 25 м и диаметром до 10 м). Это непрерывный производственный процесс. Сверху засыпают шихту (кокс, руда, флюсы), снизу подают кислород. Восстановленное железо плавится и стекает в нижнюю часть печи – горн. Оттуда его периодически выпускают. Но это железо содержит много углерода. Т.е. в домнах получают не железо, а его твердый и хрупкий сплав – чугун.
1. Восстановлением из оксидов (доменный процесс). Суть процесса: Fe2O3 + С → Fe + СO2, т.е. восстановление оксида железа, содержащегося в железной руде, коксом. Третьим компонентом необходимым для доменного процесса являются флюсы (СаСО3), они переводят тугоплавкие пустые породы (SiO2) в легкоплавкие и легкие шлаки (силикаты). Процесс проводят в домнах (печи высотой обычн о около 25 м и диаметром до 10 м). Это непрерывный производственный процесс. Сверху засыпают шихту (кокс, руда, флюсы), снизу подают кислород. Восстановленное железо плавится и стекает в нижнюю часть печи – горн. Оттуда его периодически выпускают. Но это железо содержит много углерода. Т.е. в домнах получают не железо, а его твердый и хрупкий сплав – чугун.
Процесс удаления лишнего углерода из чугуна называют переделкой. Его суть заключается в окислении «лишнего» углерода кислородом. Этот процесс проводят в мартеновских печах или кислородных конвекторах. Сырьем кроме чугуна является железный лом, легирующие добавки, кислород. В результате получается ковкий сплав железа – сталь.
2. Алюминотермия, как метод получения железа, используется в странах имеющих дешевую электроэнергию.
Соединения железа.
Для всех переходных металлов характерна зависимость свойств соединений элемента от его степени окисления. Чем выше с.о. элемента тем сильнее проявляются кислотные и окислительные свойства его соединения.
Железо (II)
FeO (твердое черное вещество, нерастворимое в воде)
Fe(OH)2 (бледно-зеленый студенистый осадок, твердое вещество практически нерастворимое в воде)
|
|
|
FeCl2 и др. соли (кристаллические вещества бледно-зеленого цвета, используют в с/х как микроудобрение)
Основные свойства оксида и гидроксида (т.е. они вступают в реакцию нейтрализации с кислотами)
FeО + HCl → FeCl2 + H2О
Fe(OH)2 + H2SO4 → FeSO4 + H2O
Восстановительные свойства (т.е. они легко окисляются)
Fe(OH)2 + O2 + H2O → Fe(OH)3
Железо (III)
Fe2O3 (твердое вещество красно коричневого цвета, нерастворимое в воде, известно под названием железный сурик, используется как пигмент для красок, как окислитель в пиротехнических смесях)
Fe(OH)3 (бурый студенистый осадок, твердое вещество практически нерастворимое в воде, ржавчина)
FeCl3 и др. соли (кристаллические вещества коричневого или желтого цвета, используют для очистки воды, в медицине - как окислитель, бактерицидное средство)
Оксид и гидроксид имеют амфотерные свойства (т.е. они вступают в реакцию нейтрализации и с кислотами и со щелочами)
Fe(OH)3 + HCl → FeCl3 + H2О
Fe(OH)3 + NaOH → Na3[Fe(OH)6]
Окислительные свойства у соединений проявляются слабо, т.е. взаимодействуют только с сильными восстановителями)
FeCl2 + H2S → FeCl2 + S + HCl
Применение железа
В чистом виде железо обычно не используют. Любые примеси, иногда очень незначительные, сильно изменяют свойства железа, а главное – усиливают его склонность к коррозии. Поэтому из чистого железа изготавливают только сердечники электромагнитов, якоря электродвигателей, а в основном используют сплавы железа.
|
|
|


