|
Просвечивающий электронный микроскоп
|
|
|
|
(рис. 1-7 ) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки.
Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта.
Подготовка материала к микроскопии
В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов.
Нативные препараты
Нативные препараты готовят для исследования живых неокрашенных бактерий. Наибольшее распространение получили метод висячей капли, микрокамеры с плотными средами и негативные методы исследования живых бактерий. Для прижизненного исследования также часто применяются исследование в тёмном поле и фазово-контрас тная микроскопия. Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов.
Окрашенные препараты
 Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
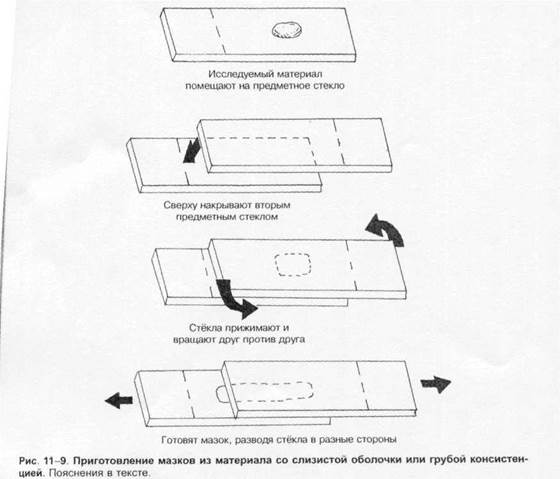
Отбор материала. Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 1-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 1-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 1-9 ). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 1-10, А ), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 1-10, Б ).
|
|
|
Фиксация. В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светооптической микроскопии используют формалин, спирты, глутаральдегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др. Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Окрашивание. Стандартные красители, используемые для окраски бактерий, — карболовый фуксин Циля, фуксин Пфайф-фера и метиленовый синий по Лёффлеру. Для получения более информативных результатов в светооптической микроскопии используют специальные и дифференцирующие методы окраски.

|
|
|
|
Специальные методы окраски бактерий. Наибольшее распространение нашли методы Грама и Циля-Нильсена (рис. 1-11 ).
Дифференцирующие методы обычно применяют для окрашивания различных морфологических структур.
Капсулы. Для окраски капсул бактерий применяют методы Хисса, Лейфсона и Антони; последний метод наиболее прост и включает окраску кристаллическим фиолетовым с последующей обработкой 20% водным раствором CuSO4.
|
|
|
Жгутики. Для окраски жгутиков предложены методы Лёффлера, Бейли, Грея и др. Для этих методов характерны первоначальное протравливание препарата [обычно растворами таннина, KAl(SO4)2, HgCl2] и последующая окраска (чаще карболовый фуксин Циля).
Споры. Окраску спор бактерий проводят после предварительной обработки их стенок. Наиболее прост метод Пешкова, включающий кипячение мазка с синькой Лёффлера на предметном стекле с последующей докраской нейтральным красным. Споры окрашиваются в синий цвет, вегетативные клетки — в розовый.
Питательные среды для культивирования бактерий
Для выделения чистых культур патогенных бактерий применяют оптимальные для их роста питательные среды с фиксированным рН. Большинство бактерий способно расти на различных питательных средах; исключение составляют хламидии и риккетсии, не растущие in vitro вне клеточных культур. Используемая среда должна содержать
|
|
-
вещества, утилизируемые бактериями для различных биосинтетических процессов.
Универсальные источники азота и углерода — бел- ковые гидролизаты (содержат полный набор аминокис- лот), пептиды и пептоны. Универсальные источники
витаминов и микроэлементов — экстракты белков жи-
вотного или растительного происхождения и белковые гидролизаты.
рН среды. В некоторых случаях жизнедеятельность
бактерий сопровождается сдвигом рН в кислую или
щелочную сторону, что требует внесения в среды раз-
личных буферных систем (обычно применяют фосфат-
ный буфер). Сбалансированные среды отличают высо-
кая буферность и стабильный оптимум рН. Важно так
же создание оптимальной концентрации О2 и СО2. ;
Классификации сред
Среды классифицируют по консистенции, составу, происхождению, назначению и загрязнённости материала.
|
|
|
По консистенции питательные среды разделяют на плотные (твёрдые), полужидкие и жидкие.
По составу выделяют белковые, безбелковые и ми неральные среды.
По происхождению среды разделяют на искусственные и естественные (природные).
Искусственные среды разделяют на животные [например, мясопептонный агар (МПА) или мясопептонный бульон (МПБ)] и растительные (например, настои сена и соломы, отвары злаков, дрожжей или фруктов, пивное сусло и др.).
|
|
|
|
|
|

 Естественные среды могут содержать компоненты животного (например, кровь, сыворотка, жёлчь) или растительного (например, кусочки овощей и фруктов) происхождения.
Естественные среды могут содержать компоненты животного (например, кровь, сыворотка, жёлчь) или растительного (например, кусочки овощей и фруктов) происхождения.
По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культиви рования (универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные).
По загрязнённости материала. Если материал слабо загрязнён посторонней микрофлорой, то для выделения чистых культур применяют простые (по составу) среды. При обильной контаминации сапрофитами используют специальные или элективные (для отдельных видов), селек тивные (только для отдельных бактерий), дифференциально-диагностические (для облегчения идентификации) среды.
Характеристики сред
Консервирующие среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь (среда Тига), гипертонический раствор, глицериновый консервант с LiCl2, раствор цитрата натрия и дезоксихолата натрия (среда Бенгсанга-Эллиота).
Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолятная среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+, теллурит К+, антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др.
|
|
|
Элективные и селективные среды (например, среды Уйлсона-Блэра, Эндо, Плбскирева, Мак-Конки) предназначены для первичного посева материала или для пересева с консервирующих сред или сред обогащения с целью получения чистой культуры. Среды готовят с учётом биохимических и энергетических потребностей микроорганизмов. Соответственно, выделяют кровяные и сывороточные среды (например, Лёффлера, Бордё-Жангу), яичные среды (например, Лёвенштайна-Йенсена) и др
Дифференциально-диагностические среды (например, среды Хисса, Кларка) применяют для изучения и идентификации отдельных типов, видов и групп бактерий. В качестве основы применяют различные органические и неорганические соединения, гидролизаты казеина, пептонную воду, бульон Хоттингера-Мартена, дополненные углеводами, спиртами, мочевиной и другими веществами; при их расщеплении происходит сдвиг рН в кислую (углеводы, спирты, липилы) или щелочную (белки) сторону. Соответственно, выделяют среды с углеводами и спир тами, среды с мочевиной, среды для определения индолообразования, среды для определения протеолитической активности и комбинированные (политропные) среды. В такие среды также часто вносят различные индикаторы (например, бромтимоловый синий, индикатор Андраде, бромкрезоловый пурпурный и крезоловый красный), помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андраде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании реактив Андраде и индикатор бром- тимоловый синий не меняют цвет среды. Все дифференциально-диагностические среды разделяют на четыре основные группы.
Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов (кровь, желатина, молоко и др.), применяют для определения гемолитических или протеолитических свойств. Наиболее распространены мясопептонная желатина (МПЖ), свернувшаяся лошадиная сыворотка, молоко и кровяной агар (КА).
Среды, содержащие углеводы или многоатомные спирты. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды, а иногда и образованию газа. Наиболее распространены цветные среды с различными углеводами (например, с бром-тимоловым синим, индикатором ВР), лакмусовое молоко (среда Минкевича) и среды Хисса. Из углеводов наиболее часто используют моносахариды (ксилозу, арабинозу, глюкозу, фруктозу, маннозу, галактозу), дисахариды (лактозу, мальтозу, сахарозу), полисахари ды (крахмал, гликоген, инулин, декстрин), спирты (дульцит, маннит, сорбит, глицерин) и гликозиды (адонит, инозит, салицин, амигдалин).
|
|
|
Среды для определения редуцирующей способности. В эту группу входят среды с красками, обесцвечивающимися при восстановлении (например, метиленовый голубой, нейтральный красный, индигокармин), а также среды с нитратами для определения денитрифицирующей активности бактерий (при положительном результате среды окрашиваются в синий цвет).
Среды, включающие вещества, ассимилируемые только определённой группой бактерий. Наиболее известны цитратный агар Симмонса и цитратная среда Козера.
Посев и культивирование
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.). Для выделения прихотливых видов в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также погло тители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
Получение изолированных колоний
Для получения изолированных колоний на практике наиболее часто используют модификацию рассева по Дригальски. Для этого материал наносят на поверхность плотной питательной среды ближе к краю и делают «бляшку». Затем из неё материал распределяют по четырём квадратам, проводя петлёй штрихи, как показано на рис. 1-12, обжигая петлю после засева каждого квадрата. Подобный метод позволяет получить изолированные колонии и изучать их. Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 1-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
.
Состав газовой среды
Бактерии чётко разделяют по отношению к содержанию кислорода в атмосфере культивирования.
Аэробы. Посевы аэробных бактерий культивируют в простых термостатах. Некоторые факультативно анаэробные виды также можно культивировать при атмосферном воздухе, но более оптимально помещение посевов в термостаты с дозированной подачей кислорода. На практике их чаще помещают в эксикаторы, куда вносят горящую свечу; после её выгорания в атмосфере снижается содержание кислорода и повышается содержание СО2.
Анаэробы. Посевы анаэробных бактерий в жидких средах заливают вазелиновым или другим маслом. При использовании плотных сред посевы культивируют в специальных устройствах — анаэростатах (откуда откачивают воздух) либо заливают посевы тонким слоем агара. Анаэробные условия можно создать химическим путём, поместив посевы в эксикаторы, на дно которых заливают щелочной раствор пирогаллола, поглощающего кислород. Также можно использовать методы Фортнера, Цейсслера и Вейнберга.
Метод Фортнера. Посевы проводят на чашку Петри с толстым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. На одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробов, а затем (после поглощения кислорода) — рост анаэробов.
Метод Цейсслера используют для выделения чистых культур спорообразующих анаэробов. Для этого проводят посев на среду Китта-Тароцци, прогревают 15 мин при 80 °С (для уничтожения вегетативных форм), заливают вазелиновым маслом и инкубируют 24 ч. Затем проводят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования подозрительные колонии изучают и отсевают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Вейнберга используют для получения чистых культур строгих анаэробов. Культуры, выращенные на среде Китта-Тароцци, вносят в сахарный бульон. Затем пастеровской пипеткой с запаянным концом материал переносят в узкие пробирки (трубки Виньяля) с сахарным МПА, погружая пастерку до дна пробирки. Засеянные пробирки быстро охлаждают холодной водой, что позволяет зафиксировать отдельные бактериальные клетки в толще затвердевшего агара. Пробирки инкубируют, и изучают выросшие колонии. При обнаружении подозрительной колонии на её месте делают распил, колонию быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
1

Методы культивирования
При выращивании бактерий применяют стационарный способ, способ глубинного культивирования с аэрацией и метод проточных питательных сред. В соответствии со способами выращивания бактериальные культуры разделяют на периодические (при стационарном и глубинном культивировании) и непрерывные (при проточном культивировании).
Стационарный способ — наиболее часто используемый на практике. Состав сред остаётся постоянным, с ними не проводят никаких дополнительных манипуляций.
Способ глубинного культивирования применяют при промышленном выращивании бактериальной биомассы, для чего используют специальные котлы-реакторы. Они снабжены системами поддержания температуры, подачи в бульон различных питательных веществ, перемешивания биомассы и постоянной подачи кислорода. Создание аэробных условий по всей толще среды способствует протеканию энергетических процессов по аэробному пути, что способствует максимальной утилизации энергетического потенциала глюкозы и, следовательно, максимальному выходу биомассы.
Метод проточных сред (промышленный способ культивирования) позволяет постоянно поддерживать бактериальную культуру в экспоненциальной фазе роста, что достигают постоянным внесением питательных веществ и удалением определённого числа бактериальных клеток. Пребывание бактерий в экспоненциальной стадии роста обеспечивает максимальный выход различных БАВ (витамины, антибиотики и др.).
Первичная идентификация бактерий
В большинстве случаев изучение особенностей роста для первичной идентификации возбудителей проводят на колониях, выросших в течение 18-24 ч. Характер роста бактерий на различных средах может дать много полезной информации. На практике используют сравнительно небольшой набор критериев. В жидких средах обычно учитывают характер поверхностного (образование плёнки) или придонного роста (вид осадка) и общее помутнение среды. На твёрдых средах бактерии формируют колонии — изолированные структуры, образующиеся в ре зультате роста и накопления бактерий. Колонии возникают как следствие роста и размножения одной или нескольких клеток. Таким образом, пересев из колонии в дальнейшем даёт возможность оперировать с чистой культурой возбудителя. Рост бактерий на плотных средах имеет больше характерных особенностей.
Гемолиз
Некоторые бактерии выделяют гемолизины — вещества, разрушающие эритроциты. На КА их колонии окружают зоны просветления. Образование гемолизинов (и соответственно — размеры зон гемолиза) может быть вариабельным, и для адекватного определения гемолитической активности следует просматривать чашки с посевами против источника света (рис. 1-14). Активность гемолизинов может проявляться в полном или неполном разрушении эритроцитов.
α-Гемолиз. Разрушение эритроцитов может быть неполным, с сохранением клеточной стромы. Подобный феномен называют α-гемолиз. Просветление среды вокруг колоний обычно незначительно, позднее среда вокруг колоний может приобретать зеленоватую окраску. Подобный рост характерен для пневмококка, а также для группы так называемых зеленящих стрептококков.
β-Гемолиз. Гораздо большая группа бактерий вызывает полное разрушение эритроцитов, или β-гемолиз. Их колонии окружены прозрачными зонами различного размера. Например, Streptococcus pyogenes и Staphylococcus aureus образуют большие зоны гемолиза, a Listeria monocytogenes или Streptococcus agalactiae — небольшие, диффузные зоны. Для определения гемолитической активности не следует применять шоколадный агар (ША), так как образующиеся зоны α- или β-гемолиза не имеют характерных особенностей и вызывают одинаковое позеленение среды.
Размеры и форма колоний
 Важные признаки колоний — их размеры и форма. Колонии могут быть большими или мелкими. Величина колоний — признак, позволяющий различать различные виды, роды и даже типы бактерий.
Важные признаки колоний — их размеры и форма. Колонии могут быть большими или мелкими. Величина колоний — признак, позволяющий различать различные виды, роды и даже типы бактерий.
|
|
В большинстве случаев колонии грамположительных бактерий мельче колоний грамотрицательных бактерий. Колонии бактерий могут быть плоскими, приподнятыми, выпуклыми, иметь вдавленный или приподнятый центр. Другой важный признак — форма краёв колоний. При изучении формы колоний учитывают характер её поверхности: матовый, блестящий, гладкий или шероховатый. Края колоний могут быть ровными, волнистыми, дольчатыми (глубоко изрезанными), зубчатыми, эрозированными, бахромчатыми и т.д. Размеры и формы колоний часто могут изменяться. Подобные изменения известны как диссоциации. Наиболее часто обнаруживают S - и R - duc социации. S-колонии круглые, гладкие и выпуклые, с ровными краями и блестящей поверхностью. R-колонии — неправильной формы, шероховатые, с зубчатыми краями.
Цвет колоний
При просмотре посевов также обращают внимание на цвет колоний. Чаще они бесцветные, белые, голубоватые, жёлтые или бежевые; реже — красные, фиолетовые, зелёные или чёрные. Иногда колонии ирризируют, то есть переливаются всеми цветами радуги [от греч. iris, радуга]. Окрашивание возникает в результате способности бактерий к пигментообразованию. На специальных дифференцирующих средах, включающих специальные ингредиенты или красители, колонии могут приобретать разнообразную окраску (чёрную, синюю и др.) за счёт включения красителей либо их восстановления из бесцветной формы. В данном случае их окраска не связана с образованием каких-либо пигментов.
Консистенция колоний и особенности роста на среде
Полезную информацию могут дать консистенция колоний и особенности роста на среде. Обычно эту информацию можно получить при прикосновении к колониям петлёй. Колонии могут легко сниматься со среды, врастать в неё или вызывать её коррозию (образуя трещины и неровности). Консистенция колоний может быть твёрдой или мягкой. Мягкие колонии — маслянистые или сливкообразные; могут быть слизистыми (прилипают к петле) или низкими (тянущимися за петлёй).
Твёрдые колонии — сухие, восковидные, волокнистые или крошковатые; могут быть хрупкими и ломаться при прикосновении петлёй.
Запах
Запах — менее важный признак колоний, поскольку вызываемые им ассоциации носят субъективный характер. В частности, культуры синегнойной палочки имеют запах карамели, культуры листерий — молочной сыворотки, протеев — гнилостный запах, нокардий — свежевскопанной земли.
Биохимические методы идентификации бактерий
Методов, используемых для идентификации особенностей метаболизма бактерий, очень много, но на практике применяют небольшое их количество. Большинство способов основано на использовании дифференциально-диагностических сред, включающих различные индикаторы.
Способность к ферментации углеводов
Способность к ферментации углеводов оценивают по изменению окраски среды вследствие образования органических кислот (соответственно, происходит уменьшение рН), вызывающих изменение окраски индикатора.
«Пёстрый» ряд. Для определения сахаролитической активности применяют среды Хисса; в их состав входят 1% пептонная вода (или МПБ), индикатор Андраде и один из углеводов. При расщеплении углевода происходит изменение цвета среды с жёлтого на красный. Поскольку бактерии различают по способности ферментировать те или иные углеводы, то ряды пробирок приобретают пёстрый вид. Поэтому этот набор сред и называют «пёстрый» (или цветной) ряд.
Стеклянные поплавки. Для определения способности микроорганизмов ферментировать углеводы с образованием кислоты и газа в сосуды со средами вносят стеклянные поплавки (запаянные с одного конца короткие трубочки), всплывающие после наполнения их газом.
Расщепление белков
Некоторые бактерии проявляют протеолитическую активность, выделяя протеазы, катализирующие расщепление белков. Наличие протеолитических ферментов из группы коллагеназ определяют при посеве уколом в МПЖ. При положительном результате наблюдают его разжижение в виде воронки либо послойно сверху вниз. Способность к расщеплению белков и аминокислот также можно оценивать по изменению окраски среды, так как образующиеся продукты — аммиак, индол и сероводород — сдвигают рН в щелочную сторону, вызывая изменение окраски индикатора.
Образование аммиака. Для определения способности к образованию NH3 проводят посев в МПБ, и между его поверхностью и пробкой закрепляют полоску лакмусовой бумаги. При положительном результате бумажка синеет.
Образование индола и H 2 S. Обычно для определения способности к образованию индола и сероводорода также проводят посев в МПБ, между его поверхностью и пробкой закрепляют бумажки: в первом случае пропитанные раствором щавелевой кислоты {при образовании индола бумажка краснеет), во втором — раствором ацетата свинца (при образовании H 2 S бумажка чернеет). Также используют специальные среды, содержащие индикаторы (например, среда Клиглера), либо их вносят непосредственно в среду после регистрации видимого роста бактерий.
Тест на нитратредуктазную активность
Этот тест используют для идентификации отдельных видов бактерий. Он позволяет определить способность восстанавливать нитраты в нитриты. Способность к восстановлению NO3 в N02, определяют культивированием в МПБ, содержащем 1% раствор KNO3. Для определения нитритов в среду добавляют несколько капель реактива Грисса. При положительном резуль тате наблюдают появление красного кольца.
Хроматография
Хроматографические методы используют для идентификации бактерий и установления их систематического положения. Объекты для исследования — жирные кислоты клеточной стенки, уникальные интермедиаты и конечные метаболиты жизнедеятельности бактерий. Хроматографические системы обычно сопрягают с компьютерами, что значительно упрощает учёт результатов. Наиболее распространена идентификация жирных короткоцепочечных и тейхоевых кислот методом газожидкостной хроматографии. Жидкостной хроматографией под высоким давлением идентифицируют миколевую кислоту в клеточных стенках микобактерий. Тонкослойную хроматографию используют для идентификации изопреноидных хинонов клеточной стенки бактерий. У различных родов их содержание и набор различны, но постоянны, что позволяет установить систематическое положение каждого конкретного вида.
Индикаторные бумажки
Для изучения биохимической активности бактерий широко применяют системы индикаторных бумажек или наборы мультимикротестов.
Система индикаторных бумажек (СИБ) — набор дисков, пропитанных различными субстратами. Их можно непосредственно вносить в пробирки со взвесью бактерий либо предварительно поместить в лунки пластиковых планшетов, куда будут внесены исследуемые бактерии. Так, на практике применяют наборы Minitek Enterobacteriaceaelll и Minitek Neisseria для дифференциальной диагностики энтеробактерий (четырнадцать субстратов) и нейссерий (четыре субстрата), позволяющие получить результаты через 4 ч инкубации при 37 0С.
Наборы мультимикротестов — пластиковые планшеты, в лунки которых помещены различные субстраты и индикаторы. В лунки вносят различные разведения бактерий и инкубируют при 37 °С. На практике используют тесты RapID NH для идентификации нейссерий и гемофилов, RapID Е для энтеробактерий и др., позволяющие получить результаты не позднее 4-8 ч.
Автоматические системы идентификации бактерий
Автоматические системы идентификации бактерий позволяют быстро (на 24-48 ч быстрее обычных методов) получить информацию о виде возбудителя заболевания и его чувствительности к антимикробным препаратам. В настоящее время наибольшее распространение получили системы типа Microscan и Vitek.
Системы Microscan. Используют турбидиметрические, колориметрические и флюоресцентные методы идентификации бактерий. Системы состоят из комплектов пластиковых планшетов, содержащих различные субстраты. Грамположительные и грамотрицательные бактерии дифференцируют с помощью флюоресцирующих субстратов (время анализа — 2 ч). Для идентификации гемофилов, анаэробов и дрожжей используют хромогенные субстраты, изменяющие свою окраску (время анализа — 4-6 ч). Минимальные ингибирующие концентрации различных антибиотиков определяют по изменению оптической плотности. Система компьютеризирована и автоматически проводит все необходимые расчёты.
Системы Vitek. В этой системе применяют один тип планшетов с тридцатью лунками.В каждую лунку автоматически вносится суспензия бактерий с известной концентрацией микробных тел. Идентификация микроорганизмов (гемофилы, нейссерии, дрожжи и анаэробы) основана на турбидометрии реакционной среды в лунке. В зависимости от свойств микроорганизма время, необходимое для его идентификации, варьирует от 4-8 до 18 ч. Система полностью компьютеризирована и работает автоматически.
Методы идентификации нуклеиновых кислот
Методы выявления РНК и ДНК возбудителей нашли применение в основном при диагностике вирусных инфекций. Тем не менее разработаны тест-системы для идентификации некоторых прихотливых бактерий (например, легионелл, хламидий), а также для идентификации колоний Neisseha gonorrhoeae, Haemophilus influenzae типа b, стрептококков группы В, энтерококков и микобактерий.
Гибридизация нуклеиновых кислот
Наиболее распространены методы гибридизации нуклеиновых кислот (рис. 1-17). Принцип методов обусловлен способностью ДНК (и РНК) специфически соединяться (гибридизироваться) с комплементарными фрагментами искусственно созданных нитей ДНК (и РНК), меченных изотопами или ферментами (пероксидазой или щелочной фосфатазой). В дальнейшем образцы исследуют различными методами (например, ИФА).
Метод гибридизации в растворах даёт наиболее быстрые результаты (рис. 1-18, А). Широкому внедрению метода препятствует проблема удаления не связавшихся нитей нуклеиновых кислот.
Метод гибридизации на твёрдой основе (рис. 1-18, Б) и его сэндвич- модификация (рис. 1-18, В) распространён больше. В качестве твёрдой основы служат мембраны из нитроцеллюлозы или нейлона. Не связавшиеся реагенты удаляют многократным отмыванием.
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
Основу метода ПЦР составляет катализируемое ДНК-полимеразой многократное образование копий определённого участка ДНК. Первоначально проводят отжиг — термическое разделение двухнитевой молекулы ДНК на отдельные цепочки. Затем среду охлаждают и вносят праймеры (затравки), комплементарные нуклеотидным последовательностям обеих цепочек. Для запуска реакции применяют синтетические праймеры — олигонуклеотиды, состоящие из 10-20 нуклеоти-дов (например, дезоксинуклеотидтрифосфат), взаимодействующие с окончаниями последовательностей и образующие последовательности в 50-1000 оснований. Затем в среду вносят термостабильную taq-полимеразу (по названию бактерии Thermus aquaticus), что запускает образование вторичных копий цепей ДНК, после чего образующиеся двухнитевые молекулы ДНК снова подогревают. Образующиеся отдельные цепочки остужают, вносят праймеры и снова повторяют процедуру подогрева и охлаждения; поскольку tag-полимераза термостабильна, то необходимость в её повторном внесении отсутствует (рис. 1-19). ПЦР позволяет получить большие количества изучаемого фрагмента ДНК даже в том случае, если в распоряжении исследователя имеется всего лишь одна исходная молекула геномной ДНК. Идентификацию копий ДНК проводят методом электрофореза. Метод ПЦР лежит также в основе ДНК-идентификации личности, установления родства людей, выявления генов наследственных болезней и пр.

|
|

Серологические методы
Классические серологические реакции применяют для выявления бактериальных AT, а также для выявления Аг, особенно для идентификации бактериальных Аг. Среди современных методов наибольшее распространение нашли методы твердофазного ИФА и латекс-агглютинации.
Аллергологические методы
Сенсибилизирующей активностью обладает ограниченное количество бактериальных Аг. Поэтому метод кожных проб применяют лишь при диагностике туберкулёза, сапа, мелиоидоза, бруцеллёза и туляремии.
Биологические методы
Выделение патогенных бактерий от заражённых животных имеет большую диагностическую ценность, особенно при контрольном применении иммунных сывороток. Цель подобных манипуляций — уменьшение времени проведения бактериологических исследований.
• При диагностике инфекций, вызванных эффектами токсина (например, ботулизма или сибирской язвы), материал, предположительно содержащий возбудитель и токсин, помещают в физиологический раствор, а затем фильтруют через бумажные фильтры, натёртые тальком (последний хорошо адсорбирует токсин). Смывами с фильтров заражают чувствительных животных.
• При диагностике инфекций, обусловленных различными патогенными свойствами самого возбудителя, лабораторных животных заражают микробной взвесью.
• Для диагностики бактериальных инфекций используют различных животных, так как проявляют видовую восприимчивость к различным этиологическим агентам.
Мыши чувствительны к пневмококкам, нейссериям, пастереллам, клостридиям, листериям, возудителям сибирской язвы, туляремии, чумы, ботулизма, столбняка, коклюша и мелиоидоза
Крысы чувствительны к возбудителям туберкулёза (бычьего типа), мелиоидоза и др.
Морские свинки чувствительны к в
|
|
|