 |
Перечислите основные типы химических связей .
|
|
|
|
Почему Элементы Si и Ti находятся в одной группе? Что такое группа, с точки зрения строения атома?
Si(кремний) – находится в третьем периоде, Ti(титан) – находится в четвертом периоде.При этом элементы находятся в одной группе. Si –в главной, Ti- в побочной.
Элементы главных и побочных подгрупп различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в одну группу - номер группы. Он, как правило, указывает на число электронов на внешнем энергетическом уровне.В этом состоит физический смысл номера группы.
Так, по 4 валентных электрона имеют: Si (главная подгруппа IV группы) -1s 22s 22p 63s 23p2 ; титан Ti (побочная подгруппа IV группы) - 1s 22s 22p 63s 23p64s 23d2.
Группа – это вертикальный ряд элементов атомы которых имеют одинаковое число валентных электронов. Валентные это электроны, за счет которых атомы соединяются между собой, образуя молекулы. Номер группы – римская цифра вверху –показывает число валентных электронов в атоме. В этом заключается физический смысл номера группы. В периодической системе элементов 8 групп состоящих из подгрупп. Главные подгруппы содержат элементы малых и больших периодов Подгруппа А. Побочные подгруппы содержат элементы только больших периодов Подгруппа Б. С увеличением заряда ядра металлические и восстановительные свойства возрастают. С точки зрения строения атома понятия группа и подгруппа приобретают особый смысл. Изучение свойств химических элементов в их связи со строением атома показывает, что объединение элементов в подгруппы прежде всего связано с аналогией строения атомов: у элементов главных подгрупп аналогия проявляется в строении внешнего энергетического уровня, а у элементов побочных подгрупп — в строении внешнего и предвнешнего уровней.
|
|
|
Объясните причины образования химических связей в соединениях. Какова природа химических связей?
Атомы различных элементов, входящие в состав простых и сложных веществ, удерживаются вместе благодаря наличию химических связей.
Химической связью называется взаимодействие между атомами, приводящее к образованию молекул, ионов, кристаллов и иных индивидуальных частиц.
Согласно современным представлениям, химическая связь имеет электрический характер и определяется превращениями электронного типа между взаимодействующими частицами. В образовании химической связи принимают участие кулоновские силы, носителями которых являются электроны и ядра атомов.
Химическая связь возникает за счет электростатического взаимодействия положительно заряженных ядер и отрицательно заряженных электронов. Одно из наиболее существительных свойств определяющих, какая связь образуется между атомами, - это электроотрицательность, т.е способность атомов в соединении притягивать к себе электроны.
В периодах наблюдается общая тенденция роста электроотрицательности элементов, а в группах – ее падения.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательности соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее.
В основу теории химической связи положено представление о том, что устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершен, т.е содержит 8 электронов (для элементов 1 периода -2)
Атомы имеющие завершенные уровни, химически инертны, т.е устойчивы. Они с трудом вступают в химическое взаимодействие. Завершенные внешние уровни имеют атомы следующих шести Элементов: He, Ne, Ar,Kr¸Xe, Rn. Отсюда и их название – инертные, или благородные, газы. Атомы остальных химических элементов имеют незавершенные внешние уровни и в процессе химических реакций стремятся завершить их путем:
|
|
|
1) Образования общих электронных пар
2) Отдачи или присоединения электронов
По современным представлениям химическая связь между атомами имеет электростатическую природу. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Если атом имеет незавершенный енергетический уровень, то он стремится к его завершению. При образовании молекул в ходе химических реакций атом стремится приобрести стойкую (завершенную) внешнюю электронную оболочку, с 8ми электронами!!!!!!
Перечислите основные типы химических связей.
1) Ионная (типичный метал + типичный не металл)
Ионная связь – Образуется при взаимодействии атомов, резко отличающихся друг от друга по электроотрицательности. (связь между ионами.)
Ионами называются заряженные частицы образовавшиеся в результате отдачи или присоединения атомами электронов.
Отдавая атомы электроны заряжаются положительно.
Принимая электроны атомы заряжаются отрицательно.
Отрицательно заряженные ионы – анеоны
2) Ковалентная связь
Это связь на основе образования общих электронных пар.
1. Ковалентная полярная (между разными неметаллами)Общие электронные пары смещены в сторону более электро отрицательного элемента.Ковалентная связьможет быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. Образуется в Кислотах, кислотных оксидах, водородных соединениях и др.)
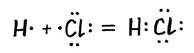
2. Ковалентная неполярная связь возникает между не металлами с одинаковой электро отрицательностью.(Одинаковыми неметаллами)Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. Возникает в простых веществах (газах)
|
|
|

| s-s- связь | 
|
| s-p- связь | 
|
| p-p- связь | 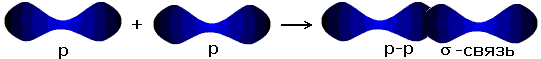
|
| p-p- связь | 
|
Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
3) Металлическая связь
В металлах кристаллическая решетка построена из катионов металла и обобществленных электронов, свободно блуждающих по куску металла. Хаотично блуждающие электроны – «электронный газ»
4) Водородная связь
Связь, которая образуется между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента (O, S, N, F и д.р) другой молекулы, называется водородной связью.
65. Какой тип связи в соединениях?
О2 -между атомами кислорода образуется две общие электронные пары. Это ковалентная неполярная связь.
ZiCl-
NH3- Ковалентная полярная
CaO – Ионная
P2O5 - Ковалентная полярная
|
|
|


