 |
Окисление кислородом воздуха в пропиленоксид
|
|
|
|
При нагревании в присутствии серебряных катализаторов:

3. При реакции галогеналканов со щёлочью:
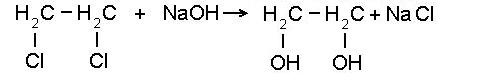
прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH.
Образование сложных эфиров

66 Классиикация ВМС
I. По происхождению высокомолекулярные соединения подразделяют на:
1. Природные (натуральные или естественные). Характерными представителями таких соединений являются природные белки, натуральный каучук, шелк, шерсть и др.
2. Искусственные, получаемые путем химической обработки натуральных высокомолекулярных соединений. К числу таких материалов относятся: нитроцеллюлоза (используемая для получения целлулоида и этрола), ксантогенат целлюлозы (вискоза), ацетат целлюлозы.
3. Синтетические, представляющие собой продукты процессов полимеризации или поликонденсации низкомолекулярных соединений. К этому наиболее важнейшему классу высокомолекулярных соединений относятся полиэтилен, поливинилхлорид, полиамиды, полистиролы, феноло-формальдегидные смолы, полиуретаны и многие другие соединения.
II. По природе высокомолекулярные соединения подразделяются на:
1. Органические, в состав которых входят атомы углерода, водорода, азота, кислорода и других органогенов. Типичными представителями таких соединений являются белки, полиолефины, поливинилхлорид, феноло-формальдегидные и эпоксидные смолы и т.д.
2. Неорганические, к которым можно отнести соединения на основе серы, кремния, фосфора и других неметаллов, таких как самородная сера, кварц, тальк, корунд и др.
|
|
|
3. Элементоорганические, к числу которых относятся высокомолекулярные соединения, макромолекулы которых содержат наряду с углеводородными группами неорганические фрагменты, в первую очередь атомы поливалентных металлов (цинка, магния, меди), а также кремния, фосфора и др. К таким соединениям относятся: кремнийорганические (полиорганосилоксаны), бор- и фосфорсодержащие полимеры.
III. По типу реакций получения высокомолекулярные соединения делятся на:
1. Полимеризационные, получаемые из низкомолекулярных соединений (мономеров) с помощью реакции полимеризации. Химический (элементарный) состав таких соединений одинаков с составом низкомолекулярных соединений (мономеров), из которых получено высокомолекулярное соединение, т.к. реакции полимеризации протекают без выделения побочных продуктов. Типичными представителями их являются: полиэтилен, поливинилхлорид, полистирол и др.
2. Поликонденсационные, получаемые из низкомолекулярных соединений с помощью реакций поликонденсации, протекающих с выделением побочных продуктов (воды, спирта и др.). В связи с этим химический состав таких высокомолекулярных соединений отличается от состава исходных продуктов (мономеров). К поликонденсационным соединениям относятся полиамиды, полиэфиры, эпоксидные смолы, феноло-формальдегидные смолы и др.
IV. По отношению к действию повышенных температур высокомолекулярные соединения подразделяют на:
1. Термопластичные — высокомолекулярные соединения, изменения свойств которых при нагревании (выше температур плавления или размягчения) носят обратимый характер. К материалам такого типа относятся полиэтилен, поливинилхлорид, полистирол, полиамиды, поликарбонаты и др.
2. Термореактивные — высокомолекулярные соединения, переходящие при нагревании до определенных температур в неплавкое и
нерастворимое состояние. К таким соединениям относятся феноло-формальдегидные, меламино-альдегидные и эпоксидные смолы.
|
|
|
V. В зависимости от состава основной (главной) цепи высокомолекулярные соединения делят на два больших класса:
1. Карбоцепные высокомолекулярные соединения, основная цепь которых построена только из углеродных атомов. К соединениям этого класса относятся: полиэтилен, поливинилхлорид, полистирол, полиметилметакрилат (органическое стекло) и др.
2. Гетероцепные — высокомолекулярные соединения, в основной цепи которых помимо углеродных атомов содержатся атомы других элементов, чаще всего азота, кремния, кислорода, фосфора. Типичными представителями этого класса соединений являются природные белки, целлюлоза, полиамиды, полиэфиры (например, полиэтилентерефталат), мочевино-формальдегидные смолы и др.
VI. По структуре макромолекул высокомолекулярные соединения могут подразделяться на:
1. Линейные, характеризующиеся молекулами вытянутой или зигзагообразной формы без боковых ответвлений или с ответвлениями малой длины. Представителями этого класса являются: полиэтилен, поливинилхлорид, полиамиды, полистирол и др.
2. Разветвленные высокомолекулярные соединения, у которых длина основной цепи соизмерима с длиной боковых ответвлений. К таким соединениям относятся ряд полиакрилатов, различные сополимеры и блок-сополимеры, крахмал и др.
3. Пространственные (сетчатые, трехмерносшитые) высокомолекулярные соединения, представляющие собой связанные химическими связями во всех трех направлениях пространства отрезки макромолекул. Представителями этого класса соединений являются отвержденные феноло-формальдегидные, эпоксидные карбамидные смолы, сшитые (вулканизированные) каучуки (резины, эбонит) и др.
Классифицировать высокомолекулярные соединения можно и по ряду других признаков, например, по отношению к воде (гидрофильные и гидрофобные), по форме макромолекул, по пространственному расположению боковых макромолекул и т.д.
67 Получение алкенов из алканов на примере бутана
каталитическое дегидрирование бутана (500С)
2С4Н10===> СН2=СН-СH2-СH3+ CH3-CH=CH-CH3 (бутен-1 и бутен-2)
Дегидрирование (отщепление водорода)
C4H10 = C4H8 + H2
даже коэффициентов не надо. над стрелкой можно поставить температуру
|
|
|
Спирты являются слабыми ОН-кислотами Бренстеда и жесткими кислотами по Пирсону. По кислотности спирты близки к воде. Кислотные свойства спиртов определяются способностью к протонизации атома водорода гидроксильной группы. Последняя обусловливается не только разницей в электроотрицательностях между атомами кислорода (3,5) и водорода (2,1), но и природой радикала. Метанол (pKa = 15,5), несколько более сильная кислота, чем вода (pKa = 15,7), но большинство спиртов являются более слабыми кислотами, чем вода. Причиной этого являются стерические препятствия, мешающие в разветвленных спиртах сольватации образующегося алкоксид-аниона. Сольватация стабилизирует алкоксид-анион и следовательно усиливает кислотные свойства.
Образование межмолекулярной водородной связи в жидкой фазе определяет различие в кислотности первичных, вторичных и третичных спиртов. В водном растворе кислотность спиртов уменьшается в ряду:










pKa (в воде) 5.0 15,5 15,7 15,9 17,0 18,0
тогда как в газовой фазе наблюдается прямо противоположная последователь-ность







 30 20 10 10
30 20 10 10
В жидкой фазе определяющим фактором стабилизации алкоксид-анионов является эффект сольватации, который тем больше, чем меньше стерические препятствия для сольватации, т.е. чем меньше в молекуле углеводородных радикалов и меньше их размер. Разветвленность алкильной группы снижает кислотность спиртов, а введение в их молекулы атомов галогена, наоборот повышает ее.
Кислотные свойства спиртов проявляются во многих реакциях, например:



69 свойства аминокислот
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы — COOH, так и основные свойства, обусловленные аминогруппой — NH 2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH 2 — CH 2 — COOH + HCl → HCl • NH 2 — CH 2 — COOH (хлороводородная соль глицина)
NH 2 — CH 2 — COOH + NaOH → H 2 O + NH 2 — CH 2 — COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
|
|
|
NH 2 — CH 2 COOH  N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO -
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH 2 — CH 2 — COOH + CH 3 OH → H 2 O + NH 2 — CH 2 — COOCH 3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC — CH 2 — NH — H + HOOC — CH 2 — NH 2 → HOOC — CH 2 — NH — CO — CH 2 — NH 2 + H 2 O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
|
|
|


