 |
Гидратация белков и факторы, влияющие на их растворим
|
|
|
|
| Нуклеиновые кислоты и их роль в организме человека | 
| 
|
| 15.07.2012 00:00 |
 Структурной единицей всех веществ, как известно, являютсямолекулы. В соответствии с особенностями молекул выделяюттри больших группы органических химических веществ, из которых построены все биологические организмы (микроорганизмы, растения, животные и человек).
Эти вещества: белки, жиры и углеводы. Вариантов их строения много. В живых организмах встречаются и моносоединения, т.е. простые молекулы, и полимерные цепи – множество простых молекул, соединенных друг с другом и образующими одно полимерное вещество.
Наиболее сложное строение имеют белки. Их цепи строятся из аминокислот. Ученые подсчитали, что из 20 аминокислот приразличных вариантах их «сборки» может быть построено 2 432 902 008 176 640 000 различных цепочек! Так же как 7 нот в музыке позволяют появится неповторимым вариантам музыкальных фраз, так и 20 аминокислот обеспечивают изумительное многообразие белковых соединений. Но структура белка не ограничивается простой цепочкой. Цепочки «сворачиваются» во вторичную структуру, далее образуется третичная и четверичная структурная формула белковых молекул.
Структурной единицей всех веществ, как известно, являютсямолекулы. В соответствии с особенностями молекул выделяюттри больших группы органических химических веществ, из которых построены все биологические организмы (микроорганизмы, растения, животные и человек).
Эти вещества: белки, жиры и углеводы. Вариантов их строения много. В живых организмах встречаются и моносоединения, т.е. простые молекулы, и полимерные цепи – множество простых молекул, соединенных друг с другом и образующими одно полимерное вещество.
Наиболее сложное строение имеют белки. Их цепи строятся из аминокислот. Ученые подсчитали, что из 20 аминокислот приразличных вариантах их «сборки» может быть построено 2 432 902 008 176 640 000 различных цепочек! Так же как 7 нот в музыке позволяют появится неповторимым вариантам музыкальных фраз, так и 20 аминокислот обеспечивают изумительное многообразие белковых соединений. Но структура белка не ограничивается простой цепочкой. Цепочки «сворачиваются» во вторичную структуру, далее образуется третичная и четверичная структурная формула белковых молекул.
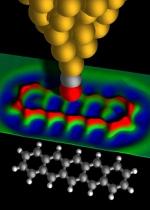 Ученые используют высокотехнологичное оборудование, компьютерные технологии, лазерные установки, чтобы распознать строение отдельных белков и расшифровать состав первичной цепочки. В живых организмах каждая клетка «знает», какой белок синтезировать, и когда начать это делать. В процессе же созревания плода все начинается с одной единственной оплодотворенной яйцеклетки. К моменту рождения клеток уже почти 100 миллиардов. Каждая имеет особенности строения, из них сформированы ткани и органы.
Все дело в том, что существует отдельный важнейший класс природных полимерных веществ — нуклеиновые кислоты. Эти особые соединения имеют уникальное строение и выполняют особые функции в организме. В их длинных цепочках закодирована вся необходимая информация для биосинтеза белков и других сложных веществ в клетках. Код строения одного белка называется ген. Ген является участком хромосомы. Каждая хромосома — это молекула нуклеиновой кислоты - ДНК. Ученые используют высокотехнологичное оборудование, компьютерные технологии, лазерные установки, чтобы распознать строение отдельных белков и расшифровать состав первичной цепочки. В живых организмах каждая клетка «знает», какой белок синтезировать, и когда начать это делать. В процессе же созревания плода все начинается с одной единственной оплодотворенной яйцеклетки. К моменту рождения клеток уже почти 100 миллиардов. Каждая имеет особенности строения, из них сформированы ткани и органы.
Все дело в том, что существует отдельный важнейший класс природных полимерных веществ — нуклеиновые кислоты. Эти особые соединения имеют уникальное строение и выполняют особые функции в организме. В их длинных цепочках закодирована вся необходимая информация для биосинтеза белков и других сложных веществ в клетках. Код строения одного белка называется ген. Ген является участком хромосомы. Каждая хромосома — это молекула нуклеиновой кислоты - ДНК.
 В природе существует два вида нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). ДНК является хранителем информации, РНК — переносит и расшифровывает биологическую информацию.
Как же устроены нуклеиновые кислоты?
Так же как белки строятся из отдельных аминокислот, так и нуклеиновые кислоты образуются из отдельных значительно более простых «строительных блоков». Эти «блоки» - строительные кирпичики, носят названия нуклеотиды. Структура нуклеотидов давно исследована и хорошо известна. Каждый отдельный нуклеотид состоит из трех компонентов: остатки фосфорной кислоты – одинакового у ДНК и РНК, пятиуглеродного сахара (рибозы у РНК и деоксирибозы у ДНК) и азотистого основания (пуринового или пиримидинового). В природе имеется всего 4 вида нуклеотидов. Из них и строится множество различных молекул ДНК и РНК растений, животных и человека, имеющих значительные видовые отличия. Несколько нуклеотидов, соединенные между собой, составляют короткие цепочки и называются олигонуклеотиды. Они состоят из 5-30 звеньев. Более длинные цепочки нуклеотидов называют полинуклеотиды, еще более тяжелые молекулы – ДНК и РНК. Нуклеотиды, соединенные в молекулу РНК, обычно состоит из одной цепочки. ДНК имеет более сложное строение и состоит из двух цепочек нуклеотидов, попарно соединенных между собой.
Молекулы ДНК очень длинные и у разных организмов имеет разную величину. Так, например молекула ДНК кишечной палочки содержит 4,5 миллиона нуклеотидов, а молекула ДНК человека 125 миллионов нуклеотидных пар.
Двойная цепочка нуклеотидов ДНК сворачивается в спираль. Спираль затем «наматывается» на специальные белки – гистоны и упаковывается в хромосому. Структура хромосомы очень плотна. Если «размотать» нить ДНК одной хромосомы – получится цепочка длинной 2 метра. У человека 23 пары хромосом умещаются в ядро размером 0,006 мм. В природе существует два вида нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). ДНК является хранителем информации, РНК — переносит и расшифровывает биологическую информацию.
Как же устроены нуклеиновые кислоты?
Так же как белки строятся из отдельных аминокислот, так и нуклеиновые кислоты образуются из отдельных значительно более простых «строительных блоков». Эти «блоки» - строительные кирпичики, носят названия нуклеотиды. Структура нуклеотидов давно исследована и хорошо известна. Каждый отдельный нуклеотид состоит из трех компонентов: остатки фосфорной кислоты – одинакового у ДНК и РНК, пятиуглеродного сахара (рибозы у РНК и деоксирибозы у ДНК) и азотистого основания (пуринового или пиримидинового). В природе имеется всего 4 вида нуклеотидов. Из них и строится множество различных молекул ДНК и РНК растений, животных и человека, имеющих значительные видовые отличия. Несколько нуклеотидов, соединенные между собой, составляют короткие цепочки и называются олигонуклеотиды. Они состоят из 5-30 звеньев. Более длинные цепочки нуклеотидов называют полинуклеотиды, еще более тяжелые молекулы – ДНК и РНК. Нуклеотиды, соединенные в молекулу РНК, обычно состоит из одной цепочки. ДНК имеет более сложное строение и состоит из двух цепочек нуклеотидов, попарно соединенных между собой.
Молекулы ДНК очень длинные и у разных организмов имеет разную величину. Так, например молекула ДНК кишечной палочки содержит 4,5 миллиона нуклеотидов, а молекула ДНК человека 125 миллионов нуклеотидных пар.
Двойная цепочка нуклеотидов ДНК сворачивается в спираль. Спираль затем «наматывается» на специальные белки – гистоны и упаковывается в хромосому. Структура хромосомы очень плотна. Если «размотать» нить ДНК одной хромосомы – получится цепочка длинной 2 метра. У человека 23 пары хромосом умещаются в ядро размером 0,006 мм.
 Хромосомы — хранители генетической информации, находятся под особой «охраной» — в ядре клетки. Ядро ограниченно практически непроницаемой мембраной, при разрушении которой клетка гибнет. Если такое случается, то молекула ДНК теряет свои функции, но сохраняет строение. Нужны очень сильные ферменты – нуклеазы – для того, чтобы разрушить структуру нуклеиновой кислоты.
Перед каждым клеточным делением при абсолютно точном соблюдении нуклеотидной последовательности происходит самоудвоение молекулы ДНК. Удвоение начинается с того, что двойная спираль ДНК временно раскручивается. Это происходит под действием специального фермента – ДНК-полимеразы, в среде, где имеются свободные нуклеотиды. Каждая одинарная цепь по принципу химического сродства притягивает к нуклеотидным блокам свободные нуклеотиды, находящиеся в клетке и закрепляет водородными связями. Таким образом, если клетке пришло время обновляться, то есть делиться, требуются два условия: генетическая информация (которая во всех клетках имеется в ядре) и наличие строительного материала для создания новых молекул нуклеиновых кислот — «кирпичики - блоки» — нуклеотиды.Если нет строительного материала, генетическая информация не реализуется, клетка не разделится, ткань не обновится, функция органа снизится, и, как следствие — пострадает организм.
Откуда же появляются нуклеотиды для осуществления процессов деления?Обычно мы получаем нуклеиновые кислоты с пищей, так как поедаем органические вещества. Нуклеиновые кислоты имеются в любой пище. Особенно много их в яйцах, икре и мясе.
Нуклеиновые кислоты, которые попадают в наш организм с пищей, уже частично денатурированы (разложены) в процессе тепловой обработки пищи. Далее они подвергаются дальнейшему разложению под действием пищеварительных ферментов.Доказано, что нуклеиновые кислоты на 95-98% деградируют в тонком кишечнике до пуриновых и пиримидиновых оснований, сахаров и фосфорных остатков. Клетка с кровью получает эти простые вещества, синтезирует из них нуклеотиды, обеспечивая процесс удвоения ДНК. При недостаточном поступлении с пищей, клетки захватывают из межклеточного пространства фрагменты отживших и разрушенных ДНК из погибших клеток. Синтез нуклеотидов и нуклеиновых кислот — один из наиболее активных процессов в клетке и уступает по активности только синтезу белка.
Воспроизводство нуклеотидов и нуклеиновых кислот требует значительного количества пластических веществ — азотистых оснований, а также углеводов, фосфатов. По затратам энергии этот процесс также относится к крайне напряженным. Из всего вышесказанного можно сделать вывод: обмен нуклеиновых кислот в клетке первичен и крайне важен. Он обеспечивает обновление клеток, полноценность их структуры и функциональную состоятельность. Поступление отдельных блоков нуклеиновых кислот с пищей невозможно. Поэтому в условиях повышенных нагрузок, стрессов и болезней стоит позаботится о получении организмом нуклеотидов. На основе фрагментов нуклеиновых кислот существует ряд лекарственных средств и БАДов. У всех них есть недостаток – низкая способность активного вещества попадать во внутреннюю среду организма (низкая биодоступность). Хромосомы — хранители генетической информации, находятся под особой «охраной» — в ядре клетки. Ядро ограниченно практически непроницаемой мембраной, при разрушении которой клетка гибнет. Если такое случается, то молекула ДНК теряет свои функции, но сохраняет строение. Нужны очень сильные ферменты – нуклеазы – для того, чтобы разрушить структуру нуклеиновой кислоты.
Перед каждым клеточным делением при абсолютно точном соблюдении нуклеотидной последовательности происходит самоудвоение молекулы ДНК. Удвоение начинается с того, что двойная спираль ДНК временно раскручивается. Это происходит под действием специального фермента – ДНК-полимеразы, в среде, где имеются свободные нуклеотиды. Каждая одинарная цепь по принципу химического сродства притягивает к нуклеотидным блокам свободные нуклеотиды, находящиеся в клетке и закрепляет водородными связями. Таким образом, если клетке пришло время обновляться, то есть делиться, требуются два условия: генетическая информация (которая во всех клетках имеется в ядре) и наличие строительного материала для создания новых молекул нуклеиновых кислот — «кирпичики - блоки» — нуклеотиды.Если нет строительного материала, генетическая информация не реализуется, клетка не разделится, ткань не обновится, функция органа снизится, и, как следствие — пострадает организм.
Откуда же появляются нуклеотиды для осуществления процессов деления?Обычно мы получаем нуклеиновые кислоты с пищей, так как поедаем органические вещества. Нуклеиновые кислоты имеются в любой пище. Особенно много их в яйцах, икре и мясе.
Нуклеиновые кислоты, которые попадают в наш организм с пищей, уже частично денатурированы (разложены) в процессе тепловой обработки пищи. Далее они подвергаются дальнейшему разложению под действием пищеварительных ферментов.Доказано, что нуклеиновые кислоты на 95-98% деградируют в тонком кишечнике до пуриновых и пиримидиновых оснований, сахаров и фосфорных остатков. Клетка с кровью получает эти простые вещества, синтезирует из них нуклеотиды, обеспечивая процесс удвоения ДНК. При недостаточном поступлении с пищей, клетки захватывают из межклеточного пространства фрагменты отживших и разрушенных ДНК из погибших клеток. Синтез нуклеотидов и нуклеиновых кислот — один из наиболее активных процессов в клетке и уступает по активности только синтезу белка.
Воспроизводство нуклеотидов и нуклеиновых кислот требует значительного количества пластических веществ — азотистых оснований, а также углеводов, фосфатов. По затратам энергии этот процесс также относится к крайне напряженным. Из всего вышесказанного можно сделать вывод: обмен нуклеиновых кислот в клетке первичен и крайне важен. Он обеспечивает обновление клеток, полноценность их структуры и функциональную состоятельность. Поступление отдельных блоков нуклеиновых кислот с пищей невозможно. Поэтому в условиях повышенных нагрузок, стрессов и болезней стоит позаботится о получении организмом нуклеотидов. На основе фрагментов нуклеиновых кислот существует ряд лекарственных средств и БАДов. У всех них есть недостаток – низкая способность активного вещества попадать во внутреннюю среду организма (низкая биодоступность).
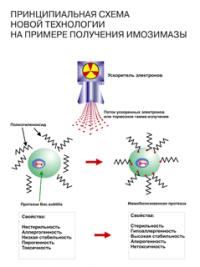 Ученые ЗАО "Сибирский центр фармакологии и биотехнологии" нашли способ увеличить биодоступность олигонуклеотидов. Высокая степень проникновения в организм активных веществ обеспечивается уникальной технологией —«АХIS-технологией» — технологией электронно-лучевого синтеза.
Суть заключается в следующем: биологически активное вещество при обработке пучком ускоренных электронов присоединяется к инертному носителю (полиэтиленоксиду). В результате получаются частицы размером в несколько сотен нанометров, устойчивые к действию пищеварительных ферментов.
Благодаря малым размерам, они легко проникают через мембрану клеток кишечной стенки и оказываются в кровяном русле. Затем эти частицы подвергаются биодеградации (разрушению биологическими средами). Активное вещество разносится с током крови и захватывается клетками, нуждающимися в них, а инертный носитель выводится из организма.
Парафармацевтики линейки «ДиЭнАй» созданы с целью устранить дефицит нуклеотидов. Поэтому в каждом из препаратов линейки «ДиЭнАй» содержатся олигонуклеотиды — короткие цепочки нуклеотидов. Олигонуклеотиды получены в результате очистки нуклеиновых кислот молок лососевых рыб от сопутствующих белков и последующей фрагментации — разделении цепочек ДНК и РНК на короткие звенья. Ученые ЗАО "Сибирский центр фармакологии и биотехнологии" нашли способ увеличить биодоступность олигонуклеотидов. Высокая степень проникновения в организм активных веществ обеспечивается уникальной технологией —«АХIS-технологией» — технологией электронно-лучевого синтеза.
Суть заключается в следующем: биологически активное вещество при обработке пучком ускоренных электронов присоединяется к инертному носителю (полиэтиленоксиду). В результате получаются частицы размером в несколько сотен нанометров, устойчивые к действию пищеварительных ферментов.
Благодаря малым размерам, они легко проникают через мембрану клеток кишечной стенки и оказываются в кровяном русле. Затем эти частицы подвергаются биодеградации (разрушению биологическими средами). Активное вещество разносится с током крови и захватывается клетками, нуждающимися в них, а инертный носитель выводится из организма.
Парафармацевтики линейки «ДиЭнАй» созданы с целью устранить дефицит нуклеотидов. Поэтому в каждом из препаратов линейки «ДиЭнАй» содержатся олигонуклеотиды — короткие цепочки нуклеотидов. Олигонуклеотиды получены в результате очистки нуклеиновых кислот молок лососевых рыб от сопутствующих белков и последующей фрагментации — разделении цепочек ДНК и РНК на короткие звенья.
|
|
|
|
|
|
|
|
|
|
|
|
|
Гомополисахариды
Яндекс.ДиректВсе объявления
| Фильмы новинки!Более 65 000 фильмов бесплатно! Смотри онлайн и без регистрации на IVI.RU!ivi.ru 16+ |
Яндекс.ДиректВсе объявленияБесплатные игры на АндроидКачайте самые новые и популярные бесплатные игры на Андроид с Google Playplay.google.com18+Установите Яндекс.БраузерПростой и быстрый. Встроенный Flash-плеер с автоматическим обновлением!browser.yandex.ru0+  Основы ценообразования.Практика ценообразования: определение цен, инструменты ценовой политики.mbschool.ru
Основы ценообразования.Практика ценообразования: определение цен, инструменты ценовой политики.mbschool.ru  Интернет-магазин Butik.ruОгромный выбор одежды, обуви и аксессуаров. Новинки! Бесплатная доставка.Адрес и телефон butik.ru
Интернет-магазин Butik.ruОгромный выбор одежды, обуви и аксессуаров. Новинки! Бесплатная доставка.Адрес и телефон butik.ru  Реферат на заказ на Work5!Закажи реферат от 450р без плагиата. Гарантии. Срок от 1 дня. Недорого!work5.ru
Реферат на заказ на Work5!Закажи реферат от 450р без плагиата. Гарантии. Срок от 1 дня. Недорого!work5.ru  Поршни поролоновые Скребки, ПоискОчистка, Диагностика труб 89-1420 мм. Приборы поиска,сопровождения скребковАдрес и телефон vostokoil.ru
Поршни поролоновые Скребки, ПоискОчистка, Диагностика труб 89-1420 мм. Приборы поиска,сопровождения скребковАдрес и телефон vostokoil.ru
По своему функциональному назначению гомополисахариды могут быть разделены на две группы: структурные и резервные полисахариды. Важным структурным гомополисахаридом является целлюлоза, а главными резервными – гликоген и крахмал (у животных и растений соответственно).
Строгая классификация по химическому строению или биологической роли вследствие отсутствия для многих полисахаридов исчерпывающих данных невозможна. Поэтому чаще всего полисахариды «именуются» по источникам выделения, несмотря на то что один и тот же полисахарид может быть получен из совершенно разных источников.
Крахмал, как отмечалось, является основным резервным материалом растительных организмов. В небольших количествах он содержится в листьях, но главным образом накапливается в семенах (зерна злаков, например пшеницы, риса, кукурузы, содержат до 70% крахмала), а также в луковицах, клубнях и сердцевине стебля растений, где содержание его доходит до 30%.
|
|
|
Крахмал представляет собой смесь 2 гомополисахаридов: линейного – амилозы и разветвленного –амилопектина, общая формула которых (С6Н10О5)n. Как правило, содержание амилозы в крахмалесоставляет 10–30%, амилопектина – 70–90%. Полисахариды крахмала построены из остатков D-глюкозы, соединенных в амилозе и линейных цепях амило-пектина α-1–>4-связями, а в точках ветвленияамилопектина – межцепочечными α-1–>6-связями:
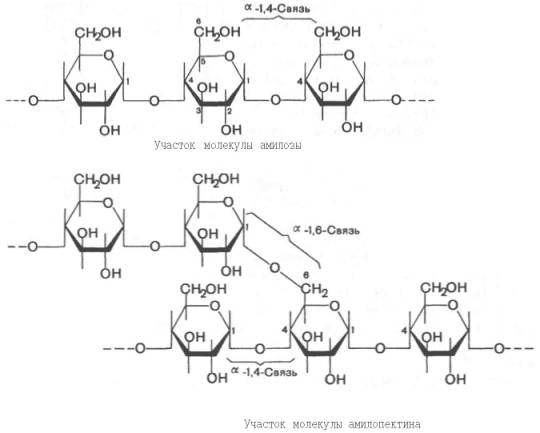
Итак, единственным моносахаридом, входящим в состав крахмала, является D-глюкоза. В молекуле амилозылинейно связано в среднем около 1000 остатков глюкозы; отдельные участки молекулы амилопектинасостоят из 20–30 таких единиц. В настоящее время общепринятой является «ветвистая» структура отдельных цепочек с α-1–>4-связями в молекуле амилопектина (рис. 5.3).
Известно, что в воде амилоза не дает истинного раствора. Цепочка амилозы в воде образует гидратированные мицеллы. В растворе при добавлениийода амилоза окрашивается в синий цвет. Амилопектин также дает мицеллярный раствор, но форма мицелл несколько иная. Полисахаридамилопектин окрашивается йодом в красно-фиолетовый цвет.
Крахмал имеет молекулярную массу 105–107 Да. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степениполимеризации – декстрины, при полном гидролизе – глюкоза.
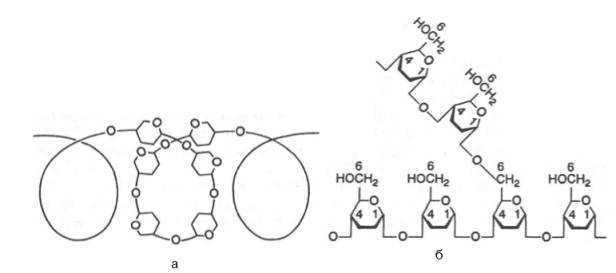
Рис. 5.3. Структура крахмала: а - амилоза с характерной для нее спиральной структурой; б - амилопектин, образующий в точках ветвления связи типа 1-6.
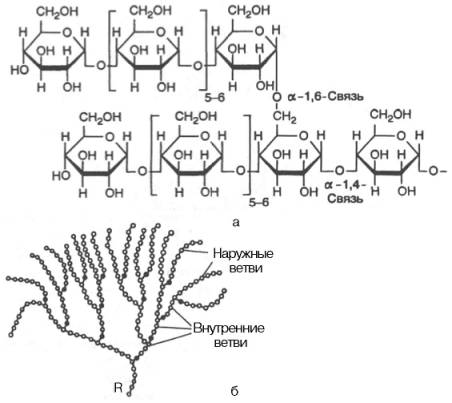
Рис. 5.4. Строение отдельного участка (а) и всей молекулы (б) гликогена (по Майеру). Белые кружки - остатки глюкозы, соединенные α-1,4-связью; черные кружки - остатки глюкозы, присоединенные α-1,6-связью; R - редуцирующая концевая группа. Внутренние цепи, или ветви,- участки между точками ветвления. Наружные цепи, или ветви, начинаются от точки ветвления и кончаются нередуцирующим остатком глюкозы.
Для человека крахмал является важным пищевым углеводом; содержание его в муке составляет 75–80%, в картофеле – 25%.
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено впечени и мышцах. Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок камилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуци-рующего конца цепи (рис. 5.4).
Гликоген характеризуется более разветвленной структурой, чем амило-пектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Инулин – полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно, он представляет собой фруктазан.
Метилирование инулина свидетельствует, что остатки D-фруктозы связаны между собой 2–>1-связями и находятся в фуранозной форме:
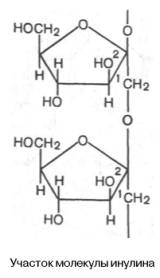
Степень полимеризации инулина равна примерно 35 моносахарным остаткам. Этот полисахарид в отличие от картофельного крахмала легко растворяется в теплой воде. Инулин используют в физиологических исследованиях для определения скорости клубочковой фильтрации в почках.
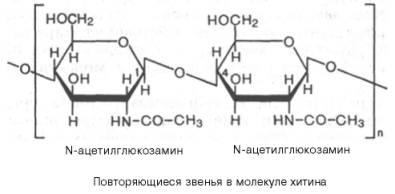
Хитин – важный структурный полисахарид беспозвоночных животных (главным образом членистоногих). Из него, в частности, построен наружный скелет ракообразных и насекомых.
Хитин также частично или полностью замещает целлюлозу в клеточных стенках сапрофитных растений, например грибов.
Структуру хитина составляют N-ацетил-D-глюкозаминовые звенья, соединенные β-(1–>4)-гликозидными связями:
Целлюлоза (клетчатка) – наиболее широко распространенный структурный полисахарид растительного мира. Он состоит из α-глюкозных остатков в их β-пиранозной форме, т.е. в молекуле целлюлозы β-глюко-пиранозные мономерные единицы линейно соединены между собой β-(1–>4)-связями:

При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном гидролизе – D-глюкоза. Молекулярная масса целлюлозы1000–2000 кДа. Клетчатка не переваривается ферментами пищеварительного тракта, так как набор этих ферментов у человека не содержитгидролаз, расщепляющих β-связи. В связи с этим целлюлозу можно рассматривать как значительный неиспользуемый «пищевой» резерв. Вместе с тем известно, что присутствие оптимальных количеств клетчатки в пище способствует формированию кала. При полном исключении клетчатки из пищи нарушается формирование каловых масс.
В кишечнике жвачных и других травоядных животных имеются микроорганизмы, способные к ферментативному расщеплению β-связей (β-глю-козидных связей), и для этих животных целлюлоза является важным источником пищевых калорий.
Наконец, целлюлоза и ее производные имеют колоссальное практическое значение. Основная масса целлюлозы используется для изготовления хлопчатобумажных тканей и бумаги. Кроме того, на основе целлюлозы производятся искусственные волокна, пластмассы и т.д. Характерной особенностью целлюлозы, определяющей в значительной степени ее механические, физико-химические и химические свойства, является линейнаяконформация молекул, закрепленная внутримолекулярными водородными связями.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Соединительная ткань
Перевод
Соединительная ткань
(textus connectivus)
развивающаяся из мезенхимы ткань животного организма, выполняющая опорную, трофическую, защитную и репаративную функцию.
Особенностью строения С. т. являются хорошо развитые межклеточные структуры (волокна и основное вещество). В зависимости отклеточного состава, строения и свойств межклеточных структур, их ориентации С. т. подразделяют на собственно соединительную, костную (см. Кость) и хрящевую (см. Хрящ) ткань. Собственно С. т. представлена рыхлой и плотной волокнистой неоформленной и плотной волокнистой оформленной С. т. К рыхлой волокнистой неоформленной С. т. относят подкожную клетчатку, С. т., заполняющую прослойки между органами, расположенную по ходу кровеносных сосудов и нервов и формирующую строму (интерстициальную ткань) паренхиматозных органов. Выделяют также С. т. со специальными свойствами — ретикулярную, являющуюся основой кроветворных и лимфоидных органов, эластическую (с большим количеством эластических волокон), жировую, а также пигментную, богатую пигментными клетками, например в сосудистой оболочке глаза. Перечисленные виды С. т. вместе с кровью и лимфой объединяют в систему тканей внутренней среды.
Наиболее распространенной С. т. человека и млекопитающих является рыхлая волокнистая ткань. Ее составляют практически все виды клеток и межклеточных структур, встречающиеся в различных типах С. т. Межклеточное вещество представлено волокнистыми структурами (коллагеновые, ретикулярные и эластические волокна) и основным веществом (аморфным компонентом межклеточного вещества), в которое заключены клетки и волокна. В состав коллагеновых и ретикулярных волокон входит коллаген различных типов, отличающихся молекулярной структурой.
Основное вещество представляет собой вязкий гель, состоящий в основном из макромолекул полисахаридов и большого количества тканевой жидкости, связанной с этими макромолекулами. Полисахариды основного вещества представлены преимущественно гликозаминогликанами, из которых важнейшими являются гиалуроновая кислота, гепарансульфат, хондроитин-4-сульфат, хондроитин-6-сульфат и дерматансульфат. Макромолекулярные комплексы, большая часть которых состоит из сульфатированных гликозаминогликанов, получила название протеогликанов. В составе основного вещества С. т. в небольшом количестве присутствуют гликопротеиды.
Различные виды С. т. отличаются между собой по типу и количеству секретируемых гликозаминогликанов. С возрастом содержание полисахаридов в С. т. уменьшается. Основное вещество С. т. обеспечивает диффузию кислорода и питательных веществ от капилляров к клеткам. В обратном направлении поступают продукты клеточного обмена.
Главной клеточной формой С. т. являются фибробласты, которые вырабатывают и секретируют проколлаген, проэластин игликозаминогликаны. Они также продуцируют белок микрофибрилл, входящий в состав эластических волокон. Доказано, что одна и та жеклетка может синтезировать коллаген двух типов. Морфологически различают фибробласты, способные к делению и активно синтезирующиебелки, и малоактивные клетки — фиброциты, потерявшие способность к делению. В фибробластах сильно развиты гранулярнаяэндоплазматическая сеть, пластинчатый комплекс (комплекс Гольджи) и другие структуры, характерные для секреторных клеток.
Фибробласты участвуют в заживлении ран, инкапсуляции инородных тел, регенерации и многих других физиологических и патологических процессах. По некоторым данным, фибробласты могут фагоцитировать и разрушать коллаген, участвуя т. о. в перестройке соединительной ткани. Наряду с типичными фибробластами выделяют так называемые миофибробласты, занимающие по функциональным и ультраструктурным признакам промежуточное положение между фибробластами и гладкомышечными клетками. Миофибробласты обеспечивают смыкание краев ран при их заживлении, прорезывание зубов и т.д.
Относительно происхождения фибробластов до сих пор нет единого мнения. Предполагают, что в эмбриональном периоде они дифференцируются непосредственно из мезенхимных клеток. В постнатальном онтогенезе, при регенерации С. т., источником фибробластов считают малодифференцированные клетки, располагающиеся вдоль капилляров. Согласно другой точке зрения, предшественники фибробластов локализуются в костном мозге и способны к миграции, что подтверждается обнаружением в периферической крови клеток, дающих начало колониям фибробластов в жидкостных культурах (КОКф). Опыты с различными индукторами, особенно с деминерализованным костным матриксом, показывают, что среди фибробластов имеются клетки, способные к трансформации в другие типы так называемых механоцитов (хондробласты, остеобласты, ретикулярные клетки) с переключением при этом на синтез коллагенов, свойственных данному типу механоцитов. Выявлены антигенные, метаболические и функциональные особенности фибробластов различной органной локализации.
Соединительная ткань богата макрофагами-гистиоцитами, относящимися к системе мононуклеарных фагоцитов (Система мононуклеарных фагоцитов) и выполняющими защитную функцию. Они фагоцитируют инородные частицы, бактерии, погибшие клетки. Макрофаги активно участвуют в воспалительных и иммунных реакциях, а также являются источниками целого ряда факторов-регуляторов клеточной пролиферации и дифференцировки. Предшественники макрофагов — кроветворные стволовые клетки, локализующиеся в костном мозге (Костный мозг).
В соединительной ткани находятся лаброциты (тучные клетки), также являющиеся потомками кроветворных стволовых клеток. Они содержатгепарин, гистамин и другие биологически активные вещества. Постоянно присутствуют в С. т. жировые, пигментные, плазматические клетки и различные виды лейкоцитов. Повсеместное распространение рыхлой С. т., ее роль в трофике клеток, защитных процессах делает эту ткань участником практически всех физиологических и патологических реакций (физиологическая и репаративная регенерация, воспаление, заживление ран, склеротические процессы и др.). Для С. т. с выраженной трофической (защитной) функцией характерно относительно большое количество и разнообразие клеток, в т.ч. лейкоцитов крови. В соединительной ткани преимущественно опорного типа преобладают межклеточные структуры, а клетки представлены только фибробластами или другими механоцитами (хрящевыми клетками, костными клетками).
В биохимическом отношении основными компонентами С. т. являются Коллагены, эластины, протеогликаны, Гликозаминогликаны и другие структурные гликопротеиды. К последним относятся адгезивные белки (фибронектин, ламинин и др.), обладающие сродством к другим белкам С. т. и участвующие в их объединении («склеивании»). Эти компоненты С. т. представляют собой высокополимерные вещества, которые локализуются во внеклеточном веществе (матриксе). Их биосинтез осуществляется в основном фибробластами, хондроцитами и др., в небольших количествах они синтезируются также эпителиальными, мышечными и нервными клетками.
Эти полимеры синтезируются в виде предшественников, которые после выхода в межклеточное вещество подвергаются «созреванию». Важно отметить, что полимеры матрикса функционально активны только в том случае, если они прошли весь путь созревания. Нарушение этого процесса, например отщепление от коллагена пептидных участков, ведет к тому, что не происходит формирования фибрилл, и ткани, в норме содержащие коллаген, теряют прочность и упругость (см. Элерса — Данлоса синдром). Аналогичный симптомокомплекс развивается и в случае нарушения образования поперечных связей между полипептидными цепочками, а также когда не происходит окисления некоторых аминокислот в белке. Нарушением формирования поперечных связей в белках С. т. можно объяснить ряд патологических проявлений, характерных для заболеваний, сопровождающихся гомоцистинурией. В некоторых случаях биохимической основой заболеваний С. т. является синтез молекул белка, больших по размерам, чем в норме. Так, при Марфана синдроме одна из полипептидных цепочек коллагена содержит на 20 аминокислот больше, чем нормальная цепь.
Нарушения метаболизма С. т. играют важную роль и в развитии многих приобретенных заболеваний. Так, избыточный синтез коллагена наблюдается при фиброзирующих процессах в легких, печени, нарушении регенерации при заживлении ран (келоидные рубцы). Различные нарушения обмена веществ, по-видимому, лежат в основе диффузных заболеваний соединительной ткани (Диффузные заболевания соединительной ткани).
Распад (катаболизм) С. т. осуществляется во внеклеточном веществе под воздействием специфических ферментов — коллагеназы, эластазы,протеазы, гликозидазы. Продуцируют эти ферменты те же клетки С. т., которые участвуют в синтезе ее белков. Известно, что клетки злокачественных опухолей синтезируют специфические и неспецифические протеазы, расщепляющие ткани, которые окружают опухоль, что способствует метастазированию. Усиленная деградация С. т., обусловленная повышенным синтезом протеолитических ферментов, наблюдается также при артрозах (см. Остеоартроз).
Изменения метаболизма С. т. играют важную роль в делении и дифференцировке клеток, формообразовании органов и тканей, а также в процессах развития и старения организма. Показано, что пролиферация и движение клеток на определенных стадиях онтогенеза контролируются уровнем синтеза адгезивных белков матрикса (фибронектина, ламинина и др.). Взаимодействие клеток с этими белками обусловлено тем, что на поверхности клетки имеются специальные рецепторы для каждого из этих белков. Нарушение взаимодействия рецепторов с белком С. т. во взрослом организме может быть причиной того, что клетки выходят из-под контроля окружающих тканей, приобретают способность к неконтролируемому росту. Имеются основания предполагать, что на этом основана малигнизация клеток.
При старении организма уменьшается растворимость коллагенов и эластинов, увеличивается содержание поперечных связей в белках, снижается содержание в ткани протеогликанов и гликозаминогликанов. Характерно также общее уменьшение клеточных элементов в С. т. Эти изменения определяют свойственные старению повышенную ломкость костей, они снижение эластичности кожи и стенок сосудов, ригидность суставов и т.д.
Биохимические методы, используемые при анализе метаболизма С. т. в норме и при патологии, характеризуются большим разнообразием приемов и подходов, из которых наиболее перспективными являются: методы генной инженерии; определение специфических метаболитов (оксипролина, пептидных фрагментов) белков С. т. в крови, моче, биопсийном материале; тестирование активности различных ферментов (коллагеназы, гиалуронидазы и др.) в суставной и других биологических жидкостях. Широко используется анализ обменных процессов С. т. в модельных системах (культурах клеток и тканей, бесклеточных системах белкового синтеза). Широкое применение нашли иммунохимические, цитохимические, электронно-микроскопические методы изучения биосинтеза и структуры биополимеров.
Библиогр.: Мазуров В.И. Биохимия коллагеновых белков, М., 1974; Никитин В.Н., Перский Е.Э. и Утевская Л.А. Возрастная и эволюционнаябиохимия коллагеновых структур, Киев, 1977; Серов В.В. и Шехтер А.Б. Соединительная ткань, М., 1981; Хэм А. и Кормак Д. Гистология, т. 2
Коллаген
Коллаген (от греческого kólla — клей и... ген), фибриллярный белок группы склеропротеинов, основная часть коллагеновых волокон соединительные ткани животных. Молекулы К. (длина около 3000  , толщина 15
, толщина 15  ) состоят из трёх полипептидных цепей, закрученных в спирали. Для первичной структуры молекул К., характерна частая повторяемость последовательности глицил — пролил — оксипролил (всего около 1/3 всех остатков аминокислот), что влияет на конфигурацию цепей К. (см. Биополимеры). К. зрелых волокон не растворяется в воде и органических растворителях; для его растворения используют растворы щёлочи (до 10%). Часть К. незрелых волокон (так называемый проколлаген или тропоколлаген) может быть растворена в слабой кислоте. При нагревании в воде происходит резкое сокращение волокон К. (сваривание К.): при длительном нагревании — денатурация К. и превращение его в желатину. К. составляет около трети всех белков животных и является важным структурным компонентом соединительной ткани, сухожилий, связок, хрящей, кожи, костей, чешуи рыб, выполняя главным образом опорные функции; в растениях К. отсутствует. Дубильные вещества повышают устойчивость волокон К. к химическим, физическим и бактериальным воздействиям, на чём основана обработка кож и мехов.
) состоят из трёх полипептидных цепей, закрученных в спирали. Для первичной структуры молекул К., характерна частая повторяемость последовательности глицил — пролил — оксипролил (всего около 1/3 всех остатков аминокислот), что влияет на конфигурацию цепей К. (см. Биополимеры). К. зрелых волокон не растворяется в воде и органических растворителях; для его растворения используют растворы щёлочи (до 10%). Часть К. незрелых волокон (так называемый проколлаген или тропоколлаген) может быть растворена в слабой кислоте. При нагревании в воде происходит резкое сокращение волокон К. (сваривание К.): при длительном нагревании — денатурация К. и превращение его в желатину. К. составляет около трети всех белков животных и является важным структурным компонентом соединительной ткани, сухожилий, связок, хрящей, кожи, костей, чешуи рыб, выполняя главным образом опорные функции; в растениях К. отсутствует. Дубильные вещества повышают устойчивость волокон К. к химическим, физическим и бактериальным воздействиям, на чём основана обработка кож и мехов.
Лит.: Финеан Дж. Биологические ультраструктуры, пер. с. англ., М., 1970; Treatise on collagen. ed. G. N. Ramachandran, B. Gould, v. 1—2, N. Y., 1967—68.
Эластин
Эластин, белок из группы склеропротеинов, составляет основную массу эластичных волокон соединительной ткани. Особенно богаты Э. шейные связки, стенки аорты (до 40% на сухую массу); в ткани лёгких количество Э. увеличивается с возрастом от 0,05 до 15% (на сухую массу). Э. нерастворим в воде, разбавленных растворах солей, кислот и щелочей даже при нагревании. В Э. велико количество аминокислотных остатков с неполярными боковыми группами, что, по-видимому, обусловливает высокую эластичность его волокон. Подобно коллагену, Э. богат глицином и пролином.
Э. трудно поддаётся расщеплению протеолитическими ферментами; в пищеварительном тракте переваривается главным образом под влиянием фермента эластазы. Э. обнаружен у всех позвоночных, кроме круглоротых; у беспозвоночных отсутствует.
Лит.: Гауровиц Ф., Химия и функции белков, пер. с англ., 2 изд., М., 1965; Elastin and Elastic tissue, N. Y. — L., 1977.
Каротин (от лат. carota — морковь) — жёлто-оранжевый пигмент, непредельный углеводород из группы каротиноидов.
Эмпирическая формула С40H56. Нерастворим в воде, но растворяется в органических растворителях. Содержится в листьях всех растений, а также в корне моркови, плодах шиповника и др. Является провитамином витамина А. Зарегистрирован в качестве пищевой добавки Е160a.
|
|
|


