 |
Общие сведения о строении вещества
|
|
|
|
Основными элементарными частицами, из которых строятся все известные нам вещества, являются протоны, электроны, нейтроны.
Из протонов и нейтронов состоит атомное ядро, а электроны заполняют атомные оболочки, компенсируя положительный заряд ядра. Как вам известно, строение ядра атома, периодичность заполнения оболочек электронами можно находить с помощью таблицы Менделеева.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Размеры атомов около 0,1 нм, размеры положительных ионов, получившихся из атомов, лишившихся части электронов, меньше, чем размеры атомов, а размеры отрицательных ионов, присоединивших дополнительные электроны больше, чем размеры соответствующих атомов, потерявших или присоединивших электроны.
Молекулы газов содержат различное число атомов. Так, например:
Одноатомные газы – He, Ne, Ar.
Двухатомные газы – O2, N2, H2, Cl2.
Трехатомные – СO2.
Четырехатомные - NH3.
Наиболее часто встречаются молекулы, в которых существуют ковалентные и ионные химические связи.
1. Ковалентная связь – связь, объединяющая несколько атомов в молекулу, что достигается за счет электронов, которые являются общими для атомов. К примеру, молекула хлора Cl2 состоит из двух атомов хлора:
| В результате образуется устойчивая конфигурация молекул за счет двух не спаренных электронов |
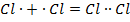
Химическая связь такого типа осуществляется в молекулах H2, O2, CO, а также наблюдается в молекулах, образованных металлоидными атомами, например, в вышерассмотренной молекуле хлора.
Выделяют ковалентную полярную и неполярную связь.
Молекулы, в которых центры одинаковых по величине положительных и отрицательных зарядов совпадают, являются неполярными. Иными словами, е сли атомы, образующие ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такую связь имеют простые вещества, например: О2, N2, Cl2.
|
|
|
Если же, в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называют полярными или дипольными. Такое соединение образуется между двумя различными неметаллами.
Полярная связь характеризуется величиной дипольного момента, которая направлена от «-» заряда к «+».

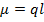
2. Ионная связь. Определяется силами притяжения между положительными и отрицательными ионами. Твердые тела ионной структуры характеризуются повышенной механической прочностью и относительно высокой температурой плавления.
Ионная связь— крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей, то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:

3. Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
|
|
|
Основные свойства:
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с плаcтичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
4. Молекулярная связь (связь Ван-дер-Ваальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Наблюдается между молекулами некоторых веществ, например, у парафина, имеющих низкую температуру плавления, свидетельствующую о непрочности их кристаллической решетки.
|
|
|


