 |
Приготовление растворов заданной концентрации
|
|
|
|
Лабораторная работа №8
Цель работы: приобретение навыков приготовления растворов заданной концентрации, выраженной различными способами, из сухой соли или более концентрированного раствора.
Оборудование и реактивы: конические колбы на 250 мл, технохимические весы, фильтровальная бумага, мерные цилиндры, набор ареометров, мерные колбы на 100 мл, сухие соли, например NaCl, KCl, Na2CO3, BaCl2, CaCl2, CuSO4.
9.1 Теоретические пояснения
Концентрация раствора – это относительное содержание растворенного вещества в растворе.
Рассмотрим некоторые способы выражения концентрации раствора.
− Массовая доля вещества w(Х).
Это безразмерная величина, равная отношению массы растворенного вещества m(X) к общей массе раствора m(р-ра):
w(Х)=  . (9.1)
. (9.1)
Часто массовую долю выражают в процентах и называют процентной концентрацией по массе:
w %(Х)=  .× 100%. (9.2)
.× 100%. (9.2)
Массовую долю также можно выражать в промилле (0/00) – это 0,1%; в ррm – это 10-4% и в ррв – это 10-7% (одна часть на миллиард).
Массовая доля вещества, выраженная в процентах, показывает, сколько граммов данного вещества содержится в 100 граммах раствора.
− Молярная концентрация вещества или молярность
Обозначается С(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к объему раствора V, выраженному в литрах:
 . (9.3)
. (9.3)
Молярная концентрация выражается в моль/л. В литературе часто встречаются сокращенные обозначения, например запись “1М раствор” означает раствор, имеющий концентрацию 1 моль/л, его еще называют одномолярным раствором.
− Молярная концентрация вещества эквивалента
Обозначается С(1/z X). Эту концентрацию еще называют эквивалентной концентрацией, нормальной концентрацией или нормальностью. Она представляет собой отношение количества вещества эквивалента n(1/z Х), выраженного в моль, к объему раствора V, выраженного в литрах:
|
|
|
 . (9.4)
. (9.4)
Данная концентрация выражается в моль/л, иногда, чтобы подчеркнуть отличие от молярной концентрации, записывают моль экв./л. Возможны также сокращения, например запись “1н. раствор“ означает раствор, в одном литре которого содержится 1 моль вещества эквивалента, такой раствор называют однонормальным.
Так как вещества взаимодействуют друг с другом в эквивалентных количествах, то для двух растворов взаимодействующих веществ выполняется равенство
V(X1)×C(1/z1 X1)= V(X2)×C(1/z2 X2) (9.5)
Следовательно, растворы равной нормальности реагируют в равных объемах.
− Моляльная концентрация (моляльность)
Обозначается b(Х). Это отношение количества растворенного вещества n(Х), выраженного в моль, к массе растворителя m, выраженной в килограммах:
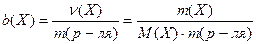 . (9.6)
. (9.6)
Данная концентрация выражается в моль/кг.
− Титр
Обозначается Т(Х). Это масса растворенного вещества в граммах, содержащаяся в одном миллилитре раствора:
Т(Х)=m(X):V. (9.7)
Титр выражается в г/мл (г/см3).
− Молярная доля (мольная доля)
Обозначается  . Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
. Представляет собой отношение количества вещества данного компонента, выраженного в моль, к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
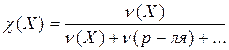 . (9.8)
. (9.8)
Может быть безразмерной величиной или выражаться в процентах.
− Объемная доля
Обозначается j(Х). Представляет собой отношение объема данного компонента системы к общему объему системы:
j(Х)=V(X):V. (9.9)
Может быть безразмерной величиной или выражаться в процентах.
Для перехода от массы раствора к его объему и наоборот нужно знать величину плотности r:
r=m:V. (9.10)
Плотность выражается в г/см3 (г/мл), кг/м3, г/л, и в других единицах.
Для приближенного, но быстрого измерения плотности служит ареометр, или денсиметр, изображенный на рисунке 9.1.
|
|
|

Рисунок 9.1 – Определение плотности жидкости при помощи ареометра
Ареометр представляет собой поплавок с дробью и узкой трубкой. На трубке имеется шкала, проградуированная в единицах плотности. Ареометр погружается в различные жидкости или растворы различной концентрации на разную глубину. При этом вытесняются различные объемы жидкостей, но массы их всегда одинаковы, они равны массе ареометра.
В состоянии равновесия выталкивающая сила, действующая на ареометр, уравновешивается силой тяжести:
Fвыт.= mg
или
rж.×V×g=mg,
следовательно,
V=m/rж..
Итак, объем вытесненной жидкости (или глубина погружения) обратно пропорционален плотности жидкости rж. Это позволяет проградуировать ареометр, погружая его в растворы с точно известной плотностью, а затем измерять этим ареометром плотности других растворов.
Для измерения плотности жидкость наливают в чистый цилиндр. Из набора выбирают ареометр, который погружается на такую глубину, чтобы уровень жидкости в цилиндре находился в пределах шкалы ареометра. Ареометр не должен касаться дна и стенок цилиндра. Показания следует снимать по нижнему краю мениска в случае прозрачной жидкости, и по верхнему – в случае непрозрачной. Зная плотность раствора, по специальным таблицам можно определить массовую долю раствора, и наоборот, зная концентрацию раствора, определить его плотность. Зависимость массовой доли от концентрации для растворов некоторых солей приведена в таблице 9.1.
Таблица 9.1 – Массовая доля w % и плотность r растворов солей при 20 0С
| w % | r, г/см3 | |||||
| CaCl2 | NaCl | CuSO4 | KCl | Na2CO3 | BaCl2 | |
| 1,0070 1,0148 1,0316 1,0486 1,0659 1,0835 1,1015 1,1198 | 1,0053 1,0125 1,0226 1,0413 1,0559 1,0707 1,0857 1,1009 | 1,009 1,019 1,040 1,062 1,084 1,107 1,131 1,155 | 1,0046 1,0110 1,0239 1,0369 1,0500 1,0633 1,0768 1,0905 | 1,009 1,019 1,040 1,061 1,082 1,103 1,085 1,101 | - 1,016 1,034 1,053 1,072 1,092 1,113 1,134 |
Если в таблице отсутствует необходимое значение величины, то применяют метод интерполяции (нахождение промежуточного значения величины по известным крайним значениям). В данном случае применяется линейная интерполяция: считается, что в узких интервалах зависимость между плотностью и концентрацией линейна. Это является, в некоторой степени, приближением. В действительности возможны и отклонения от линейности.
|
|
|
Допустим, нужно определить плотность 2,3% раствора хлорида натрия. Такой концентрации в таблице нет. Ближайшие значения массовой доли – 2% и 4%, им соответствуют плотности растворов 1,0125 г/см3 и 1,0226 г/см3. Следовательно, при изменении концентрации на 2%, плотность раствора изменится на 1,0226-1,0125=0,0101 г/см3. Составив пропорцию, найдем, как изменится плотность при изменении концентрации на 0,3%:
2% _____на 0,0101 г/см3
0,3% ____на х
Из пропорции х =0,0015 г/см3. Прибавив эту величину к значению плотности 2% раствора, получим плотность 2,3% раствора:
1,0125+0,0015=1,0140 г/см3.
9.2 Методика проведения опытов
|
|
|


