 |
Реакции полимеризации пропена
|
|
|
|
Реакция монобромирования бутана в условиях радикального механизма
Реакции радикального присоединения— реакции присоединения, в которых атаку осуществляют свободные радикалы — частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и нейтральные частицы.
Реакции радикального присоединения обозначают AdR.
Реакции свободнорадикального присоединения характерны для алкенов, которые часто вступают в них вместо реакций электрофильного присоединения в присутствии источника свободных радикалов
Механизм реакции радикального присоединения включает в себя следующие стадии:
1. Первая стадия — инициирование цепи. Она может начаться спонтанно, фотохимически, электрохимически, посредством нагревания или путем химического иницирования[2].
2. Вторая стадия — развитие цепи. На этой стадии радикалы реагируют с молекулами, образуя продукты реакции и новые радикалы.
3. Третья стадия — обрыв цепи или рекомбинация свободных радикалов.

Реакции радикального замещения ускоряются в условиях генерирования свободных радикалов и замедляются в присутствии веществ, улавливающих свободные радикалы.
Радикальное присоединение идет против правила Марковникова (эффект Хараша). Вызвано это повышенной стабильностью третичных, аллильных и некоторых других радикалов, образующихся при присоединении атакующего радикала в определённую позицию в молекуле.
Сравнение свойств альдегидов и кетонов в условиях реакции нуклеофильного присоединения

Наличие в молекуле альдегида или кетона электрофильного центра — атома углерода карбонильной группы — предопределяет возможность нуклеофильной атаки. Местом электрофильной атаки служит основный (нуклеофильный) центр — атом кислорода карбонильной группы. Кроме того, в альдегидах и кетонах имеется слабый СН-кислотный центр, атом водорода которого обладает с определенной протонной подвижностью и может, в частности, подвергаться атаке основанием. Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины эффективного положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина дельта+ на нем в альдегидах и кетонах убывает в следующем ряду.
|
|
|

Пространственная доступность карбонильного атома углерода уменьшается при замене водорода на более объемистые органические радикалы. Поэтому альдегиды более реакционноспособны, чем кетоны.Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т. е. альдегидную группу —СН=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими.Изомерия альдегидов связана только со строением радикалов.Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи.
Двухосновные карбоновые кислоты
Двухосновные карбоновые кислоты — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.
Химические свойства
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые — эти свойства обусловлены наличием карбоксильной группы:
- диссоциация в водных растворах
|
|
|
- образование солей: в отличие от монокарбоновых кислот, дикарбоновые способны образовывать кислые соли;
- образование галогенангидридов.
В то же время есть существенные различия, обусловленные наличием второй карбоксильной группой:
склонность к образованию хелатов;
образование некоторыми кислотами циклических ангидридов;
способность образовывать полимеры в реакции с другими полифункциональными соединениями.
Примеры
Щавелевая кислота Этандиовая кислота HOOC—COOH
Малоновая кислота Пропандиовая кислота НООС—СН2—СООН
Янтарная кислота Бутандиовая кислота НООС—(СН2)2—СООН
Фталевая кислота Бензол-1,2-дикарбонавя кислота 
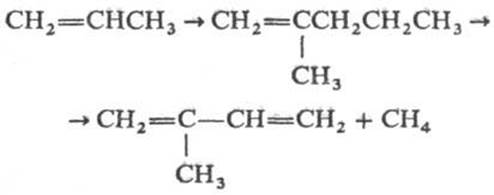
Реакции полимеризации пропена
Пропен (пропилен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этена, горючий газ, относится к углеводородам ряда этена (алкены или олефины).
- Полимеризация
Условия реакции: нагревание, присутствие Катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных π-cвязей и образования новых межмолекулярных σ-cвязей

В присутствии Катализаторов Циглера - Натты (в массе, в растворе или псевдоожиженном слое) пропен полимеризуется до полипропилена; в присутствии металлоорганических комплексных Катализаторов образуются этен-пропиленовые сополимеры, обладающие свойствами натуральных каучуков; при полимеризации на кислотных Катализаторах (А1С13, HF, Н3РО4) - три- и тетрамеры пропена, на щелочных Катализаторах-4-метил-1-пентен, полимеры которого обладают уникальными теплофизическими свойствами, в присутствии А1k3А1-2-метил-1-пентен, деметилированием которого получают изопрен:
|
|
|


