 |
метода электронного баланса.
|
|
|
|
Он основан на том, что общее число электронов, отдаваемых" восстановителем и "принимаемых" окислителем в одной и той же реакции должно быть одинаковым. Метод электронного баланса рассматривает, как правило, не реально существующие частицы, а условные ионы, т.е. атомы, взятые в данной СО. Поэтому он, с одной стороны, носит формальный характер, а, с другой, может применяться для различных ОВР. При этом рекомендуется определенная последовательность действий.
Рассмотрим ее на примере ОВР, схема которой:
Na2SO3 + K2Cr2O7 + H2SO4→Na2S2O6 + Cr2(SO4)3 + K2SO4 + H2O + Na2SO4.
1. Для заданной схемы реакции находим, какое вещество является
восстановителем, а какое - окислителем. С этой целью необходимо определить
СО атомов в исходных веществах и в продуктах реакции:
Na2+1S+4O3-2 + K2+1Cr2+6O7-2 + H2+1S+6O4-2→Na2+1S2+5O6-2 + Cr2+3(S+6O4-2)3 +К2 +1S+6O4-2 + H2+1O-2 + Na2+1S+6O4-2
.
Видно, что Na2SO3 является восстановителем за счет атома серы, СО
которого повышается с +4 до +5, а K2Cr2O7 - окислителем за счет атомов хрома,
понижающих СО с +6 до +3.
2. Составляем электронные уравнения процессов:
окисления
S+4 - e = S+5
и восстановления
Cr+6 + 3e = Cr+3
.
3. Находим наименьшее общее кратное (НОК) для чисел "отданных" и
"присоединенных" электронов и с его помощью определяем множители для обоих
электронных уравнений: НОК для 1 и 3 равно 3; множитель для первого
уравнения 3: 1 = 3; множитель для второго уравнения 3: 3 = 1. Обычно это записывают так:
Восстановитель: S+4 - e = S+5 3 Окисление
Окислитель: Cr+6 + 3e = Cr+3 1 Восстановление.
Схему подобного типа называют схемой электронного баланса или
просто электронным балансом.
4. Подставляем коэффициенты в уравнение реакции к формулам
восстановителя, окислителя, продуктов окисления и восстановления, перенося
|
|
|
туда коэффициенты из суммарного уравнения электронного баланса:
6Na2SO3 + K2Cr2O7 + H2SO4→ 3Na2S2O6 + Cr2(SO4)3 + K2SO4 + H2O + Na2SO4
5. Проверяем правильность расстановки коэффициентов, подсчитав
суммарное число атомов каждого элемента в левой и правой частях уравнения.
Чаще всего ограничиваются подсчетом числа атомов кислорода в исходных
веществах и продуктах.
Окончательный вид уравнения
6Na2SO3 + K2Cr2O7 + 7H2SO4 = 3Na2S2O6 + Cr2(SO4)3 + K2SO4 + 7H2O + 3Na2SO4
Более сложным методом расстановки коэффициентов в ОВР, является метод ионных полуреакций.
Все реакции протекают в различных средах: кислой, нейтральной и щелочной.
Правила оформления уравнений ОВР, протекающих в кислой среде.
1) Записываем схему реакции.
2) Записываем в ионном виде полуреакции окисления и восстановления. Слабые электролиты, твердые и газообразные вещества записываем в молекулярном виде.
3) На основании закона сохранения массы и энергии при составлении уравнений полуреакций следует соблюдать баланс веществ и баланс зарядов.
4) Для уравнивания числа атомов кислорода в полуреакции в ту часть, где он в избытке, добавляем столько катионов водорода Н+, чтобы, связавшись с атомами кислорода, образовалась молекула воды:
· добавляем Н+ в ту часть полуреакции, где избыток кислорода;
· в противоположную часть добавляем Н2О;
· уравниваем атомы кислорода, затем атомы водорода;
· подсчитываем заряды в полуреакциях, уравниваем заряд, для этого отнимаем или добавляем электроны.
5) Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях.
6) Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой. Результат – суммарное ионное уравнение.
7) Сокращаем в правой и левой части одинаковые молекулы и ионы.
8) Добавляем недостающие катионы или анионы. Следует учесть, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
|
|
|
Правила оформления уравнений ОВР, протекающих в щелочной среде.
4) Для уравнивания атомов водорода и кислорода в уравнениях для щелочной среды:
· добавляем воду в ту часть полуреакций, где избыток кислорода;
· в противоположную часть добавляем удвоенное число гидроксид-ионов;
· перед Н2О ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед ОН─ - его удвоенный коэффициент.
Правила оформления уравнений ОВР, протекающих в нейтральной среде.
Среду нейтральной считают условно. На самом деле вследствие гидролиза соли среда может быть слабокислотной или слабощелочной, поэтому полуреакции можно оформлять двумя способами.
4) Способ 1 – без учета гидролиза соли. Так как среда нейтральная, в левые части полуреакций добавляют воду и тогда одну полуреакцию оформляем как для кислотной среды (добавляется Н2О + Н+), а в другую – как для щелочной среды (добавляется Н2О + ОН─).
4) Способ 2 – если при оформлении полуреакций появляется небольшой избыток Н+ или ОН─ ионов, то обе полуреакции удобнее и правильнее будет оформлять как для кислотной или щелочной среды.
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов
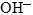 Уравнивание осуществляется за счет ионов
Уравнивание осуществляется за счет ионов 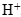 и молекул воды.
и молекул воды. - В щелочной среде ни в левой, ни в правой части не должно быть ионов
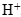 . Уравнивание осуществляется за счет ионов
. Уравнивание осуществляется за счет ионов 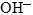 и молекул воды.
и молекул воды. - В нейтральной среде ни ионов
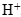 , ни
, ни 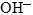 в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион 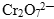 содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
Полуреакция восстановления: 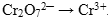
Ионы  могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления:
могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления: 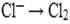
|
|
|

Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
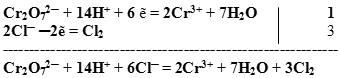
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов  ─ была соль
─ была соль  , поэтому с каждым молем
, поэтому с каждым молем 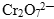 в раствор попадает 2 моль ионов
в раствор попадает 2 моль ионов 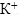 . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов
. В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов 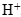 в раствор вносится 14 моль ионов
в раствор вносится 14 моль ионов  . Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы
. Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы 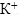 , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
, в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
В результате получаем:
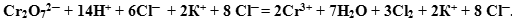
После этого можно объединить ионы в формулы реальных веществ:

Рассмотрим другой пример.
Задача. Закончить уравнение реакции 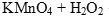 → …
→ …
Ион 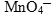 содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
Полуреакция восстановления: 
Если ион 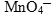 будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления:
будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления:
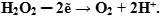
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
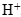 , ни
, ни 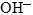 в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
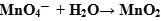
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:

- Перед
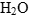 ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед 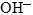 - его удвоенный коэффициент:
- его удвоенный коэффициент:
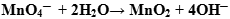
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
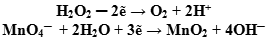
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
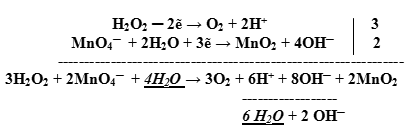
|
|
|
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
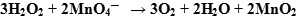
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
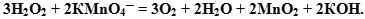
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции: 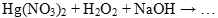
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
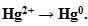
- Если ион
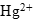 будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
будет выступать в роли окислителя, то пероксид водорода - в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
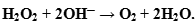
- Оформляем уравнение ОВР, протекающей в щелочной среде:
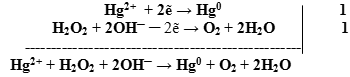
- Добавляем недостающие катионы и анионы.
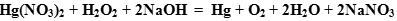
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Самостоятельная работа студентов:
Уравняйте следующие реакции. Указать окислитель и восстановитель:
1) KMnO4 + K2SO3 + H2SO4 = MnSO4 + K2SO4 + H2O
2) KMnO4 + K2SO3 + H2O = MnO2 + K2SO4 + KOH
3) KMnO4 + K2SO3 + KOH = K2MnO4 + K2SO4 + H2O
4) KMnO4 + H2S + H2SO4 = MnSO4 + K2SO4 + S + H2O
5) K2Cr2O7 + SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
6) K2Cr2O7 + KI + H2SO4 = Cr2(SO4)3 + K2SO4 + I2 + H2O
7) KMnO4 + HCl = Cl2↑ + MnCl2 + KCl + H2O
8) K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + K2SO4 + S + H2O
9) K2MnO4 + H2O = MnO2 + KMnO4 + KOH
10) NaBr + H2SO4 + NaBrO3 = Br2 + Na2SO4 + H2O
11) (NH4)2Cr2O7 = Cr2O3 + N2↑ + H2O
Процесс дыхания, как ОВР.
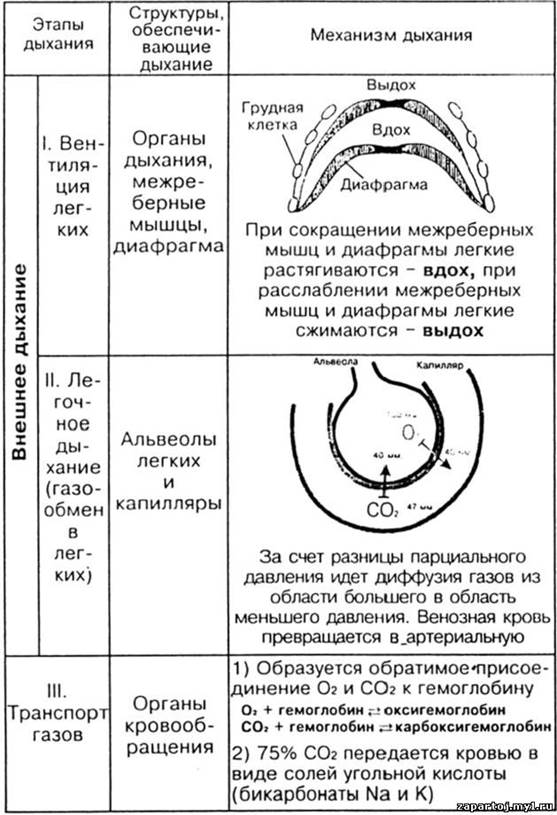
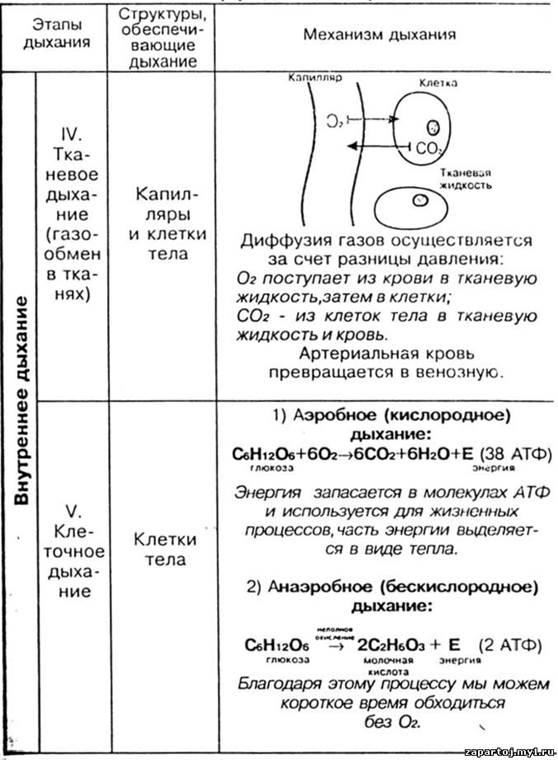
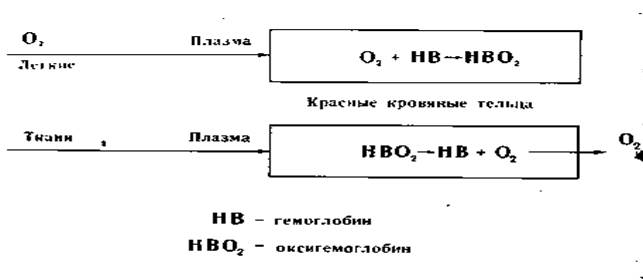
Взрослый человек, находясь в состоянии покоя, совершает в среднем 14 дыхательных движений в минуту. Вместе с тем, частота дыхания может претерпевать значительные колебания (от 10 до 18 за минуту). У детей частота дыхания составляет 20-30 дыхательных движений в минуту; у грудных детей — 30-40; у новорождённых — 40-60.
В течение одного вдоха (в спокойном состоянии) в лёгкие поступает 400—500 мл воздуха. Этот объём воздуха называется дыхательным объёмом (ДО). Такое же количество воздуха поступает из лёгких в атмосферу в течение спокойного выдоха. Максимально глубокий вдох составляет около 2000 мл воздуха. Максимальный выдох также составляет около 2000 мл.. В спокойном состоянии и при нормальных метеорологических условиях, когда температура воздуха держится в пределах 18—22° и относительная влажность составляет 40—70 процентов, человек может пропустить через свои легкие около 8 литров воздуха в минуту, то есть около 500 литров в час. При этом человеческий организм получает примерно 22 литра кислорода. При выполнении тяжелой физической работы или при быстрых движениях дыхание у человека учащается и количество воздуха, пропускаемого через легкие, увеличивается в 10 и более раз. Так, например, спортсмены при беге или плавании вдыхают и выдыхают в минуту 120— 130 литров воздуха; соответственно увеличивается и количество кислорода, получаемого организмом.
|
|
|
|
|
|


