 |
Типичные окислители и восстановители
|
|
|
|
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных форм обучения
Нижний Новгород 2012
Составители: А.Д. Самсонова, А.Л.Галкин, Т.В.Сазонтьева
УДК 54 (07)
Окислительно-восстановительные реакции: методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных форм обучения/ НГТУ им. Р.Е. Алексеева сост.: А.Д. Самсонова, А.Л.Галкин,Т.В.Сазонтьева. Н.Новгород, 2012. 36 с.
Предложены теоретическая часть, вопросы и задачи для домашних и практических занятий, а также описание лабораторных работ по теме «Окислительно-восстановительные реакции»
Научный редактор Паничева Г.А.
Редактор Э. Б. Абросимова
Подп. к печ. 10.09.2012 Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ. л. 2,25. Уч.-изд. л.. Тираж 1500 экз. Заказ
Нижегородский государственный технический университет
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный технический
университет, им. Р.Е. Алексеева, 2012
Теоретическая часть
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Химические реакции можно разделить на два типа. К первому относятся реакции, которые идут без изменения степени окисления атомов реагирующих веществ. В таких реакциях взаимодействие электронных оболочек у реагирующих частиц сводится к образованию общих молекулярных орбиталей. Все электроны остаются общей принадлежностью этих частиц, между которыми возникает ковалентная связь.
|
|
|
Ко второму типу относятся реакции, которые протекают с изменением степени окисления атомов реагирующих веществ. В таких реакциях столкновение частиц сопровождается переходом электронов от одного из реагентов к другому. Эти реакции получили название «ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ». В отечественной литературе часто используется сокращение ОВР, а в иностранной REDOX от латинских восстановление-окисление. Окислительно-восстановительная реакция – это единый процесс, состоящий из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление – это процесс потери электронов атомом, молекулой или ионом.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом.
Частица, отдающая свои электроны, в ходе реакции окислятся. Ее принято называть ВОССТАНОВИТЕЛЕМ (обозначим ее как ВОС):
ВОС - n  → продукт окисления (окисленная форма).
→ продукт окисления (окисленная форма).
Частица, которая эти электроны присоединяет, в ходе реакции восстанавливается. Ее принято называть ОКИСЛИТЕЛЕМ (обозначим ее как ОК):
ОК + n  → продукт восстановления (восстановленная форма).
→ продукт восстановления (восстановленная форма).
Например, в реакции  +
+ 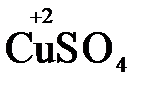 →
→  +
+ 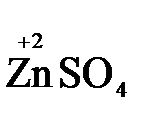
 - 2
- 2 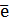 →
→  (полуреакция окисления)
(полуреакция окисления)
Восстановитель окисленная форма
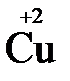 +2
+2 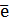 = →
= →  (полуреакция восстановления)
(полуреакция восстановления)
Окислитель восстановленная форма
Окислительно-восстановительные реакции очень широко распространены в природе. К ним относятся реакции фотосинтеза у растений, дыхание живых организмов, процессы горения и коррозии металлов и многие другие.
СТЕПЕНЬ ОКИСЛЕНИЯ
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
|
|
|
В отличие от реально существующих зарядов у ионов, степень окисления показывает лишь условный заряд атома в молекуле. Она может быть отрицательной, положительной и нулевой. Например, степень окисления атомов в простых веществах равна «0» (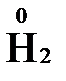 ,
,  ,
, 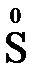 ,
,  ). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).
). В химических соединениях атомы могут иметь постоянную степень окисления или переменную. У металлов главных подгрупп I, II и III групп Периодической системы в химических соединениях степень окисления, как правило, постоянна и равна соответственно Ме+1, Ме+2 и Ме+3 (Li+, Ca+2, Al+3). У атома фтора всегда -1. У хлора в соединениях с металлами всегда -1. В подавляющем числе соединений кислород имеет степень окисления -2 (кроме пероксидов, где его степень окисления -1), а водород +1(кроме гидридов металлов, где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной кислоты H2SO4 атом водорода имеет степень окисления +1, а атом кислорода -2. Так как атомов водорода два, а атомов кислорода четыре, то мы имеем два «+» и восемь «-». До нейтральности не хватает шесть «+». Именно это число и является степенью окисления серы - 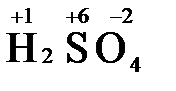 . Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 (
. Молекула дихромата калия K2Cr2O7 состоит из двух атомов калия, двух атомов хрома и семи атомов кислорода. У калия степень окисления всегда +1, у кислорода -2. Значит, мы имеем два «+» и четырнадцать «-». Оставшиеся двенадцать «+» приходятся на два атома хрома, у каждого из которых степень окисления равна +6 ( ).
).
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F2, O2, Cl2, S);
|
|
|
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO4-);
3) перекисные соединения.
Конкретными веществами, применяемыми на практике в качестве окислителей, являются кислород и озон, хлор, бром, перманганаты, дихроматы, кислородные кислоты хлора и их соли (например,  ,
, 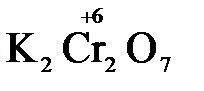 ,
, 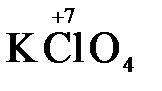 ), азотная кислота (
), азотная кислота ( ), концентрированная серная кислота (
), концентрированная серная кислота (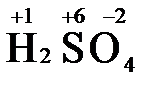 ), диоксид марганца (
), диоксид марганца (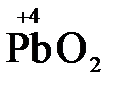 ), пероксид водорода и пероксиды металлов (
), пероксид водорода и пероксиды металлов (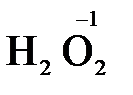 ,
,  ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe2+);
3) простые элементарные анионы, например, сульфид-ион S2-;
4) кислородосодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит 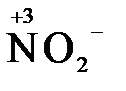 , сульфит
, сульфит  ).
).
Конкретными веществами, применяемыми на практике в качестве восстановителей, являются, например, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогенводороды (кроме HF), органические вещества – спирты, альдегиды, формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, моноксид углерода ( ) и алюминий при высоких температурах.
) и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO2- в кислой среде выступает в роли окислителя по отношению к иону I-:
2 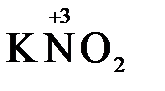 + 2
+ 2 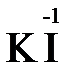 + 4 HCl→
+ 4 HCl→ 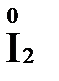 + 2
+ 2  + 4KCl + 2H2O
+ 4KCl + 2H2O
и в роли восстановителя по отношению к перманганат-иону MnO4-
5 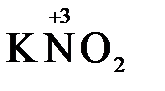 + 2
+ 2  + 3H2SO4 → 2
+ 3H2SO4 → 2 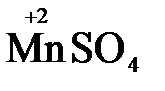 + 5
+ 5  + K2SO4 + 3H2O
+ K2SO4 + 3H2O
|
|
|
|
|
|


