 |
Вопрос 2. Свойства белков, изменение белков в процессах технологической обработки пищевых продуктов.
|
|
|
|
Лекция №3 «Белки».
Всего: 2 часа
Цель: Изучить общую характеристику белков, а также изменение их состава при тепловой обработке, физколлоидные основы кулинарных приемов.
План:1. Состав и строение белков.
Свойства белков, изменение белков в процессах технологической обработки
Пищевых продуктов.3. Ферменты.
Вопрос 1. Состав и строение белков.
В 1838 году голландский ученый Мульдер впервые применил термин “протеин” вкачестве наименования сложных органических веществ, встречающихся во всех живых организмах. Ранее считалось, что белок является неким однородным веществом, присутствующем в одном и том же виде в различных организмах. Теперь хорошо известно, что белок – это не одно вещество, а целый класс природных соединений, включающий очень большое число различных индивидуальных веществ, родственных по составу и строению. В живых организмах нет участков, которые не содержали бы белков. Разнообразие белков поистине огромно.
Белки - это сложные полимеры, молекулы которых построены из остатков
ά – аминокислот.
В состав белков входят различных 20 видов ά - аминокислот.
Аминокислоты в белках связаны последовательно пептидной связью
11 I
-C - N-,

которая образуется в результате взаимодействия -NH2 группы одной молекулы
с -СООН группой другой молекулы аминокислоты.
В основе образования пептидной связи лежит реакция конденсации
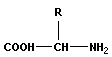 +
+ 
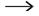
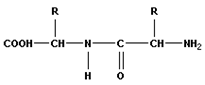
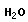
Полипептидные цепи белков строятся из десятков и сотен звеньев - остатков различных аминокислот. Образуя цепь, соединяются в различной последовательности, что приводит к огромному многообразию молекул белков.
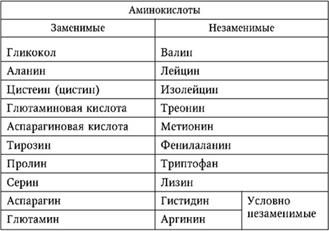
Подсчитано, что с цепью из 20 разных аминокислот (при условии, что каждая войдет в цепь только один раз), при их различной последовательности, возможно гигантское число различных вариантов белковых молекул 2,3·1018. В составе белков встречается до 25 аминокислот, но только десять из них не синтезируются живым организмом. Это так называемые незаменимые аминокислоты (табл. 1). Заменимые аминокислоты: Глицин, Аланин, Глутаминовая кислота, Аспарагиновая кислота, Серин, Цистин, Тирозин, Пролин, Оксипролин, Цистеин, Аргинин.
|
|
|
Таблица 1. аминокислоты
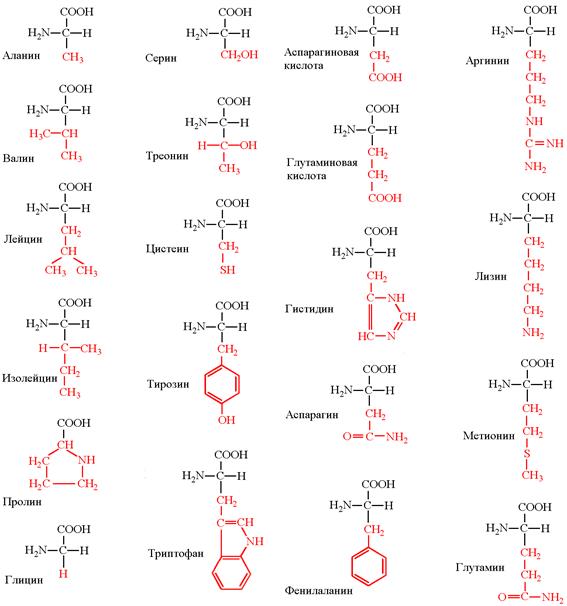
Все белки являются полипептидами, однако не каждый полипептид является белком. В настоящее время принято считать, что белками являются только такие полипептиды, для которых характерна определенная, свойственная данному белку последовательность чередования аминокислотных остатков (первичная структура белка) и специфическая пространственная конфигурация полипептидной цепочки (вторичная структура белка). Эти две важнейшие характеристики белковой молекулы обусловливают биологическую роль данного белка в живом организме. В определенных условиях (рН среды, концентрация ионов и т. д.) вторичная структура белка однозначно определяется его первичной структурой. На рис. 1 приведена структура нити мышечного белка. Одной из важнейших вторичных структур является α -спираль, впервые найденная Л. Полингом и Р. Б. Кори.
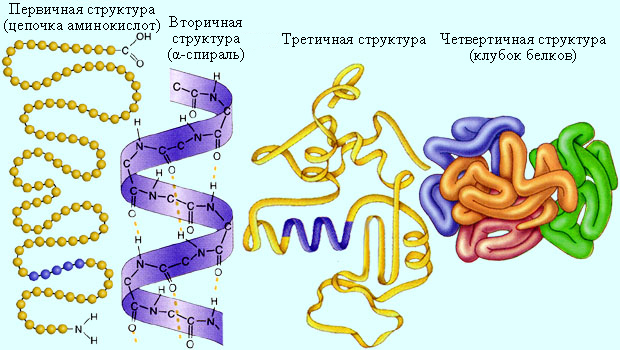
Рисунок 1. Структура нити мышечного белка.
Все белки подразделяются на глобулярные и фибриллярные.
Фибриллярные белки состоят из макромолекул, имеющих вид тонких вытянутых нитей. Полипептидные цепи такого белка, свернутые в винтовую спираль, ориентированы параллельно друг другу. В эту группу входят белки мышечных тканей и кожных покровов, белки волос, рогов, перьев, шерсти, шелка. При комнатной температуре эти белки нерастворимы в воде, но могут набухать в ней. При повышенной температуре некоторые из них (желатин) растворяются с образованием очень вязких растворов.
|
|
|
Глобулярные белки пептидных цепей белка состоят измакромолекул эллипсоидальной, реже шаровидной формы. Глобулярный белок диаметром 2,5 нм представляет собой полипептидную цепь длиной до 50 нм, свернутую в клубок. Эти белки хорошо растворимы в воде, причем вязкость ах растворов невелика. К ним относятся белки крови, молока.
Наличие в макромолекулах белков двух противоположных по свойствам групп: - NН2 и кислотной -COOH, сообщает белкам амфотерные свойства. В кислотной среде ионизация карбоксильных групп будет подавлена и макромолекула белка приобретет положительный заряд в результате ионизации группы -NH2. В щелочной среде белок ведет себя как кислота, а макромолекула белка будет приобретать отрицательный заряд.
Очевидно, должна существовать такая концентрация ионов водорода, при которой число ионизированных основных групп равно числу ионизированных кислотных групп, т.е. суммарный заряд макромолекулы равен нулю. Такое состояние белка называется изоэлектрическим состоянием, а значение рН, которое соответствует изоэлектрическому состоянию, называется изоэлектрической точкой белка.
От реакции среды и характера диссоциации белка зависит форма молекул в растворе. При диссоциации только по кислотному или только по основному типу в макромолекуле появляются одноименные заряды, распределенные по всей ее длине. Под действием сил электростатического отталкивания макромолекула растягивается. В изоэлектрическом состоянии в макромолекуле чередуются разноименные заряженные группы, которые притягиваются друг к другу и тем самым сжимают или даже скручивают молекулу.
Реакция среды, от которой зависит форма макромолекулы белка, определяет свойства белковых растворов. В изоэлектрическом состоянии молекулы белка свернуты в плотный клубок и занимают небольшой объем. С изменением рН молекула изменяет объем. Чем больший объем занимает макромолекула, тем больше вязкость раствора. По изменению вязкости в зависимости от рН можно найти изоэлектрическую точку, ей соответствует наименьшее значение вязкости. Аналогично зависимость степени набухания от рН среды. Степень набухания минимальна в изоэлектрической точке.
|
|
|
Вопрос 2. Свойства белков, изменение белков в процессах технологической обработки пищевых продуктов.
Денатурация белка
Большое значение имеет тепловая денатурация белков. Типичным примером может служить денатурация куриного белка (альбумина) при варке: из прозрачного растворимого в воде вещества он превращается в более или менее твердую, непрозрачную, нерастворимую в воде массу. Исследования показали, что денатурация или свертывание белка при нагревании большей частью складывается из двух различных процессов:
· понижения растворимости белка (собственно денатурация);
· коагуляции золей денатурированного белка.
Обе стадии невозможно отделить одну от другой. Сущность тепловой денатурации можно рассмотреть на примере глобулярных белков. Основная молекула глобулярного белка, как известно, состоит из одной или нескольких полипептидных цепей, сложенных складками и образующих клубки. Такая структура стабилизируется непрочными связями, среди которых большую роль играют водородные связи, образующие поперечные мостики между параллельными пептидными цепями или их складками. При нагревании белков происходит усиленное движение полипептидных цепей или их. складок, что вызывает разрыв непрочных связей между ними. В результате этого наблюдается развертывание и перегруппировка складок, сопровождаемые перераспределением полярных и неполярных радикалов, причем неполярные радикалы концентрируются на поверхности глобул, понижая их гидрофильность, а следовательно, и растворимость.
Для денатурации белка необходимо присутствие некоторого минимального содержания воды. Безводный белок при нагревании не подвергается денатурации. Так, сухой альбумин выдерживает нагревание в струе сухого воздуха при температуре 393О С без заметного изменения его растворимости. При денатурации белки становятся нерастворимыми и утрачивают способность к набуханию.
|
|
|
Денатурация, кроме нагревания, при кулинарной обработке пищевых продуктов может быть вызвана и другими причинами. Например, взбивание яичного белка, сливок превращает их в пену, состоящую из пузырьков воздуха, окруженных тонкими белковыми пленками, образование которых также сопровождается развертыванием пептидных цепей за счет разрыва связей при механическом воздействии. Таким образом, при образовании пленок происходит частичная или полная денатурация белка. В отличие от тепловой она называется поверхностнойденатурацией.
Вопрос 3. Ферменты.
Белковую природу имеют многочисленные ферменты, которые катализируют реакции определенного типа. Ферментам свойственна высокая избирательность, наибольшая активность при нормальной температуре организма, зависимость ферментной активности от pH. Ферменты разделяются на шесть классов:
- Оксидоредуктазы – катализируют окислительно-восстановительные процессы.
- Трансферазы – катализируют перенос химических групп (радикалов).
- Гидролазы – катализируют гидролитические процессы.
- Лиазы – обеспечивают присоединение по двойным связям или их образование.
- Изомериазы – участвуют в процессах изомеризации.
- Синтетазы – обеспечивают реакции конденсации двух молекул с участием фосфатных групп.
Для обеспечения каталитической функции многие ферменты содержат в молекуле небелковую часть – кофактор. Кофакторами могут быть органические вещества или ионы биометаллов, а также NH4+.
В живых организмах нет участков, которые не содержали бы белков. Разнообразие белков поистине огромно.
|
|
|


