 |
Приведите примеры редокс-процессов
|
|
|
|
В чем заключается механизм возникновения
Окислительно-восстановительного потенциала?
потенциал возникает на границе раздела металла
с раствором в результате окислительного и
восстановительного процессов, протекающих
с участием металла (электрода) и образованием
двойного электрического слоя называют
электродным потенциалом.
Зависит от:
1.Природы окисленной и восстановленной
формой сопряж.пары.
2.соотношения концентраций
3.Температуры.
Окислительно-восстановительный потенциал
является мерой химической активности элементов
или их соединений в обратимых химических процессах,
связанных с изменением заряда ионов в растворах.
Стандартный восстановительный потенциал-концентрация
реагентов 1моль/л, температура 298К.
уравнению Нернста-Петерса
: 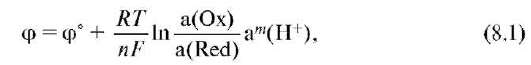
2. Объясните связь величин ЭДС и ΔG.
Изменение стандартной энергии гиббса связано с ЭДС
окислительно-восстановительной реакции соотношением. G=-zFE
Для самопроизвольного протекания
окислительно-восстановительной реакции
необходимо, чтобы разность потенциалов
сопряженных пар была величиной положительной,
что следует из уравнения, т.е. пара, потенциал
которой выше, может выполнять роль окислителя.
Реакция идет до тех пор, пока потенциалы обеих
пар не станут равными. ΔEo= φ°окисл. - φ°восстан
Если ЭДС реакции является отрицательной величиной,
то реакция идет в обратном направлении.
Чем больше ΔЕ°, тем реакция протекает
более интенсивно
SnCl2 + FeCl3  SnCl4 + FeCl2,
SnCl4 + FeCl2,
если φ0(Sn4+/Sn2+) = +0,15 B;
φ0(Fe3+/Fe2+) = +0,77
самопроизвольный процесс 0.77-0.54=0.13
Е положительная
(насчет реакции не знаю,не уверенна…)
Оксидиметрическое титрование,
|
|
|
Оксидиметрия точнее редоксиметрия, группа методов
количественного химического, основанных
окислительно-восстановительных реакций.Современная О.
разделяется на ряд методов: перманганатометрия,
хроматометрия, броматометрия, титанометрия, цериметрия и др.
Применение потенциометрии для установления точки
эквивалентности значительно расширяет область
оксидиметрических определений. Число методов О.
продолжает увеличиваться за счет применения новых
реагентов: калия гексацианоферриата, аскорбиновои
кислоты, ацетада свинца (IV), гипогалогенидов и др. О
.широко применяется для анализа неорганических и
органических веществ и является наиболее распространенным
видом титриметрических определений.
Особенности окислительно-восстановительных реакций
В организме. Антиоксиданты.
Все биохимические окислительно-восстановительные
процессы, скорость и глубина которых контролируется
организмом, совершается в присутствии ферментов с
общеим названием оксидоредуктазы.
Ряд ферментов и белков, присутствующих в живых
клетках, по которым передаются электроны.
Способы: 1. Прямой перенос электронов
2.Перенос в составе атома H
3.Перенос элктрона от донора к акцептору
в форме гидрид-аниона
4.Перенос путям прямого взаимодействия
органического восстановителя с кислородом,
Антиоксиданты (антиокислители, консерванты) — ингибиторы
окисления, природные или синтетические вещества,
способные замедлять окисление.
Антиоксиданты (антиокислители, консерванты) — ингибиторы
окисления, природные или синтетические вещества,
способные замедлять окисление.
Обезвреживание кислорода, пероксида водорода
И супероксид-иона в организме.
1. антиоксидантные и антиперекисные ферменты:
супероксиддисмутаза, каталаза, глутатионпероксидаза.
Способствуют распаду пероксида на воду и кислород.
|
|
|
2.антиоксиданты- различные тиолы, аскорбиновая к-та,
каротин, витамин Е, К, Р и стероидные гормоны.
Приведите примеры редокс-процессов
Редокс процессы в условиях организма протекают
в водной среде. Жидкая вода устойчива в диапазоне
потенциалов от - 0,42 до + 0, 82 В. При более низких
значениях потенциала происходит восстановление воды
до молекулярного водорода, а при более высоких – окисление
воды до молекулярного кислорода. Следовательно,
значения формальных редокс-потенциалов редокс - систем,
функционирующих в организме, не могут быть
ниже -0, 42В(сильные восстановители) и
выше 0, 82(сильные окислители). Все редокс-процессы
протекают в организме ферментативно-под действием
ферментов оксидоредуктаз.
Примером системы второго типа является процесс
утилизации перекиси водорода в организме
: Н2О2 + 2Н+ + 2ē ↔ 2Н2О, а также восстановление
в кислой среде многих окислителей,
содержащих кислород: CrО42-, Cr2О72-, MnО4-.
|
|
|


