 |
Нефтяной газ и его свойства
|
|
|
|
Газы нефтяных и газовых месторождений по химической природе сходны с нефтью. Газы нефтяных месторождений, добываемые вместе с нефтью, называют нефтяными газами, а газы газовых месторождений называются природными газами. Природные и нефтяные газы состоят из предельных углеводородов: метана СН4, пропана CsHg, бутана С^ю, пентана С^Нп и так далее. Часто углеводородные газы в своем составе содержат сероводород H2S, азот N, двуокись углерода СО2, гелий Не, аргон Аг, пары ртути Hg. Содержание сероводорода, азота, углекислого газа достигает нескольких десятков процентов, а остальных примесей -долей процента.
В нормальных условиях при атмосферном давлении и температуре 0° С углеводороды от метана (СН4) до бутана (С4Ню) всегда находятся в газообразном состоянии.
Молекулярная масса М углеводородных газов определяется по формуле:
 (16)
(16)
где Mt - молекулярная масса /-го компонента; у, - доля компонента в смеси по объему.
Учитывая, что природный газ в основном состоит из метана, молекулярная масса нефтяного газа больше.
Если при постоянной температуре повышать давление газа, то при достижении определенного давления этот газ перейдет в жидкую фазу. Для каждого газа существует своя предельная температура, выше которой этот газ нельзя перевести в жидкое состояние. Максимальная температура, при которой данный газ может перейти в жидкое состояние при повышении давления, называется критической температурой. Для метана критическая температура -82,1° С, для этана - +32,3° С, для азота - +141,7° С. Давление, соответствующее критической температуре, называется критическим давлением. Температура, при которой вещество с повышением давления до определенной величины из газообразной фазы переходит в жидкую, называется точкой росы или точкой начала конденсации. Эта же температура при снижении давления является точкой испарения, так как при этом вещество из жидкой фазы начинает переходить в газообразную.
|
|
|
Пропан и бутан легко переходят в жидкость даже при небольших давлениях. Давление, необходимое для перевода того или иного углеводорода из газообразного состояния в жидкое, то есть упругость его паров, повышается с ростом температуры. При данной температуре оно тем больше, чем ниже плотность углеводорода. Наибольшей упругостью паров обладает метан, который при нормальных условиях невозможно перевести в жидкость, так как его критическая температура равна -82,1°С. Так же трудно переводится в жидкое состояние этан. В зависимости от преимущественного содержания в нефтяных газах
легких или тяжелых углеводородов газы разделяются на сухие и жирные.
Сухой газ - это естественный газ, в котором не содержатся тяжелые углеводороды или содержатся в небольших количествах.
Жирный газ - это газ, в котором тяжелые углеводороды содержатся в таких количествах, когда можно получать сжиженные газы или газовые бензины. Сухим принято считать газ, в 1 м3 которого содержится меньше 60 г газового бензина, а жирным - если в 1 м3 содержится более 60 г газового бензина.
Жирные газы чаще содержатся в легких нефтях, а сухой газ - в тяжелых нефтях. Одним из основных физических параметров нефтяного газа является его плотность.
Плотностью называется отношение массы вещества к занимаемому объему:
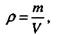 (17)
(17)
где т - масса вещества, кг; У- объем, м3; р - плотность, кг/м3.
Плотность газа можно определить взвешиванием или вычислить, когда знаем молекулярную массу смеси:
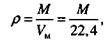 (18)
(18)
где Ум - объем моля газа при стандартных условиях, м3; 22,4 - газовая постоянная.
Плотность газар находится в пределах 0,73-1 кг/м3.
На практике пользуются относительной плотностью газа, которая показывает, во сколько раз масса данного газа, заключенного в определенном объеме при данных давлениях и температуре, больше или меньше массы сухого воздуха, заключенного в том же объеме и при тех же условиях:
|
|
|
 (19)
(19)
где рг - плотность углеводородного газа, ръ - плотность сухого воздуха, jur - молекулярная масса газа, ц% - молекулярная масса воздуха.
Относительные плотности некоторых углеводородов и их примесей (в нормальных условиях) составляют: воздух - 1; N2 -0,9673; СО2 - 1,5291; H2S - 1,1906; СН4 - 0,553; С2Н6 -1,038; С3Н8 - 1,523; С4Н10 - 2,007.
В пласте углеводородные газы находятся в различных условиях. С увеличением давления от 0 до 3-4- МПа объем газов уменьшается.
С увеличением температуры при постоянном объеме газов сжимаемость газов уменьшается.
Приведенным давлением Рпр называется отношение давления газа к его критическому давлению Р^:
 (20)
(20)
Давление, соответствующее точке критической температуры, называется критическим давлением.
Приведенной температурой газа Тпр называется отношение
абсолютной температуры газа Т к его критической температуре:
 (21)
(21)
Критическая температура Ткр - это температура, при которой исчезает граница между жидкостью и паром. Для углеводородных газов, представляющих собой смесь отдельных компонентов, величины Ркр и Ткр определяются как среднеарифметические.
Если известен объем газа У0 при нормальных условиях (Р0
и Г0), то объем его при других давлениях и температурах (Р и Т) с учетом сжимаемости можно определить на основе закона Гей-Люссака:
 (22)
(22)
где Т0 = 273 К.
Для перехода от объема, занимаемого газом в нормальных условиях, к объему газа в пластовых условиях пользуются объемным коэффициентом, который занял бы 1 м3 газа в пластовых условиях. Объемный коэффициент газа из формулы (22)
 (23)
(23)
Вязкость газа
Вязкость газа - это свойство газа сопротивляться перемещению одних частиц относительно других.
Силы трения, возникающие между двумя смежными слоями газа при его движении, пропорциональны изменению скоростей на единицу длины. Коэффициент пропорциональности называется коэффициентом динамической вязкости.
В системе СИ единица динамической вязкости обозначается Па • с. Кинематическая вязкость - это отношение динамической вязкости газа к ее плотности р при той же температуре:
|
|
|
 (24)
(24)
В системе СИ единица кинематической вязкости имеет размерность м2/с. При давлениях до 4 МПа динамическая вязкость газов мало зависит от давления. Но при более высоких давлениях вязкость газа повышается, так как число молекул в единице объема увеличивается, что приводит к увеличению числа взаимных столкновений.
При низких давлениях с повышением температуры вязкость газа возрастает в связи с тем, что скорости движения молекул при этом увеличиваются. При значительном повышении давления вследствие уплотнения газа вязкость его с повышением температуры уменьшается. При высокой температуре зависимость вязкости от давления значительно меньше, а при повышении давления вязкость снижается с увеличением температуры.
|
|
|


