 |
Активный транспорт веществ.
|
|
|
|
Задачи обучения.
· основные термины и определения, используемые в биофизике мембран.
· история развития моделей мембран.
· современные представления о структуре и функциях мембран
· основные методы применяемых при изучении структуры мембран (рентгеноструктурный анализ, электронное микроскопирование, применение флуоресцентных зондов, ЯМР, ЭПР).
· связь между предлагаемыми моделями мембран и экспериментальными данными.
· основные события, протекающих в биомембранах, включая трансмембранный транспорт.
· Основные физико-химические и структурные характеристики мембраны
· Биофизические закономерности переноса веществ через мембранные структуры
· Механизмы формирования диффузионных потоков
Основные вопросы темы:
1. История развития моделей строения мембраны. Экспериментальные доказательства наличия липидного бислоя.
2. История развития моделей строения мембраны. Модель мембраны Даниелли и Давсона.
3. Современные представления о строении мембраны. Жидкокристалическая модель Сингера-Никольсона.
4. Функции мембраны.
5. Компоненты мембраны. Липидный и белковый состав мембраны.
6. Липид-липидные, липид-белковые взаимодействия в мембране. Подвижность компонентов мембраны (вращательная диффузия, латеральная диффузия, флип-флоп переход).
7. Фазовые переходы в липидном бислое. Изменение конформации липидных молекул. Формирование кинков.
8. Липосомы. Виды липосом. Получение. Использование.
9. Плоские бислойные липидные мембраны (БЛМ). Получение. Использование.
10. Использование флуоресцентных меток. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
11. Рентгеноструктурный анализ строения мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
|
|
|
12. Электронная микроскопия. Метод "замораживание-скол-травление". Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
13. Спектроскопия электронного парамагнитного резонанса (ЭПР), спектроскопия ядерного магнитного резонанса (ЯМР). Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
14. Искусственные мембраны (липосомы, протеолипосомы, плоские бислойные липидные мембраны), моделирование мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
15. Трансмембранный транспорт. Виды транспорта веществ через биологические мембраны.
16. Пассивный транспорт. Определение. Закон Фика.
17. Пассивный транспорт. Простая диффузия. Определение. Классификация.
18. Пассивный транспорт. Облегченная диффузия. Определение. Классификация.
19. Облегченная диффузия. Механизм работы молекул-переносчиков.
20. Активный транспорт. Электрогенные ионные насосы.
21. Вторичный активный транспорт. Основные виды.
Методы обучения и преподавания: работа в малых группах.
Литература:
1. Биологические мембраны http://www.chem.msu.su/rus/books/ovchinnikov/p547-636.pdf
2. Биофизика мембран http://www.pereplet.ru/obrazovanie/stsoros/109.html
3. Активный транспорт http://alexandr4784.narod.ru/antbio/antbio_07.pdf
4. Активный транспорт опыт Уссинга http://studopedia.ru/2_96194_aktivniy-transport-opit-ussinga.html
5. Физические основы функционирования биологических мембран. http://intranet.tdmu.edu.ua/data/kafedra/internal/distance/lectures_stud/%D0%A0%D1%83%D1%81%D1%81%D0%BA%D0%B8%D0%B9/1%20%D0%BA%D1%83%D1%80%D1%81/%D0%91%D0%B8%D0%BE%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0%20%D0%B8%20%D0%BC%D0%B5%D0%B4%D0%B8%D1%86%D0%B8%D0%BD%D1%81%D0%BA%D0%B0%D1%8F%20%D0%B0%D0%BF%D0%BF%D0%B0%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0/04_%D0%A4%D0%B8%D0%B7%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5%20%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D1%8B%20%D1%84%D1%83%D0%BD%D0%BA%D1%86%D0%B8%D0%BE%D0%BD%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F%20%D0%B1%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85%20%D0%BC%D0%B5%D0%BC%D0%B1%D1%80%D0%B0%D0%BD..htm
|
|
|
6. Методы исследования биологических мембран http://pskgu.ru/ebooks/revinbio/revinbio_2_21.pdf
7. Методы исследования биомембран http://arsob.getbb.ru/viewtopic.php?f=80&t=679
8. Краткий обзор групп методов исследования мембран http://chem21.info/article/741649/
Контроль: (контрольные вопросы по теме занятия)
1. Компоненты мембраны и её строение в соответствии с жидкокристалической моделью Сингера-Никольсона.
2. Функции мембраны.
3. Липид-липидные, липид-белковые взаимодействия в мембране. Подвижность компонентов мембраны (вращательная диффузия, латеральная диффузия, флип-флоп переход).
4. Фазовые переходы в липидном бислое. Изменение конформации липидных молекул. Формирование кинков.
5. Липосомы. Виды липосом. Получение. Использование.
6. Плоские БЛМ. Получение. Использование.
7. Основные составные части молекулы липидов входящих в состав мембран.
8. Биологические мембраны. Виды биологических мембран и их функции.
9. Основные классы мембранных липидов. Физические свойства мембранных липидов.
10. Какие методы дают возможность изучать динамику мембран без их разрушения. Кратко охарактеризуйте данные методы.
11. Использование флуоресцентных меток. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
12. Дифракция рентгеновских лучей. Рентгеноструктурный анализ строения мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
13. Электронная микроскопия. Метод "замораживание-скол-травление". Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
14. ЭПР, ЯМР спектроскопия. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
15. Искусственные мембраны (липосомы, протеолипосомы, плоские БЛМ), моделирование мембран. Цель, принцип, ограничения метода. Значимость результатов в развитии представлений о мембранах.
16. Трансмембранный транспорт. Виды транспорта веществ через биологические мембраны.
17. Пассивный транспорт. Определение. Закон Фика.
18. Пассивный транспорт. Простая диффузия. Определение. Классификация.
19. Пассивный транспорт. Облегченная диффузия. Определение. Классификация.
|
|
|
20. Облегченная диффузия. Механизм работы молекул-переносчиков.
21. Активный транспорт. Электрогенные ионные насосы.
22. Вторичный активный транспорт. Основные виды.
Тестовые вопросы
1. Какая модель на современном этапе наиболее полно представляет строение мембраны?
A. модель Лили
B. модель Робертсона
C. модель Данели-Давсона
D. модель Сингер-Николсона
E. модель Резерфорда
2. Как называется перенос вещества через мембрану против градиента концентрации с помощью белков переносчиков?
A. простая диффузия
B. облегченная диффузия
C. осмос
D. фильтрация
E. активный транспорт
3. Укажите функцию мембраны, за счет которой обеспечивается селективный, регулируемый, пассивный и активный обмен веществом с окружающей средой
A. Матричная
B. Энергетическая
C. Барьерная
D. Механическая
E. Рецепторную
4. Укажите функцию мембраны, которая обеспечивает прочность и автономность клетки, внутриклеточных структур
A. Матричная
B. Генерации и проведения биопотенциалов
C. Барьерная
D. Механическая
E. Рецепторную
5. Укажите функцию мембраны, которая обеспечивает возбудимость клетки
A. Матричная
B. Генерации и проведения биопотенциалов
C. Барьерная
D. Механическая
E. Рецепторную
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ. СТРУКТУРА, СВОЙСТВА
Биофизика мембран - важнейший раздел биофизики клетки, имеющий большое значение для биологии. Многие жизненные процессы протекают на биологических мембранах. Нарушение мембранных процессов - причина многих патологий. Лечение также во многих случаях связано с воздействием на функционирование биологических мембран.
Основные функции биологических мембран
Элементарная живая система, способная к самостоятельному существованию, развитию и воспроизведению - это живая клетка - основа строения всех животных и растений. Важнейшими условиями существования клетки (и клеточных органелл) являются, с одной стороны, автономность по отношению к окружающей среде (вещество клетки не должно смешиваться с веществом окружения, должна соблюдаться автономность химических реакций в клетке и ее отдельных частях); с другой стороны, связь с окружающей средой (непрерывный, регулируемый обмен веществом и энергией между клеткой и окружающей средой). Живая клетка - открытая система.
|
|
|
Единство автономности от окружающей среды и одновременно тесной связи с окружающей средой - необходимое условие функционирования живых организмов на всех уровнях их организации. Поэтому важнейшее условие существования клетки, и, следовательно, жизни - нормальное функционирование биологических мембран.
Три основные функции биологических мембран:
· барьерная - обеспечивает селективный, регулируемый, пассивный и активный обмен веществом с окружающей средой (селективный - значит, избирательный: одни вещества переносятся через биологическую мембрану, другие - нет; регулируемый - проницаемость мембраны для определенных веществ меняется в зависимости от генома и функционального состояния клетки); Т.е. создание биомембраной препятствий для свободного переноса веществ через нее. Для одних агентов БМ является непреодолимым препятствием, другие легко проходят сквозь нее, причем, как правило, только в определенном направлении, как того требуют векторные свойства мембраны. Скорости мембранного транспорта разных веществ далеко не одинаковы. Следовательно, с барьерной функцией БМ непосредственно связана ее избирательная (селективная) проницаемость. Мембраны не только отделяют клетки друг от друга, но также разделяют цитоплазму на ряд замкнутых отсеков (компартментов), каждый из которых выполняет свою специфическую задачу. В такой трактовке клеточные органоиды рассматриваются в качестве компартментов. Принцип компартментализации (разбиения цитоплазмы на компартменты) признан сейчас одним из важнейших в организации биологических систем. Благодаря компартментализации в клетке пространственно разобщены и изолированы друг от друга биохимические процессы, совместное течение которых невозможно. Например, синтез жирных кислот происходит в цитоплазме, а окисление - в митохондриях; синтез белка - на рибосомах, а деградация - в лизосомах. Между содержимым органоидов и цитозоля имеются существенные различия в химическом составе, чем обусловлены высокие концентрационные градиенты на внутриклеточных мембранах. На плазмолемме также поддерживаются значительные физико-химические градиенты. Они служат главной движущей силой трансмембранного переноса веществ.
· матричная – обеспечивает определенное взаимное расположение и ориентацию мембранных белков, обеспечивает их оптимальное взаимодействие (например, оптимальное взаимодействие мембранных ферментов); Преимущества компартментализации связаны не только с барьерной, но и с матричной функцией клеточных мембран. БМ служит матрицей для белков-рецепторов, ферментов и других физиологически активных веществ, обеспечивая пространственную организацию рецепторных взаимодействий, метаболических реакций, переноса энергии и других мембранных процессов. Так, биомембраны объединяют встроенные в них ферменты в единый конвейер, где каждый из них действует строго согласованно с остальными. Среди мембранных ферментов выделяют так называемые векторные, которые пронизывают БМ и принимают субстраты на ее одной стороне, чтобы выделить продукты реакции на противоположной. Реакции, катализируемые такими ферментами, имеют векторный характер. Мембранным ферментам присуще явление аллопии, заключающееся в том, что при отделении от БМ они полностью или частично утрачивают свою активность.
|
|
|
· механическая - обеспечивает прочность и автономность клетки, внутриклеточных структур. Т.е. заключается в поддержании морфологической целостности и относительной автономности как клетки в целом, так и внутриклеточных органоидов. Она основана прежде всего на механических свойствах мембранных структур.
Кроме того, биологические мембраны выполняют и другие функции:
· энергетическую - синтез АТФ на внутренних мембранах митохондрий и фотосинтез в мембранах хлоропластов;
· генерацию и проведение биопотенциалов;
· рецепторную (механическая, акустическая, обонятельная, зрительная, химическая, терморецепция - мембранные процессы) и многие другие функции.
Общая площадь всех биологических мембран в организме человека достигает десятков тысяч квадратных метров. Относительно большая совокупная площадь связана с огромной ролью мембран в жизненных процессах.
Структура биологических мембран

|
| Рисунок 1. Схематическое представление монослоя, образующегося в ванне Лэнгмюра. Полярные головки погружены в воду, а неполярные цепи обращены в воздух |
Первая модель строения биологических мембран была предложена в 1902 г. Было замечено, что через мембраны лучше всего проникают вещества, хорошо растворимые в липидах, и на основании этого было сделано предположение, что биологические мембраны состоят из тонкого слоя фосфолипидов. На самом деле, на поверхности раздела полярной и неполярной среды (например, воды и воздуха) молекулы фосфолипидов образуют мономолекулярный (одномолекулярный) слой (рис.1). Их полярные "головы" погружены в полярную среду, а неполярные "хвосты" ориентированы в сторону неполярной среды (рис.2). Поэтому и можно было предположить, что биологические мембраны построены из монослоя липидов.
|
| Рис. 2. Схема фосфолипида: 1 - полярная (гидрофильная) часть; 2 - неполярная (гидрофобная) часть |
В 1925 г. Гортер и Грендел показали, что площадь монослоя липидов, экстрагированных из мембран эритроцитов, в два раза больше суммарной площади эритроцитов. Гортер и Грендел экстрагировали липиды из гемолизированных эритроцитов ацетоном, затем выпаривали раствор на поверхности воды и измеряли площадь образовавшейся мономолекулярной пленки липидов. На основании результатов этих исследований была высказана идея, что липиды в мембране располагаются в виде бимолекулярного слоя (рис.3).
Эту гипотезу подтвердили исследования электрических параметров биологических мембран (Коул и Кертис, 1935 г.): высокое электрическое сопротивление ≈ 107 Ом*м2 и большая емкость ~ 0,5*10-2 Ф/м2.
|
| Рис. 3. Бимолекулярный фосфолипидный слой |
Биологическую мембрану можно рассматривать как электрический конденсатор, в котором пластинами являются электролиты наружного и внутреннего растворов (внеклеточного и цитоплазмы) с погруженными в них головами липидных молекул. Проводники разделены диэлектрическим слоем, образованным неполярной частью липидных молекул - двойным слоем их хвостов. Для плоского конденсатора можно найти расстояние между пластинами, соответствующее толщине липидной части мембраны и ≈3,5 нм. Это как раз соответствует по порядку величины толщине неполярной части бимолекулярного слоя липидов, сложенных определенным образом.
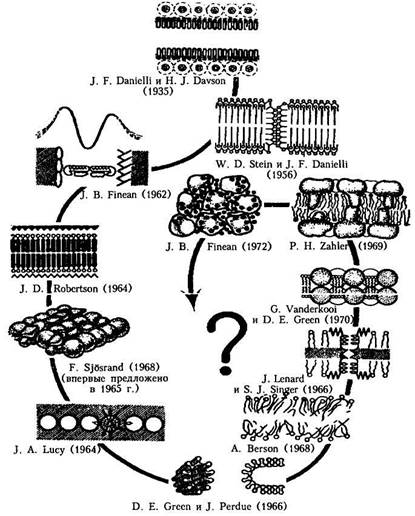
Однако мембрана - это не только липидный бислой. Имелись экспериментальные данные, которые свидетельствовали о том, что биологическая мембрана состоит и из белковых молекул. Например, при измерении поверхностного натяжения клеточных мембран было обнаружено, что измеренные значения коэффициента поверхностного натяжения значительно ближе к коэффициенту поверхностного натяжения на границе раздела белок-вода (около 10-4 Н/м), нежели на границе раздела липид-вода (около 10-2 Н/м). Эти противоречия экспериментальным результатам были устранены Даниели и Девсоном, предложившими в 1935 г. так называемую бутербродную модель строения биологических мембран, которая с некоторыми несущественными изменениями продержалась в мембранологии в течение почти 40 лет. Согласно этой модели мембрана - трехслойная. Она образована двумя расположенными по краям слоями белковых молекул с липидным бислоем посередине; образуется нечто вроде бутерброда: липиды, наподобие масла, между двумя "ломтями" белка (рис.4).
Однако по мере накопления экспериментальных данных пришлось в конце концов отказаться и от бутербродной модели строения биологических мембран.
Огромную роль в развитии представлений о строении биологических мембран сыграло все большее проникновение в биологию физических методов исследования.
Большую информацию о структуре мембран, о взаимном расположении атомов мембранных молекул дает рентгеноструктурный анализ, основанный на дифракции коротковолновых рентгеновских лучей на атомарных структурах. Рентгеноструктурный анализ позволяет обнаруживать упорядоченность в расположении атомов и определять параметры упорядоченных структур (например, расстояния между кристаллографическими плоскостями). Исследования дифракции рентгеновских лучей на мембране подтвердили относительно упорядоченное расположение липидных молекул в мембране - двойной молекулярный слой с более или менее параллельно расположенными жирнокислотными хвостами, дали возможность точно определить расстояние между полярной головой липидной молекулы и метильной группой в конце углеводородной цепи.
Метод дифракции рентгеновского излучения
|
| Дифракция рентгеновских лучей |
Одним из наиболее точных методов исследования структуры молекул, составляющих мембрану клетки, является метод рентгеноструктурного анализа, основанный на дифракции рентгеновских лучей. Как правило, это явление наблюдается в тех случаях, когда на пути лучей встречаются препятствия, сравнимые по размеру с длиной волны луча (для анализа объектов нанометрового диапазона необходимо рентгеновское излучение диапазон длин его волн от 10-5 до 80 нм). Если на исследуемый объект направляют параллельный пучок рентгеновских лучей, а за объектом помещают фотопленку, то на ней фиксируется дифракционная картина. На рентгенограмме наблюдается множество пятен (дифракционных максимумов), образующихся в результате интерференции лучей. Анализ рентгенограммы дает сведения о структуре объекта на молекулярном (и даже атомном) уровне.

|
| Схема отражения рентгеновских лучей, объясняющая принцип рентгеноструктрного анализа. |
Ценность метода заключается в том, что появляется возможность, во-первых, изучить пространственное расположение молекул, точно измерить расстояние между ними, оценить их внутримолекулярную структуру, во-вторых, определить структуру молекулярных компонентов мембраны в нефиксированных клеточных препаратах.
Дифракционная решетка -оптическое устройство, представляющее собой совокупность большого числа параллельных, обычно равноотстоящих друг от друга щелей. Дифракционную решетку получают нанесением непрозрачных царапин (штрихов) на стеклянную пластину. Непроцарапанные места - щели - будут пропускать свет; штрихи, соответствующие промежутку между щелями, рассеивают и не пропускают света. В случае рентгеноструктурного анализа роль штриха выполняют атомы, щелей - промежутки между атомами.
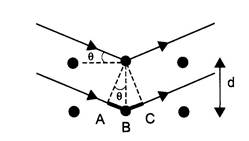
Чтобы понять принцип использования рентгеновского излучения для анализа структуры вещества, рассмотрим кристаллическую структуру, на два соседних атома которой падают параллельные лучи, которые отражаются от соседних атомов кристаллической решетки, а затем интерферируют, собираясь в одну точку на некотором экране. Вводя значение межатомного расстояния d, угла скольжения θ, получим, что разность хода лучей
A=AB+BC=2d sinθ
Условием того, что в некоторой точке экрана две волны будут усиливать друг друга, является равенство этой разности хода целому числу длин волн

|
| Рисунок. Рентгенограмма (дебаеграмма) кристалла |

Наблюдая картину дифракции на экране, можно установить, под каким углом θ наблюдается, например, максимум первого порядка (n=1) Зная длину волны, можно найти важнейший параметр структуры исследуемого вещества - межатомное расстояние d

С помощью рентгеноструктурного анализа были подтверждены бислойное расположение фосфолипидов и присутствие в мембранах белков, вычислены важные структурные параметры мембраны.
П. Дебаем и П. Шеррером был предложен метод рентгеноструктурного анализа, основанный на дифракции монохроматических рентгеновских лучей в поликристаллических телах (обычно спрессованные порошки).
Среди множества кристаллитов всегда найдутся такие, для которых одинаковы λ, q и k, причем эти величины соответствуют формуле Вульфа - Брэггов. Отраженный луч 2 (максимум) составит угол 2 q с падающим рентгеновским лучом 1.
|
| Рис. 4. Развитие представлений о молекулярной организации биологических |
Так как условия одинаково для многих кристаллов, по-разному ориентированных, то дифрагированные рентгеновские лучи образуют в пространстве конус, вершина которого лежит в исследуемом объекте, а угол раствора равен 4 q. Другой совокупности величин l, q и k, удовлетворяющих условиям, будет соответствовать другой конус. На фотопленке рентгеновские лучи образуют рентгенограмму (дебаеграмму) в виде окружностей или дуг.
Дифракцию рентгеновских лучей наблюдают также при рассеянии их аморфными твердыми телами, жидкостями и газами. В этом случае на рентгенограмме получаются широкие и размытые кольца. В настоящее время широко применяют рентгеноструктурный анализ биологических молекул и систем: на рис. показаны рентгенограммы белков.
Наибольшие успехи в раскрытии особенностей строения биологических мембран были достигнуты в электронно-микроскопических исследованиях. Как известно, световой микроскоп не позволяет рассмотреть детали объекта, меньшие примерно половины длины световой волны (около 200 нм). В световом микроскопе можно разглядеть отдельные клетки, однако он совершенно непригоден для изучения биологических мембран, толщина которых в 20 раз меньше предела разрешения светового микроскопа. Разрешающая способность микроскопа ограничена явлением дифракции. Поэтому, чем меньше длина волны по сравнению н с деталями исследуемого объекта, тем меньше искажения. Предел разрешения пропорционален длине волны.
В электронном микроскопе вместо светового пучка на исследуемый объект направляется пучок электронов, разогнанных до больших скоростей.
| 
|
| Рис. 5. Трехслойное изображение биомембраны на электронограмме | Рис. 6. Электронограмма поверхностей скола биомембраны (метод «замораживания-скалывания») Выступам (1-5) на левой поверхности соответствуют вмятины (1-5) на правой, и наоборот |

|
| Рисунок 7. Исследование мембран методом замораживания-скалывания. А. Плоскость скола замороженной клетки частично проходит через центральную часть различных мембран. Б. Разъединение двух половинок скола. В. Образец подвергают травлению для выявления деталей поверхности слоя. Г. На образец напыляют слой платины, а затем слой углерода; таким образом, получается реплика с поверхности образца. Д. Эту реплику отделяют от препарата и исследуют под электронным микроскопом. |
ИИзвестно, что электронам с высокими скоростями тоже присущи волновые свойства, в том числе явление дифракции. Однако при достаточно больших скоростях, согласно формуле де Бройля, длина волны мала и соответственно мал предел разрешения. Так, если электроны ускоряются электрическим полем с напряжением 105 В, их скорость достигает 106 м/с, длина волны уменьшается и предел разрешения составляет порядка 0,1 нм, что позволяет рассмотреть отдельные детали строения биологических мембран.
В электронном микроскопе достигается увеличение в сотни тысяч раз, что дало возможность исследовать строение клетки, клеточных органелл и биологических мембран.
Недостатком электронной микроскопии является деформация живого объекта в процессе исследования. Перед началом электронномикроскопических исследований клетка проходит через многие стадии предварительной обработки: обезвоживание, закрепление, ультратонкий срез, обработка препаратов веществами, хорошо рассеивающими электроны (например, золотом, серебром, осмием, марганцем и т.п.). При этом изучаемый объект значительно изменяется. Несмотря на это, успехи в изучении клетки при помощи электронного микроскопа несомненны.
При помощи электронной микроскопии удалось получить изображение биологических мембран, на снимках видно трехслойное строение мембраны (рис.5).

|
| Рис. 8. Жидкостно-мозаичная модель плазматической мембраны. |
Новая информация о строении мембраны была получена с помощью метода "замораживание-скол-травление" (см рис.7). По этому методу клетку охлаждают до очень низкой температуры в жидком азоте. Охлаждение проводится с очень большой скоростью (около 1000 градусов в секунду). При этом вода, содержащаяся в препарате, переходит в твердое аморфное состояние. Затем клетки раскалываются специальным ножом и помещаются в вакуум. Замерзшая вода быстро возгоняется, освобождая поверхность скола (этот процесс и называют травлением). После травления получают реплику (отпечаток со сколотой поверхности) и фотографируют в электронном микроскопе. Замороженные мембраны могут при раскалывании расщепляться в разных направлениях, в том числе и вдоль границы двух липидных монослоев, и поэтому можно видеть их внутреннее строение (рис.6).
Было обнаружено, что имеются белковые молекулы, погруженные в липидный бислой и даже прошивающие его насквозь. Это привело к существенному изменению представлений о строении мембраны.

|
| Рис. 9. Холестерин и фосфолипид в биомембране |
Современное представление о структуре мембраны. Совокупность результатов, полученных физическими и химическими методами исследования, дала возможность предложить новую жидкостно-мозаичную модель (рис.8) строения биологических мембран (Сингер и Никольсон, 1972 г.). Согласно Сингеру и Никольсону, структурную основу биологической мембраны образует двойной слой фосфолипидов, инкрустированный белками (рис.8). Различают поверхностные (или периферические) и интегральные белки.
Липиды находятся при физиологических условиях в жидком агрегатном состоянии. Это позволяет сравнить мембрану с фосфолипидным морем, по которому плавают белковые "айсберги". Одним из подтверждений жидкостно-мозаичной модели является и тот факт, что, как установил химический анализ, в разных мембранах соотношение между содержанием белков и фосфолипидов сильно варьирует: в миелиновой мембране белков в 2,5 раза меньше, чем липидов, а в эритроцитах, напротив, белков в 2,5 раза больше, чем липидов. При этом, согласно современной модели, соотношение количества белков и липидов во всех мембранах должно быть примерно одинаково. Тот факт, что не вся поверхность биологической мембраны покрыта белками, показал и метод ядерного магнитного резонанса. Так, например, более чем половина поверхности мембраны кишечной палочки образована полярными головами липидов.
Кроме фосфолипидов и белков, в биологических мембранах содержатся и другие химические соединения (рис.9,10). В мембранах животных клеток много холестерина (в сравнимом количестве с фосфолипидами и белками). Есть в мембранах и другие вещества, например гликолипиды, гликопротеиды.
Жидкостно-мозаичная модель строения мембраны в настоящее время общепринята. Однако, как всякая модель, она дает довольно упрощенную картину строения мембраны. В частности, обнаружено, что белковые "айсберги" не всегда свободно плавают в липидном море, а могут быть "заякорены" на внутренние (цитоплазматические) структуры клетки. К таким структурам относятся микрофиламенты и микротрубочки (рис. 11). Микротрубочки - полые цилиндры диаметром около 300 нм из особого белка (тубулина) играют, по-видимому, важную роль в функционировании клетки.

|
| Рис. 10. Структурные формулы мембранных липидов: а - фосфатидилэтаноламин; б - фосфатидилсерин; в - фосфатидилхолин (лецитин); г - кардиолипин; д - холестерин |
Выяснилось также, что не все липиды в мембране расположены по принципу бислоя. Физические методы исследования показали, что липидная фаза мембран содержит также участки, где липидные молекулы не образуют двойной слой.
Изучением сложного химического состава мембран, мембранных белков и других веществ занимается биохимия. Основная область приложения биофизики - структурная основа мембраны, а именно двойной слой фосфолипидных молекул.
Молекула фосфолипида лецитина содержит полярную голову (производную фосфорной кислоты) и длинный неполярный хвост (остатки жирных кислот). В голове фосфолипидной молекулы лецитин имеются две заряженные группы, расположенные на некотором расстоянии друг от друга. Два разноименных заряды, равные по абсолютной величине, образуют электрический диполь.

|
| Рис. 11. Синтетическая модель клеточной мембраны: 1 - бимолекулярный слой фосфолипидов; 2 - интегральные белки; 3 - микрофиламенты; 4 - микротрубочки; 5 - части спектриновой сети; 6 - коммутационные белки; 7 - гликопротеиды внеклеточного матрикса; 8 - зоны аннулярных липидов |
В мембранах содержатся разные фосфолипиды. Например, в мембране эритроцитов их около 20 видов. Варьирует химическая формула полярной головы молекулы. У некоторых фосфолипидов головы кроме двух зарядов противоположного знака, создающих дипольный момент, но оставляющих молекулу в целом нейтральной, несут один некомпенсированный отрицательный заряд, вследствие чего молекула оказывается заряженной отрицательно. Углеводородные хвосты фосфолипидной молекулы содержат приблизительно 20 атомов углерода, в хвосте может быть 1-4 двойных ненасыщенных связей.

|
| Рис. 12. Схематичное изображение "однохвостовой" фосфолипидной молекулы (а) и схема образования поры в мембране из "однохвостовых" молекул |
Полярные головы молекул фосфолипидов - гидрофильны, а их неполярные хвосты - гидрофобны. В смеси фосфолипидов с водой термодинамически выгодно, чтобы полярные головы были погружены в состоящую из полярных молекул воду, а их неполярные хвосты были бы расположены подальше от воды. Такое расположение амфифильных (имеющих и гидрофильную, и гидрофобную части) молекул соответствует наименьшему значению энергии Гиббса по сравнению с другими возможными расположениями молекул.
Очень существенным является то обстоятельство, что молекулы фосфолипидов имеют два хвоста. Такая молекула в пространстве имеет форму, близкую к цилиндру. Из молекул фосфолипидов в водной среде происходит самосборка бислойной мембраны. Присутствие молекул с одним хвостом (лизолецитин), имеющих в пространстве форму, близкую к конусу, разрушает клеточные мембраны (рис. 12). Фосфолипидные молекулы, лишенные одного из хвостов, образуют поры в бислойной мембране, нарушается барьерная функция мембран.
Динамика мембран. Подвижность фосфолипидных молекул в мембранах
Режим функционирования мембраны сильно зависит от: микровязкости липидного бислоя и подвижности фосфолипидных молекул в мембране, фазового состояния мембранных липидов. Отклонения биофизических характеристик липидного бислоя от нормы связано с разного рода патологиями. Важную роль в физиологии клетки играют фазовые переходы в биологических мембранах.

|
| Рис. 13. Изменение спектров ЭПР при уменьшении микровязкости Т (увеличении подвижности молекул) - схематичное изображение |
Липидная фаза биологических мембран при физиологических условиях (температуре, давлении, химическом составе окружающей среды) находится в жидком агрегатном состоянии. Это доказано методами флюоресцентного анализа (с использованием флуоресцентных зондов и меток), электронного парамагнитного резонанса (ЭПР), с использованием спиновых зондов и меток, и ядерного магнитного резонанса (ЯМР).
Наиболее полные сведения об агрегатном состоянии липидных бислоев дают методы радиоспектроскопии ЭПР и ЯМР.
Электронный парамагнитный резонанс - это явление резкого возрастания поглощения энергии электромагнитной волны системой парамагнитных частиц (электронов с некомпенсированными спинами), помещенных во внешнее магнитное поле, при резонансной частоте волны. Спектром ЭПР называется зависимость мощности поглощения Р электромагнитной волны от величины магнитной индукции В.
Чем сильнее взаимодействие между атомами и молекулами образца, тем спектры ЭПР шире. Чем слабее взаимодействие между частицами (больше подвижность молекул), тем уже спектры ЭПР (рис. 13). По ширине спектров ЭПР можно судить о подвижности молекул вещества.
Так как молекулы фосфолипидов диамагнитны, для ЭПР-исследований биомембран используются спин-зонды и спин-метки - молекулы или молекулярные группы с неспаренными электронами.
Парамагнитные спин-зонды вводятся в липидную мембрану, спектры поглощения спин-зондами электромагнитной волны дают информацию о свойствах липидного окружения, в частности о подвижности липидных молекул в мембране.
Несмотря на ценную информацию, которую удалось получить при исследовании биологических объектов методом ЭПР с использованием спиновых зондов, этот метод обладает существенным недостатком - внесение в биологический объект чужеродных молекул-зондов может изменять структуру объекта. От этого недостатка свободен метод ЯМР.
Ядерный магнитный резонанс - это явление резкого возрастания поглощения энергии электромагнитной волны системой атомных ядер, обладающих магнитным моментом, помещенных во внешнее магнитное поле, при резонансной частоте волны.
Магнитным моментом обладают, например, такие ядра, как 

 . Не обладают магнитным моментом такие ядра, как
. Не обладают магнитным моментом такие ядра, как 

 . В биологическом объекте содержится много ядер
. В биологическом объекте содержится много ядер  - протонов, что дает возможность применять для их исследования ЯМР. В ЯМР используются более сильные магнитные поля, а частоты переменного электромагнитного поля меньше (5*107 Гц), чем в ЭПР.
- протонов, что дает возможность применять для их исследования ЯМР. В ЯМР используются более сильные магнитные поля, а частоты переменного электромагнитного поля меньше (5*107 Гц), чем в ЭПР.
Как и в случае ЭПР, спектры ЯМР тем шире, чем больше вязкость и меньше молекулярная подвижность исследуемого объекта.
Флуоресцентные, ЭПР- и ЯМР-исследования показали, что подвижность фосфолипидных молекул в мембране сравнительно велика, а вязкость мала. В нормальных физиологических условиях липидная часть мембраны находится в жидком агрегатном состоянии. Вязкость липидной мембраны сравнима с вязкостью подсолнечного масла (30-100 мПа*с, для сравнения: вязкость воды при 20о С составл
|
|
|


