 |
В реакции участвует только кислород и азот атмосферного воздуха.
|
|
|
|
Энергетика
Энергетика – область народного хозяйства, охватывающая энергетические ресурсы, выработку, преобразование, передачу и использование различных видов энергии.
Энергетика делится на теплоэнергетику, гидроэнергетику, ветроэнергетику, ядерную энергетику.
Теплоэнергетика – охватывает получение тепла при сгорании органического топлива и преобразование его в другие виды энергии (механическую, электрическую).
Топливо - горючие вещества, основной составляющей которых является углерод применяемые с целью получения при их сжигании тепловой энергии, а также как сырье в химической промышленности.
Наиболее часто используют следующие природные топлива: угли каменные, угли бурые, нефть, газы природные горючие, сланцы горючие, торф, древесину. Все они (кроме древесины) относятся к горючим ископаемым. В них содержится основная часть активного углерода планеты (более 90%, остальное - в живых организмах). За счет сжигания перечисленных топлив получают около 75%всей потребляемой энергии.
Охарактеризуем природные или ископаемые топлива:
Торф - геологически самый молодой среди горючих ископаемых. Образовался из скоплений болотных растений в условиях повышенной влажности и недостаточной аэрации. Торф - очень гидрофильное вещество. В процессе сушки объемная усадка достигает 50% первоначального объема. Но вода в торфе не только заполняет капилляры, на частично связана с ним. Это затрудняет сушку и препятствует механическому удалению влаги.
Содержание углерода в торфе возрастает с увеличением степени разложения растений. Зола торфа состоит главным образом из CaO, Fe2O3, Al2O3 и SiО2.
Угли бурые - смесь в разной степени превращенных остатков высших наземных растений, водорослей и организмов планктона. Содержание минеральных примесей (зольность) бурых углей м.б. больше 30%, содержание влаги около 20%. От торфов, из которых они произошли, отличаются большей однородностью и отсутствием неразложившихся остатков растений.
|
|
|
Основные буроугольные бассейны - Канско-Ачинский (Красноярский край), Подмосковный, Украинский, Челябинский.
Угли каменные - по запасам заключенной в них тепловой энергии (вместе с близкими им антрацитами) занимают основное место среди горючих ископаемых. Каменные угли являются одним из членов генетического ряда твердых горючих ископаемых: торф - бурый уголь - каменный уголь - антрацит.
Процессы метаморфизма (действие температуры, давления, других веществ) привели к образованию из бурого угля каменного, а, в конечном счете, - антрацита и графита. Это обусловило такое многообразие марок каменных углей, которое определяется составом их и свойствами (Д - длиннопламенный, Г - газовый, Ж - жирный, К - коксовый, С - спекающийся, ОС – отощенный спекающийся, Т - тощий, А - антрацит).
Содержание гигроскопической влаги в каменных углях снижается с ростом их метаморфизма от 7-9% в Д до 0,2-0,4% в Т.
Если зольность угля более 40%, то такие угли называют горючими сланцами. Основные составляющие золы каменных углей - оксиды кремния. Fе, AI, встречаются некоторые редкие элементы - германий, ванадий, вольфрам, титан и драгоценные металлы - Аu, аg.
Основные каменноугольные бассейны – Донецкий, Кузнецкий, Карагандинский, Кизеловский, Печорский.
Нефть - горючее ископаемое, смесь углеводородов с другими органическими соединениями (сернистыми, азотистыми, кислородными). Нефть - важнейший источник жидкого топлива, а также сырья для химической промышленности. Мазут - остаток после отгонки из нефти бензина и керосина.
Газы природные горючие - естественные смеси углеводородов различного состава. По способу добычи подразделяются на:
|
|
|
Ø собственно природные газы, добываемые из чисто газовых месторождений, практически не содержащие нефти;
Ø попутные газы, растворенные в нефти и добываемые вместе с ней;
Ø газы конденсатных месторождений;
Ø содержащие керосиновые, иногда соляровые фракции нефти.
Классификации топлив:
- по агрегатному состоянию (твердые, жидкие, газообразные);
- по происхождению (природные и искусственные, получаемые при переработке естественных - кокс, моторные топлива, газ коксовый и др.)
В золе топлива должны быть минимальные количества ванадия (0,001%) и натрия (0,0005%), являющихся основными коррозионными агентами.
Для сопоставления разных видов топлив принята условная единица - условное топливо - 1 тут = 7·106 ккал = 2,93·104 МДж.
Очевидно, что протекание процесса горения зависит как от свойств топлив, так и от организации самого процесса горения.
Свойства топлива определяются его химическим составом, горючей массой и балластом.
Химический состав топлива принято записывать символами элементов: С, Н, 0, N, S. Для содержания золы и влаги приняты обозначения А и W. Индексы справа сверху показывают, к какому топливу относятся данные: р - к рабочему, с - к сухому, г - к горюче массе, о - к органической массе.
Горючая масса - основные горючие составляющие: углерод (теплота сгорания 34,4 МДж/кг), водород (l43 МДж/кг), сера (9,3 МДж/кг).
Характеристики твердых и жидких топлив:
| Топливо | Химический состав, % | Низшая теплота сгорания, МДж/кг | ||||
| С | Н | О | N | S | ||
| Торф | 2,5 | 0,5 | 21,4 - 24,7 | |||
| Древесина | 42,6 | 0,5 | - | 16,9 - 20,1 | ||
| Бурый уголь | 64 - 77 | 4 – 7 | 15 – 25 | 0,5 – 7,5 | 26,4 - 30,2 | |
| Каменный уголь | 88 – 90 | 4 – 4,5 | 3 – 4 | 1,5 | 1 – 3 | 31,4 - 34,6 |
| Антрацит | 90 - 93 | 2 - 4 | 2 - 4 | 0,5 - 2 | 33,7 - 35,0 | |
| Сланцы | 60 – 75 | 7 - 9 | 10 - 17 | 5 - 15 | 29,3 - 37,7 | |
| Мазут | 86 - 88 | 10 – 10,5 | 0,5 – 0,8 | 0,5 – 0,8 | 0,5 – 3 | 44 - 46 |
Сера содержится в топливе в 3-х видах: органическая (в составе сложных соединений), колчеданная (в соединениях с Fе и другими металлами) и сульфатная.
Негорючие вещества вместе с влагой топлива образуют балласт топлива. Минеральные примеси, характеризующие зольность, присутствуют в виде силикатов (кремнезем, глинозем, глина), сульфидов (FeS), карбонатов (Ca, Мg, Fе), сульфатов (Ca, Mg), оксидов металлов, фосфатов, хлоридов и других солей щелочных металлов в разных сочетаниях для разных месторождений.
|
|
|
Важнейшая характеристика топлива - теплота сгорания.
Высшая теплота сгорания топлива - количество теплоты, выделяющееся при полном сгорании твердого, жидкого или газообразного топлива, когда вся влага топлива переходит в продукты реакции горения.
Низшая теплота сгорания меньше высшей на то количество тепла, которое затрачивается на испарение воды, образующейся при сгорании топлива, а также влаги, содержащееся в нем.
Т.к. при сгорании 1вес.ч. водорода образуется 9вес.ч. Н2О, то общее количество испарившейся воды равно (W + 9Н)% от веса топлива, анизшая теплота сгорания QН равна:
QН = QВ - 6(W + 9Н) ккал/кг.
QН = QВ - 25(W + 9Н) кДж/кг,
где W - содержание влаги в топливе, вес.%.
Н -содержание водорода в топливе, вес.%
Процесс горения твердого топлива проходит через несколько стадий:
- подсушка топлива,
- возгон летучих веществ и образование кокса,
- горение летучих веществ и кокса.
Процесс гетерогенного горения (коксового остатка) - основной процесс горения твердого топлива.
При горении твердых частиц наблюдаются две ситуации:
- на поверхности твердых частиц доступ воздуха к месту реакции не ограничен, реакция идет по типу С + О2 == СО2 и скорость горения определяется кинетикой химической реакции - кинетический режим горения;
- под поверхностью твердой частицы кислорода для полного окисления недостаточно, скорость реакции горения определяется скоростью диффузии кислорода к месту реакции. Реализуется диффузионный режим горения 2С + О2 = 2СО
Дальнейшее окисление СО в топках не играет заметной роли из-за очень малой скорости реакции. Основная реакция, по которой выгорает СО - его реакция с гидроксидом: СО + ОН = СО2 + Н
СО + Н2О = СО2 + Н2
Поэтому добавки пара и воды способствуют снижению выхода СО и дополнительному получению энергии.
В реакциях горения вещества проходят через промежуточные стадии, в результате которых образуются активные продукты - атомы и радикалы. В процессе горения эти продукты воспроизводятся, обеспечивая его дальнейшее протекание. Примером цепной реакции (теорию горения и закономерности его протекания изучал Семенов Ник.Ник - ак.АНСССР, создавший количественную теорию цепных реакций) может служить окисление водорода, в котором последовательная цепь реакций имеет вид:
|
|
|
Н + 02 = ОН + 0
О + Н2 = ОН + Н
2ОН + 2Н2 = 2Н2О + 2Н
т.е. вступление 1атома Н в реакцию Н + 3Н2 = 2Н2О + 3Н вызывает появление 3-х атомов Н, которые, в свою очередь, могут вызвать развитие цепи.
При горении органических веществ рвутся связи в больших органических молекулах, образуются радикалы и с большими, и с малыми молекулярными массами, возможно образование канцерогенных веществ путем рекомбинации радикалов. Их наличие определяется индикацией бенз(а)пирена, который присутствует в продуктах горения различных агрегатных состояний топлива и может конденсироваться в виде капель или желтых иглообразных кристаллов.
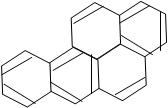 Бенз(а)пирен – полициклический ароматический углеводород (С20Н12). В природе весьма устойчив (на протяжении более 40 дней не уменьшает свою активность в воде). Температурная зависимость выхода имеет максимум, который при времени реагирования 0,2 – 0,5 с соответствует температуре 1450 – 1550 К.
Бенз(а)пирен – полициклический ароматический углеводород (С20Н12). В природе весьма устойчив (на протяжении более 40 дней не уменьшает свою активность в воде). Температурная зависимость выхода имеет максимум, который при времени реагирования 0,2 – 0,5 с соответствует температуре 1450 – 1550 К.
При горении следующего компонента горючей массы - серы - образуется один из наиболее токсичных газообразных выбросов – SO2. Его количество определяется сернистостью топлива - Sр, %.
S + О2 = SO2
SO2 составляет 98-99% от выброса сернистых соединений. Разные топлива существенно отличаются по содержанию серы. Наибольшую сернистость имеют топлива европейской части СССР; подмосковные и украинские бурые угли, донецкие и интинский каменные угли, эстонские горючие сланцы, мазуты из нефти Татарии и Башкирии. Сибирские угли (кузнецкие, канско-ачинские) как правило, имеют небольшое содержание серы. Бессернистым топливом является природный газ большинства месторождений, за исключением оренбургского, ряда месторождений Средней Азии и нижней Волги. Потоки SO2, измеряемые млн.т/год пересекают государственные границы. В наиболее неблагоприятных условиях оказался восток и северо-восток Европы (из-за преобладающих западных потоков воздушных масс). Так, на территорию бывшего СССР ежегодно приносится 5-10 млн.т SO2, а уходит на запад примерно 1,5 млн.т. Выпадение на территории Скандинавии кислых дождей приносит до 7ОО тыс.т SO2 в год. Причем 75 – 90% попадает из других стран: 240тыс.т из США, 160 - из Италии, остальное -вклад теплоэнергетических объектов ФРГ и Англии.
Одним из вредных веществ, попадающих в атмосферу при горении топлив, являются оксиды азота. Их образование идет по 3 путям:
|
|
|
- образование топливных оксидов азота. Полное превращение азота топлива в оксиды наблюдается при Nр не менее 0,1%. При увеличении содержания азота в топливе количество его оксидов в отходящих газах не меняется, а увеличивается содержание пиридинов, хинолинов, смолистых веществ, NН3, значительная часть азота переходит в нитриды и N2. Время образования топливных оксидов азота – 10–2 – 10–3 с.
- образование быстрых оксидов азота. Эти оксиды обнаруживаются при времени горения 10-4с. Предложен механизм их образования с участием радикалов, образующихся при горении, и азота воздуха:
СН· + N2 = НСN + N·
НСN + (Н,ОН) = СN· + (Н2, Н2О)
СN· + О2 = СО + NО
СN· + ОН· = СО + NН·
NН· + ОН· = NО + Н2
- с увеличением температуры горения увеличивается доля термических оксидов азота, реакция идет по цепному механизму:
О2 = О· + О· инициирование цепи
N2 = N· + N·
О· + N· = NО + N· рост цепи
N· + О2 = NО + О·
О· + О· = О2 обрыв цепи
N· + N· = N2
В реакции участвует только кислород и азот атмосферного воздуха.
Энергия активации этих реакций велика, поэтому скорость образования термических оксидов азота очень сильно зависит от температуры.
При температуре горения до 1000˚С количество оксида азота определяется количеством топливных, которых очень мало. В области от 1200 до 1500°С присутствуют все виды оксидов азота, а при температуре выше 1500° резко возрастает доля термических оксидов азота:
С(NОх), мг/м2 0,00127 0,38 2,54 4700 31700
температура; OC 20 300 500 1500 2200
Для топочных камер больших размеров характерен медленный темп охлаждения продуктов сгорания и больший, чем для малых топок период реакции синтеза NО. Поэтому выход термических оксидов азота в топочных камерах энергоблоков (при температурах выше 1700°) составляет до 1,5г/м3, а для малых промышленных и отопительных котлов со значительно скоростью охлаждения продуктов сгорания выход термических оксидов азота невелик или полностью отсутствует.
Таким образом, оксиды азота образуются по трем механизмам:
- топливному, зависящему от содержания азота в топливе и от избытка воздуха,
- быстрому, действующему в начале зоны горения, в результате взаимодействия радикалов топлива с азотом воздуха. Выход NO слабо зависит от температуры, а сильно - от структуры молекул топлива,
- термическому, в результате термической диссоциации молекул кислорода и азота воздуха и последующем окислении азота кислородом. Выход NO значительно зависит от температуры.
Различают гомогенное и гетерогенное горение, т.е. однофазное (газ-воздух) и двухфазное (твердое или жидкое топливо - воздух).
К гомогенному типу горения относится горение газообразных топлив.
При сжигании органического топлива различают 3 типа горения:
1-нейтральное (стехиометрическое) или горение топлива без избытка воздуха Коэффициент избытка воздуха α = 1.0
2- окислительное или полное сгорание при избытке воздуха α > 1.0
3-восстановительное или неполное при недостатке воздуха α < 1.0
Возможно смешанное (окислительно-восстановительное) горение, которое характерно для горения частиц твердого топлива.
В балластных соединениях тоже проходят химические реакции:
- окисляется сульфидная сера
4FеS + 702 = 2Fe2O3 4SO2
- при температуре выше 600° разлагаются карбонаты
CaCO3 = СаО + CО2
- при температуре выше 1000° разлагаются сульфаты:
СаSO4 == СаО + SO3
Минеральные частицы образуют золу – твердые частицы разных размеров.
Зольностью топлива (Ар, %) называется отношение массы негорючих материалов к массе топлива. Зольность зависит от природы топлива и качества его обработки перед сжиганием.
Различают первичную золу - остатки минеральных примесей, входящих в состав топлива, при его образовании; вторичную золу - посторонние минеральные вещества, равномерно распределенные в горючей массе топлива и породу - минеральные вещества, попавшие в топливо при его добыче.
Содержание первичной золы в сухой массе топлива не превышает 1-1,5%, породы – 2-2,5%. Суммарная зольность некоторых марок углей может превышать 40%, где основная доля принадлежит вторичной золе.
Образование NО2 в процессе горения
При горении происходит доокисление NО до NО2 в результате взаимодействия с атомарным кислородом и, в основном, с радикалом НО2·. Эксперименты показали, что доля NО, образовавшегося за счет реакции NО + О = NО2 чрезвычайно мала. Основное количество NО2 образуется за счет реакции
NО + НО2· = NО2 + ОН
Начало роста накопления радикалов НО2 в пламени наблюдается при 360-380°С. Выше 400° он доминирует среди активных центров в пламени. Максимальная его концентрация наблюдается при 500°. Источником атомарного водорода в этой реакции м.б. реакция догорания СО: CO + OН = СО2 + Н Таким образом, NО2 образуется в зоне резкого охлаждения пламени и результате взаимодействия с пероксидными радикалами. Эта реакция идет при температуре ниже 704°. Резкое охлаждение продуктов сгорания в котлах имеет место в малых отопительных котлах. Такой переход резко увеличивает токсичность выброса, т.к. ПДК(NО)сс = 0,06мг/м3, ПДК(NО2)сс = 0,04мг/м3.
Состав оксидов азота, образующихся в процессе горения, равен 85-90% NО и 10-15% NО2.
Образование NО 2 в дымовой струе.
При движении в дымовой струе концентрация NО 2 возрастает до 70%. Установлена определяющая роль атмосферного озона в доо-кислении NО по реакции NО + О3 = NО2 + О2
Эта реакция проходит в 105 раз быстрее, чем окисление NO атмосферным кислородом, т.е. выбрасываемый с дымовыми газами NО "съедает" озон. Концентрация озона в воздухе равна 0,061 - 0,121 мг/м3.
При ежегодном выбросе 50 млн.т NО потери озона в приземном слое атмосферы составят 80 млн.т/год, последствия этого еще не ясны. Кроме того из-за большей реакционной способности (образование смеси азотной и азотистой кислот с атмосферной влагой), резко усиливаются процессы вторичного загрязнения атмосферы.
По дисперсности пылевидной золы классифицируют на тонкодисперсные (удельная поверхность более 4000 см2/г), средне дисперсные (удельная поверхность 2000-4000 см2/г и грубодисперсные (удельная поверхность менее 2000 см2/г).
Мелкие и легкие частицы (размером менее 100 мкм), содержащиеся в золе в количестве 80-85%, уносятся из топок с дымовыми газами, образуя золу-унос. Ее состав:
более 40 мкм 4,4%,
20 – 40 3,9%,
5 – 20 5,7%,
I – 5 36,2%,
менее 1 49,8%.
Частицы размером более 12 мкм полностью задерживаются в верхних дыхательных путях. Более мелкие частицы проникают в легкие, вызывая различные заболевания. Частицы размером более 100 мкм оседают на под топки, сплавляясь в шлаки. Анализ золы и шлака показывает наличие в них ряда элементов с содержанием, значительно превышающем их среднее содержание в земной коре.
| Элемент | Ср.содержание в литосфере, г/т | Ср.содержание в золе, г/т | Коэффициент обогащения |
| Бор | 3.0 | ||
| Германий | 7.0 | ||
| Мышьяк | 5.0 | ||
| Уран | 2.0 | ||
| Вериллий | 5.0 | ||
| Серебро | 0.1 |
Т.к. большинство твердых топлив содержит калий, изотоп которого 40К радиоактивен, а также смесь изотопов урана и тория, можно сделать вывод, что летучая зола является источником загрязнения атмосферы радиоактивными веществами. Правда, значения этих выбросов значительно меньше ПДК для таких веществ.
В зависимости от модуля основности m, представляющего собой отношение массовых долей основных оксидов к кислым
m = [С(CaO+MgO)]/[C(SiO2+Al2O3)],
золы и шлаки делятся на основные (m более 0.9), кислые (m = 0,6-0,9) и сверхкислые (m менее 0,6).
При сжигании топлива вся его масса превращается в отходы, причем масса продуктов сгорания превышает массу использованного топлива за счет включения азота и кислорода воздуха в 4-5 раз.
|
|
|


