 |
Химические свойства кислот
|
|
|
|
Тема 1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Основные определения.
Химия – одна из фундаментальных естественных наук, предметом изучения которой являются вещества, их свойства и превращения. Одной из центральных характеристик вещества является масса m. Истинные массы структурных составляющих вещества (атомов, молекул и др.) очень малы, порядка 10-24¸10-20 г, поэтому для удобства в химии принято работать не с абсолютными, а с относительными значениями масс.
Относительная атомная масса химического элемента Аr – это величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 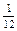 массы изотопа углерода 12 (
массы изотопа углерода 12 (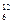 С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
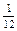 массы
массы 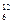 С называется атомной единицей массы (а.е.м.), т. е.
С называется атомной единицей массы (а.е.м.), т. е.
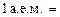
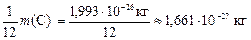 .
.
Относительная молекулярная масса вещества Mr находится как сумма Аr атомов, из которых состоит молекула.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль n – такое количество вещества, которое содержит столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 12 г изотопа углерода 12.
Число атомов в 12 г 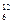 С равно 6,02×1023 атомов. Это число называется постоянной Авогадро N А, которая равна N А = (6,022045±0,000031)×1023 моль-1.
С равно 6,02×1023 атомов. Это число называется постоянной Авогадро N А, которая равна N А = (6,022045±0,000031)×1023 моль-1.
Таким образом, количество вещества можно оценить по формуле
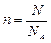 , (1)
, (1)
где N – число элементарных структурных единиц вещества.
Масса 1 моль вещества называется молярной массой M. Ее можно вычислить как отношение массы вещества m к его количеству n, кг/моль (г/моль):
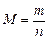 или
или 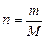 (2)
(2)
Численное значение М (в г/моль) совпадает с Mr вещества или Аr элемента.
|
|
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Неорганические соединения обычно делят на четыре важнейших класса: оксиды, основания, кислоты и соли.
Оксиды – это соединения, состоящие из двух элементов, одним из которых является кислород. Образование названия оксида (его номенклатура) подчиняется следующим правилам:
а) Если элемент, соединяясь с кислородом, проявляет единственную степень окисления, то название такого соединения состоит из слова «оксид» и названия металла, например: Na2O – оксид натрия, BaO – оксид бария.
б) Если элемент, соединяясь с кислородом, проявляет различные степени окисления, то после названия элемента в круглых скобках римскими цифрами указывается степень окисления элемента или систематическое название с числовыми приставками, например: N2O – оксид азота (I) или оксид диазота, NO2 – оксид азота (IV) или диоксид азота.
Оксиды делятся на солеобразующие и несолеобразующие. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Основные оксиды образуются металлами, степень окисления которых не выше трех (например, оксиды щелочных и щелочно-земельных металлов). Кислотные оксиды образуются неметаллами, а также металлами со степенью окисления +4, +5, +6, +7, например: Р2О3, SiО2, Mn2О7 и т.д. Амфотерные оксиды образуются металлами, проявляющими амфотерные свойства и степень окисления которых равна +2, +3, например: Al2О3, Cr2О3, Ga2О3, Fe2О3, SnО, BeО, ZnО и т.д.
Если элемент образует несколько оксидов (например, хром: 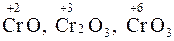 ), то по мере увеличения его степени окисления усиливается кислотный характер оксида. Таким образом, CrO – основной оксид, Cr2O3 – амфотерный оксид, CrO3– кислотный оксид.
), то по мере увеличения его степени окисления усиливается кислотный характер оксида. Таким образом, CrO – основной оксид, Cr2O3 – амфотерный оксид, CrO3– кислотный оксид.
Химические свойства оксидов
1. Оксиды щелочных и щелочноземельных металлов, а также кислотные оксиды непосредственно реагируют с водой:
Nа2O + Н2О = 2NаOН;
|
|
|
основной вода щелочь
оксид
N2O5 + Н2О = 2НNO3.
кислотный вода кислота
оксид
2. Основные и кислотные оксиды реагируют между собой:
Nа2O + СО2 = Nа2СО3.
основной кислотный соль
оксид оксид
3. Амфотерные оксиды реагируют с кислотными и основными оксидами:
ZnO + SO3 = ZnSO4;
амфотерный кислотный соль
оксид оксид
ZnO + Nа2O = Nа2ZnO2.
амфотерный основной соль
оксид оксид
4. Основные оксиды взаимодействуют с кислотами:
Nа2O + H2SO4 = Nа2SO4 + Н2О.
основной кислота соль вода
оксид
5. Кислотные оксиды взаимодействуют с основаниями:
N2O5 + 2NаOН = 2NaNO3 + Н2О.
кислотный основание соль вода
оксид
6. Амфотерные оксиды взаимодействуют с кислотами и основаниями, проявляя при этом:
– основные свойства:
ZnO + H2SO4 = ZnSO4 + Н2О;
амфотерный кислота соль вода
оксид
б) кислотные свойства:
ZnOт + NаOНт  Nа2ZnO2 + Н2О.
Nа2ZnO2 + Н2О.
амфотерный основание соль вода
оксид
Гидроксиды можно рассматривать как продукты соединения оксидов с водой. Они бывают трех видов: основные (основания), кислотные (кислоты) и амфотерные (амфолиты).
Амфолиты – гидроксиды, которые проявляют как основные, так и кислотные свойства. Чтобы установить амфотерность гидроксида, следует провести две реакции взаимодействия его с кислотой и с основанием. Если обе реакции осуществимы, то гидроксид амфотерен.
Основания – электролиты, которые при диссоциации в качестве анионов образуют только гидроксид-ионы ОН–, например:
NаOН ↔ Nа+ + ОН–.
Кислотность основания определяется числом гидроксильных групп. В связи с этим различают:
– однокислотные основания (например: NаOН, LiOH);
– двухкислотные основания (например: Mg(OH)2, Cu(OH)2);
– трехкислотные основания (например: Al(OH)3, Fe(OH)3).
Основания, в составе которых находится более одной гидроксильной группы, называются многокислотными. Диссоциация многокислотных оснований протекает ступенчато:
Cu(OH)2 ↔ CuOH+ + ОН– I ступень
CuOH+ ↔ Cu2+ + ОН– II ступень
По растворимости основания делят на сильные, т.е. растворимые в воде (к ним относятся гидроксиды щелочных и щелочноземельных металлов), и слабые, т.е. малорастворимые в воде (гидроксиды остальных металлов).
Номенклатура основанийоснована на следующих положениях:
|
|
|
1. Если металл имеет постоянную степень окисления, то названия образуются из слова «гидроксид» и названия металла, например: Mg(OH)2 – гидроксид магния, NаOН – гидроксид натрия.
2. Если металл имеет переменную степень окисления, то к слову «гидроксид» добавляется приставка латинского числительного или после названия катиона в круглых скобках римскими цифрами указывается его степень окисления, например: Cr(OH)3 – тригидроксид хрома, или гидроксид хрома (III); Fe(OH)2 – дигидроксид железа, или гидроксид железа (II).
Химические свойства оснований
1. Основания взаимодействуют с кислотами (реакция нейтрализации):
NаOН + HCl = NаCl + Н2О.
основание кислота соль вода
2. Растворимые основания взаимодействуют с кислотными оксидами:
2NаOН + СО2 = Nа2СО3 + Н2О.
основание кислотный соль вода
оксид
3. Растворимые основания взаимодействуют с солями (условие: один из продуктов нерастворим):
2КОН + MgCl2 = Mg(OH)2↓ + 2KCl.
основание соль основание соль
4. Нерастворимые основания при повышении температуры разлагаются на оксид и воду:
Cu(OH)2 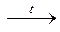 CuO + Н2О.
CuO + Н2О.
5. Амфотерные гидроксиды взаимодействуют с кислотами и основаниями, проявляя при этом:
а) основные свойства:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O;
амфотерный кислота соль вода
гидроксид
б) кислотные свойства:
Zn(OH)2 т + 2NаOНт = Na2ZnO2 + 2H2O.
амфотерный основание соль вода
гидроксид
6. Растворы оснований изменяют цвет индикаторов: фенолфталеин – с бесцветного на малиновый, лакмус – с фиолетового на синий, метиловый оранжевый – с оранжевого на желтый.
Кислоты – это электролиты, которые в водных растворах диссоциируют на катион водорода Н+ и кислотный остаток, например:
HCl ↔ H+ + Cl−.
Основность кислоты определяется числом катионов водорода, поэтому HCl, HNO3 – одноосновные кислоты; H2SO4, H2S – двухосновные кислоты; H3PO4 – трехосновная кислота. Многоосновные кислоты диссоциируют ступенчато, например:
H2SO4 ↔ H+ + HSO4− I ступень
HSO4− ↔ H+ + SO42− II ступень
Кислоты могут быть бескислородными (не содержащими кислород в своем составе: HCl, H2S) и кислородсодержащими (содержащими в своем составе кислород: H2SO4, HNO3).
|
|
|
Номенклатура кислот подчиняется следующим правилам:
1. Названия бескислородных кислот образуются путем прибавления к корню русского названия элемента через соединительную гласную «о» и словосочетания «водородная кислота», например: HCl– хлороводородная кислота, HF – фтороводородная кислота.
2. Названия кислородсодержащих кислот образуются из названия неметалла с прибавлением - ная, - вая, если степень окисления неметалла равна номеру группы. При понижении степени окисления суффиксы меняются в следующем порядке: - оватая,
- истая, - оватистая, например: HCl+7O4 – хлорная кислота, HCl+5O3 – хлорноватая кислота, HCl+3O2 – хлористая кислота, HCl+O – хлорноватистая кислота.
3. Если элемент в одной и той же степени окисления образует две кислоты, различающиеся «по содержанию воды», то перед названием кислоты, содержащей меньшее количество атомов кислорода, ставят приставку мета-, а перед названием кислоты с большим числом атомов кислорода ставят приставку орто-, например: HP+ 5 O 3 – метафосфорная кислота,Н3P+5O 4 – ортофосфорная кислота.
Химические свойства кислот
1. Кислоты взаимодействуют с основными оксидами:
2HCl + Na2O = 2NaCl + H2O.
кислота основной соль вода
оксид
2. Кислоты взаимодействуют с основаниями (реакция нейтрализации):
HCl + NаOН = NaCl + H2O.
кислота основание соль вода
3. Кислоты взаимодействуют с солями с образованием новой кислоты и новой соли (условие: образование осадка или выделение газа):
HCl + AgNO3 = AgCl↓ + HNO3.
кислота соль соль кислота
4. Кислоты взаимодействуют с металлами:
а) соляная и разбавленная серная кислоты с металлами, стоящими в ряду стандартных электродных потенциалов до водорода, с выделением водорода:
2HCl + Mg = MgCl2 + H2↑;
б) азотная кислота, в зависимости от положения металла в ряду стандартных электродных потенциалов и концентрации кислоты, с выделением NO2, NO, N2O, N2или NH3, например:
Pb + 4HNO3 = Pb(NO3) 2 + 2NO2↑ + 2H2O;
в) концентрированная серная кислота, в зависимости от положения металла в ряду стандартных электродных потенциалов, с выделением SO2илиH2S,например:
Cu + 2H2SO4 (конц) = CuSO4 + SO2 ↑ + 2H2O.
5. Раствор кислоты изменяет цвет индикатора: лакмус – с фиолетового на красный, метиловый оранжевый – с оранжевого на розовый, конго красный – с красного на синий.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или катион аммония NH4+) и анионы кислотных остатков. Соли делятся на средние, кислые, основные, двойные, комплексные и гидратные.
Средние соли – продукты полного замещения атомов водорода на металл, например: BaSO4, NaCl. Диссоциацию средней соли можно выразить уравнением
|
|
|
NaCl ↔ Na+ + Cl−.
Кислые соли (гидросоли) – продукты неполного замещения атомов водорода многоосновных кислот на металл. Образуются только многоосновными кислотами, например: Ba(HCO3)2, MgHPO4. Диссоциацию кислой соли можно выразить уравнением
Ba(HCO3)2 = Ba2+ + 2HCO3 –.
Основные соли (гидроксосоли) – помимо металла и кислотного остатка содержат гидроксильные группы ОН–. Образуются только многокислотными основаниями, например: AlOHCl2, Cr(OH)2NO3. Диссоциацию основной соли можно выразить уравнением
AlOHCl2 = AlOH+ + 2Cl–.
Двойные соли образуются при действии на многоосновную кислоту двух различных оснований. Двойная соль содержит катионы двух металлов и анионы одной и той же кислоты, например:
K2NaPO4 ↔ 2K+ + Na+ + PO43–;
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42–.
Комплексные соли – это вещества, в состав которых входят сложные ионы (в формулах они заключаются в квадратные скобки), способные отщепляться при диссоциации, например:
K4[Fe(CN)6] ↔ 4K+ + [Fe(CN)6]4–;
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl–.
В большинстве комплексных соединений различают внутреннюю и внешнюю сферы. Например, в К2[BeF4] и [Zn(NH3)4]Cl2 внутреннюю сферу составляют группировки атомов в квадратных скобках [BeF4]2– и [Zn(NH3)4]2+, а внешнюю сферу, соответственно, ионы К+ и Сl–. Центральный атом (ион) внутренней сферы называется комплексообразователем, а координированные вокруг него молекулы (ионы) – лигандами.
Гидратные соли – это соли, содержащие молекулы кристаллизационной воды, например: Na2SO4 · 10H2O.
Номенклатура солейобразуется по следующим правилам:
1. Название средней соли образуется из названия аниона (кислотного остатка) в именительном падеже и катиона (металла или основания) в родительном падеже. Если металл проявляет переменную степень окисления, то после названия катиона указывают римскими цифрами в скобках степень его окисления, например: NaCl – хлорид натрия, FeS– сульфид железа (II).
2. Названия кислых солей образуются добавлением к названию аниона приставки гидро-,например: KНSO4 – гидросульфат калия, Ca(H2PO4)2 – дигидрофосфат кальция.
3. Названия основных солей образуются добавлением к названию катиона приставки гидроксо-, например: AlOHSO4 – сульфат гидроксоалюминия, Al(OH)2Cl – хлорид дигидроксоалюминия.
4. Названия двойных солей образуются из названия аниона (кислотного остатка) в именительном падеже и катионов (металла или основания) в родительном падеже в алфавитном порядке, например: KAl(SO4)2 – сульфат алюминия-калия.
5. Название комплексного иона начинается с указания лигандов и заканчивается названием металла (комплексообразователя) с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русский корень названия металла, например: [Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II),[Ag(NH3)2]2SO4 – сульфат диамминсеребра (I). При образовании названия комплексных анаионов применяют латинский корень названия металла с суффиксом - ат, например: K[Al(OH)4] – тетрагидроксиалюминат калия, K4[Fe(CN)6] – гексацианоферрат (II) калия.
6. Названия гидратных солей образуются чаще всего, начиная с численной приставки к слову гидрат,далее следует название средней соли в родительном падеже, например: СaCl2 · 2H2O – дигидрат хлорида кальция.
Химические свойства солей
1. Соли взаимодействуют с кислотами с образованием новой соли и новой кислоты. Условиями протекания реакций являются:
– образование осадка или газа;
– сильная кислота вытесняет слабую из ее соли в соответствии с рядом уменьшения силы кислот (см. прил. 3), например:
2KNO3 + H2SO4 = 2HNO3 + K2SO4;
BaCl2 + H2SO4 = BaSO4↓ + HCl.
2. Соли взаимодействуют с растворимыми основаниями с образованием новой соли и нового основания (условие: образование осадка), например:
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH.
3. Соли взаимодействуют с другими солями с образованием двух новых солей (условие: образование осадка), например:
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2NaNO3.
4. Соли взаимодействуют с металлами с образованием новой соли и нового металла (условие: новый металл в ряду стандартных электродных потенциалов стоит ближе к началу ряда, чем исходный металл), например:
CuSO4 + Mg = MgSO4 + Cu;
NaCl + Mg ≠.
Получение кислых солей
1. Взаимодействием основания с избытком кислоты, например:
NaOH + H2CO3 = NaHCO3 + H2O.
2. Взаимодействием средней соли с избытком кислоты, например:
Na2SO4 + H2SO4 = 2NaHSO4.
Получение основных солей
1. Взаимодействием кислоты с избытком основания, например:
H2SO4 + 2Са(ОН)2 = (СаOH)2SO4 + 2H2O.
2. Взаимодействием средней соли с избытком основания, например:
CuSO4 + 2NaOH = (CuOH)2SO4 + Na2SO4.
Перевод кислых (основных) солей в среднюю соль
1. Взаимодействием кислойсоли с основанием, например:
NaHSO4 + NaOH = Na2SO4 + H2O.
2. Взаимодействием основнойсоли с кислотой, например:
(CuOH)2SO4 + H2SO4 = 2CuSO4 + 2H2O.
Основные газовые законы
Количественные расчеты между веществами, находящимися в газообразном состоянии, удобнее производить не по массе, а по объему. Наиболее важными законами газового состояния являются законы Авогадро, Менделеева-Клапейрона и Дальтона.
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро вытекает два важных следствия:
Следствие 1: при одинаковых физических условиях (то есть Р,Т = const) 1 моль любого газа занимает один и тот же объем, который называют молярным объемом VM. При нормальных условиях (н.у.) – давление 101,325 кПа (1 атм или 760 мм рт. ст.), температура 273 К (0 °С) – этот объем равен V 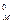 = 22,4 дм3/моль;
= 22,4 дм3/моль;
Следствие 2: отношение масс равных объемов различных газов равно отношению их молярных масс:
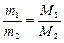 , (3)
, (3)
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение 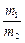 называется относительной плотностью первого газа по второму D
называется относительной плотностью первого газа по второму D 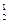 . Тогда из формулы (3) следует, что
. Тогда из формулы (3) следует, что
M1 = M2 × D 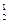 . (4)
. (4)
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое отражает закон Менделеева-Клапейрона:
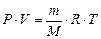 , (5)
, (5)
где 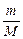 = n, моль; P – давление, Па; V – объем, м3; R = 8,314
= n, моль; P – давление, Па; V – объем, м3; R = 8,314 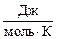 - универсальная газовая постоянная; T – температура, К.
- универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, химически не взаимодействующих друг с другом, то общее давление такой смеси Р можно определить по закону Дальтона:
Р = Р1 + Р2 + Р3 + …, (6)
где Р – общее давление; Р1, Р2, Р3 … - парциальные давления газов 1, 2, 3 ….
Парциальным давлением газа Рi в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси. Его можно рассчитать по формулам:
Рi = 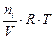 , (7)
, (7)
Pi = xi × P, (8)
где ni – число моль i -го газа в смеси; 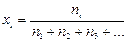 – мольная доля i- го газа в смеси.
– мольная доля i- го газа в смеси.
|
|
|


