 |
Лекция на тему: Начала термодинамики
|
|
|
|
План.
1. I-е начало термодинамики.
2. Понятие энтропии. II-е начало термодинамики для равновесных систем.
3. III-е начало термодинамики.
4. II-е начало термодинамики для неравновесных систем. Энтропия неравновесных процессов.
1. Как известно из курса общей физики, I–е начало термодинамики представляет собой наиболее общую форму закона сохранения и превращения энергии.
Непосредственным следствием I–го начала является вывод об однозначности внутренней энергии 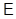 как функции термодинамического состояния. Предположим, что внутренняя энергия системы не является однозначной, т.е. при одном и том же полном наборе термодинамических параметров
как функции термодинамического состояния. Предположим, что внутренняя энергия системы не является однозначной, т.е. при одном и том же полном наборе термодинамических параметров 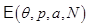 имеются два значения энергии:
имеются два значения энергии:  (Ө,V,a,N) ≠
(Ө,V,a,N) ≠ 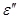 (Ө,V,a,N). В этом случае имелась бы возможность извлечь и использовать энергию
(Ө,V,a,N). В этом случае имелась бы возможность извлечь и использовать энергию
 ,
,
не изменяя термодинамического состояния системы и окружающих ее тел. Однако в этом случае нарушается I–е начало термодинамики.
По этой причине I-е начало иногда формулируют как невозможность создания вечного двигателя 1–го рода, который совершал бы работу, не требуя никаких энергетических затрат.
Однозначность внутренней энергии ε (Ө,V,a,N) позволяет рассматривать ее как некоторый термодинамический потенциал, поскольку ее изменения при переходе из состояния 1 в состояние 2 не зависит от процесса.
Запишем I–е начало термодинамики для частного случая перехода термодинамической системы в некоторое состояние, близкое к исходному. Причем, параметры этих состояний отличаются на бесконечно малые величины. В этом случае I–е начало можно представить в виде большой энергии: бесконечно малые изменения внутренней энергии dε происходит за счет того. Что система поглощает количество тепла δQ, совершает работу δW и за счет изменения числа частиц на dN:
|
|
|
 (2.1)
(2.1)
Величина μ получила название химического потенциала и характеризует изменение внутренней энергии за счет добавления в систему одной частицы при отсутствии работы и потоков тепла:
 (2.2)
(2.2)
Заметим, что величина химического потенциала не тождественна удельной внутренней энергии ε = ε / N.
Запишем далее I-е начало термодинамики для бесконечно малого изменения состояния системы. Будем предполагать, что внешнее поле а, в котором находится система, отсутствует или не изменяется. Тогда состояние системы описывается в переменных (Ө,V,N), которые наиболее часто используются в прикладных задачах. Учтем, что
 . (2.3)
. (2.3)
Кроме того,
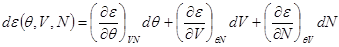 (2.4)
(2.4)
Соотношения (2.3) и (2.4) позволяют представить (2.1) в виде:
 (2.5)
(2.5)
Выражение (2.5) позволяет оценить тепловой(калорический) эффект термодинамического процесса и широко используется на практике. Однако пока его использование невозможно по той причине, что нам известны количественные значения только из давления (определяется из уравнения состояния p = p(Ө,υ) и теплоемкости
 ,
,
заданная из калорического уравнения состояния.
В открытых системах (допускающих обмен веществом) первое начало термодинамики имеет несколько более сложный вид:
dε = δФ – δW + μdN (2.6)
Здесь δФ характеризует суммарный поток энергии, обусловленный не только теплопередачей но и переносом вещества.
2. Второе начало термодинамики в формировке Рудольфа Клаузиуса (1865 г) гласит: Для любой равновесной (квазиравновесной) термодинамической системы существует однозначная функция термодинамического состояния 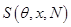 , называемая энтропией. Причем, ее полный дифференциал равен:
, называемая энтропией. Причем, ее полный дифференциал равен:
 . (2.7)
. (2.7)
|
|
|
С математической точки зрения (2.7) можно интерпретировать таким образом: дифференциальное выражение I начала термодинамики (2.5) всегда имеет интегрирующий множитель, равный обратной температуре.
Энтропия физической системы является аддитивной функцией, т.е. полная энтропия системы равна сумме энтропий каждой ее части:
 . (2.8)
. (2.8)
Изменение энтропии 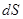 состоит из двух частей:
состоит из двух частей:
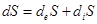 . (2.9)
. (2.9)
Здесь  – поток энтропии, обусловленный взаимодействием с окружающей средой, а
– поток энтропии, обусловленный взаимодействием с окружающей средой, а  – часть энергии, обусловленная изменениями внутри системы.
– часть энергии, обусловленная изменениями внутри системы.
Величина  никогда не имеет отрицательного значения. Она равна нулю только в том случае, если система претерпевает обратимые изменения, но всегда положительна, если в системе протекают и необратимые процессы:
никогда не имеет отрицательного значения. Она равна нулю только в том случае, если система претерпевает обратимые изменения, но всегда положительна, если в системе протекают и необратимые процессы:
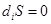 (обратимые процессы), (2.10а)
(обратимые процессы), (2.10а)
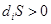 (необратимые процессы). (2.10б)
(необратимые процессы). (2.10б)
Для изолированной системы поток энтропии равен нулю и выражения (2.9) и (2.10) сводятся к соотношению
 (изолированная система). (2.11)
(изолированная система). (2.11)
Соотношение (2.11) для изолированной системы равноценно классической формулировке, согласно которой энтропия никогда не может уменьшаться. В этом случае энтропия является общим критерием необратимости (неравновесности).
В некоторых источниках энтропию рассматривают как функцию качества энергии. Так, согласно Кельвину, энергией высокого качества является механическая и электрическая энергии, энергий среднего качества – химическая энергия, а энергией низкого качества – тепло.
То есть в замкнутой изолированной системе количество энергии остается неизменным. Обратимые преобразования или химические реакции внутри системы не изменяют качества энергии. Необратимые преобразования понижают качество.
Для характеристики качества энергии часто вводят понятие негэнтропии (негативной энтропии):
 . (2.12)
. (2.12)
|
|
|
Важность рассмотрения отрицательной энтропии была подчеркнута Э. Шредингером в книге “ Что такое жизнь с точки зрения физики?” Если живой организм нуждается в пище, то это связано только негэнтропией, которую он может получить из пищи для восполнения потерь на совершенную механическую работу или вследствие процессов деградации в живо организме. Энергия, содержащаяся в пище, существенного значения не имеет.
Впервые II-е начало термодинамики было сформулировано Сади Карно. Рассмотрим цикл, состоящий из двух изотерм и двух адиабат. По традиции этот цикл называют циклом Карно. Термостат с температурой  называют нагревателем, а термостат с температурой
называют нагревателем, а термостат с температурой 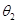 (
( ) – холодильником. Заставим термодинамическую систему (рабочее тело) совершать квазистатический процесс по циклу Карно и определим КПД этой тепловой машины как отношение
) – холодильником. Заставим термодинамическую систему (рабочее тело) совершать квазистатический процесс по циклу Карно и определим КПД этой тепловой машины как отношение
 . (2.13а)
. (2.13а)
Используя (2.1), имеем:
 . (2.13б)
. (2.13б)
То есть замкнутый цикл, составленный из двух изотерм  и пересекаемый двумя адиабатами (цикл Карно) можно использовать с КПД, который зависит только от температуры нагревателя
и пересекаемый двумя адиабатами (цикл Карно) можно использовать с КПД, который зависит только от температуры нагревателя  и холодильника
и холодильника 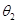 и не зависит от природы рабочего тела.
и не зависит от природы рабочего тела.
Сформулированное положение получило название теоремы Карно (первой теоремы Карно).
Также теоремой Карно (второй теоремой Карно) иногда называют теорему о том, что КПД любого теплового двигателя не может превышать КПД цикла Карно, осуществляемого при той же температуре нагревателя и холодильника.
Покажем, как из формулировки Карно следует утверждение Клаузиуса о существовании однозначной функции термодинамического состояния 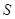 такой, что
такой, что  . Учитывая правило знаков для количества теплоты, перепишем (2.13а) и (2.13б) в виде:
. Учитывая правило знаков для количества теплоты, перепишем (2.13а) и (2.13б) в виде:
 . (2.14)
. (2.14)
Предположим теперь, что система совершает квазистатический процесс по произвольному циклу. Разобьем этот цикл на большое число (в процессе - бесконечное) циклов Карно, сложенных друг с другом. Для каждого из этих циклов
|
|
|
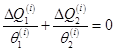 .
.
Суммируя по  и переходя к пределу бесконечного числа циклов, получаем:
и переходя к пределу бесконечного числа циклов, получаем:
 . (2.15)
. (2.15)
Последнее соотношение называется равенством Клаузиуса. Равенство нулю интеграла по замкнутому контуру означает, что стоящая под знаком интеграла величина, представляет полный дифференциал некоторой однозначной функции (функции состояния), которую обозначают через 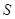 . То есть,
. То есть,  , что и является формулировкой II-го начала термодинамики Клаузиуса.
, что и является формулировкой II-го начала термодинамики Клаузиуса.
Помимо изложенных, можно привести и другие формулировки II-го начала. Так, в формулировке В. Томсона (лорда Кельвина) невозможно построить периодически действующую машину, которая совершала бы работу только за счет охлаждения некоторого источника тепла. Подобный двигатель был назван вечным двигателем II-го рода.
Поскольку таких двигателей создано не было, формулировка Томсона приобретает характер обобщения экспериментальных данных. Справедливость этого положения также следует из формулировки Клаузиуса. Пусть система совершает работу только за счет нагревателя (участок 1-2 на кривой). Возврат системы в прежнее состояние возможен только при 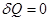 , то есть
, то есть
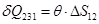 .
.
Отсюда следует, что возврат системы в прежнее состояние может быть осуществлен только по адиабате, т.к. 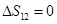 , т.е. адиабата дважды пересекает изотерму.
, т.е. адиабата дважды пересекает изотерму.
Таким образом
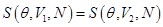 ,
,
то есть энергия не является функцией состояния, поскольку разным состояниям ( ) соответствует ее одно значение. Последнее положение противоречит формулировке II начала термодинамики Клаузиуса, т.е. вечного двигателя II-го рода, совершающего работу вдоль изотермы, не существует.
) соответствует ее одно значение. Последнее положение противоречит формулировке II начала термодинамики Клаузиуса, т.е. вечного двигателя II-го рода, совершающего работу вдоль изотермы, не существует.
Аналогичным образом можно доказать, что невозможно существование вечного двигателя, совершающего работу вдоль изобары или изохоры. Для его работы адиабата должна иметь, как минимум, две точки пересечения с изохорой или изобарой.
Другая формулировка II-го начала, также являющаяся обобщением экспериментальных данных, была введена Клаузиусом в 1850г.: “Тепло не может самопроизвольно перейти от менее нагретого тела к более нагретому”. Положим, что эта формулировка эквивалентна более поздней формулировке Клаузиуса о существовании функции состояния энтропии.
Пусть имеется некоторая система, состоящая из двух термостатов с температурами  , между которыми проходит теплообмен.
, между которыми проходит теплообмен.  – количество тепла, отдаваемое термостатом с меньшей температурой, а
– количество тепла, отдаваемое термостатом с меньшей температурой, а 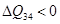 – количество тепла, получаемое термостатом с большей температурой.
– количество тепла, получаемое термостатом с большей температурой.
|
|
|
Поскольку процесс совершается самопроизвольно, то суммарная работа, совершаемая за цикл должна быть равна нулю. Это возможно только в том случае, если адиабаты 2-3 и 4-1 пересекаются. Тогда
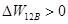 ,
,  ,
,  ,
,
т.е., в принципе было бы возможным “подстроить” характеристики процесса таким образом, чтобы
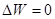 .
.
Однако совершить такой процесс не представляется возможным, поскольку, как уже было показано, адиабата (изоэнтропа) соответствует однозначной функцией состояния и, соответственно, пересечение адиабаты невозможно.
С положением о непересечении адиабат связана еще одна формулировка II-го начала термодинамики, предложенная в 1909 г. Каратеодори и признаваемая многими авторами наиболее удачной: вблизи каждого термодинамического состояния всегда есть состояние, перейти в которое посредством квазистатического адиабатического процесса невозможно.
Например, не существует адиабат, переводящих систему из состояния 2 через состояние 3 в состояние 1 (рис.3) или адиабат 4- Д, 1-Д, 3-С, 2-С на рис. 4.
Введенный принцип получил название принципа адиабатической недостижимости Каратеодори. Наглядно его можно проиллюстрировать с помощью семейства непересекающихся поверхностей с фиксированными значениями энтропии термодинамической системы.
Далее воспользуемся II-м началом термодинамики для уточнения калорического эффекта термодинамического процесса (2.5). Запишем:
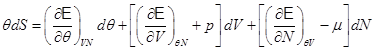 . (2.16)
. (2.16)
Выражение (2.16) и подобные ему, некоторые авторы называют обобщенной формулировкой I и II начала термодинамики.
Преобразуем дифференциал 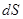 , и подставим его в (2.5):
, и подставим его в (2.5):
 .
.
Из последнего равенства следует:
 ,
,  ,
,  .
.
(2.17)
Учитывая, что
 ,
,
получаем
 .
.
Выполняя преобразования в последнем равенстве, имеем:
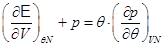 . (2.18)
. (2.18)
Аналогичным образом, учитывая
 ,
,
Находим:
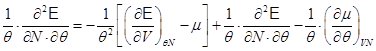 .
.
Последнее выражение можно переписать в виде:
 . (2.19)
. (2.19)
Соотношения (2.18) и (2.19) позволяют преобразовать (2.5) и (2.16), представив их в виде:
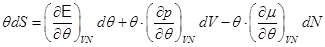 . (2.20).
. (2.20).
Практическое использование уравнения (2.20) возможно после определения выражения для химического потенциала. Для его получения выразим энергию  через функции состояния
через функции состояния 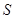 ,
,  и
и  :
:  . Тогда
. Тогда
 . (2.21)
. (2.21)
Здесь 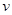 – удельный объем,
– удельный объем,  – удельная энтропия,
– удельная энтропия,  – удельная внутренняя энергия термодинамической системы.
– удельная внутренняя энергия термодинамической системы.
Далее воспользуемся первым началом термодинамики (2.1) с учетом второго начала (2.7):
 .
.
Полагая 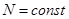 и разделив результат на
и разделив результат на  , получим соотношение для удельных величин:
, получим соотношение для удельных величин:
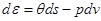 ,
,
откуда следует:
 ,
, 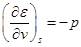 .
.
Подставляя последние выражения в (2.21), получаем:
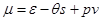 . (2.22)
. (2.22)
Далее определим удельную внутреннюю энергию  и удельную энтропию
и удельную энтропию 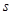 .
.
Система уравнений для удельной внутренней энергии следует из калорического уравнения состояния (1.8), первого начала термодинамики (2.5) и уравнения (2.18):
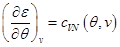 ,
,  . (2.23)
. (2.23)
Здесь 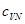 – удельная теплоемкость при постоянном объеме
– удельная теплоемкость при постоянном объеме 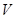 и сохранении числа частиц
и сохранении числа частиц  .
.
С математической точки зрения (2.23) представляет собой систему уравнений первого порядка в частных производных, правые части которых являются известными функциями. Данная система имеет решение, если выполняется равенство:
 . (2.24а)
. (2.24а)
или, для термодинамической “ координаты” произвольной природы
 . (2.24б)
. (2.24б)
Решение системы (2.23) и с точностью до постоянной имеет вид:
 . (2.25)
. (2.25)
Определение постоянной  (начального уровня отсчета энергии) не является исключительно термодинамической проблемой. Так, в классической механике сохраняется произвол в выборе нулевого потенциала. Такая же проблема присутствует и в электродинамике. Однако реальных затруднений это не вызывает, поскольку в эксперименте определяют либо приращение энергии
(начального уровня отсчета энергии) не является исключительно термодинамической проблемой. Так, в классической механике сохраняется произвол в выборе нулевого потенциала. Такая же проблема присутствует и в электродинамике. Однако реальных затруднений это не вызывает, поскольку в эксперименте определяют либо приращение энергии  , либо значения ее производных. По этой причине начало отсчета
, либо значения ее производных. По этой причине начало отсчета  для энергии может быть выбрано произвольным образом из соображений удобства.
для энергии может быть выбрано произвольным образом из соображений удобства.
Система уравнений для удельной энтропии следует из калорического уравнения состояния (1.8) с учетом II-го начала термодинамики (2.7), а также из системы (2.17):
 ,
, 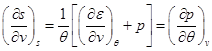 . (2.26).
. (2.26).
Совместимость системы (2.26) также обеспечивается условием (2.24). По аналогии с (2.25), запишем решение (2.26) в виде:
 , (2.27a)
, (2.27a)
Соответственно для энтропии системы в целом:
 . (2.27б)
. (2.27б)
Следует отметить, что в ряде проблем недостаточно ограничиваться только значениями приращения энтропии  или ее производными. Поэтому становится актуальным определение энтропийной константы
или ее производными. Поэтому становится актуальным определение энтропийной константы  (или
(или  ). Однако ни I, ни II–е начало термодинамики не отвечает на вопрос о ее значении. Эту проблему удалось решить только с возникновением (открытием) III начала термодинамики, которое будет рассмотрено далее.
). Однако ни I, ни II–е начало термодинамики не отвечает на вопрос о ее значении. Эту проблему удалось решить только с возникновением (открытием) III начала термодинамики, которое будет рассмотрено далее.
Кроме расчета калорического эффекта термодинамических процессов, определения внутренней энергии термодинамической системы, ее удельной энтропии и химического потенциала совместное использование I и II начал термодинамики позволяют рассчитать теплоемкость любых процессов. Обозначим через К. любой термодинамический процесс, геометрически изображенный в виде линии на поверхности термодинамических состояний  . Тогда для удельной теплоемкости можем записать:
. Тогда для удельной теплоемкости можем записать:
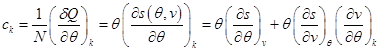 . (2.28)
. (2.28)
Учитывая (2.26), запишем:
 . (2.29)
. (2.29)
Так, если  – изобарический процесс (
– изобарический процесс (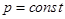 ), получаем:
), получаем:
 .
.
При записи последнего соотношения использовано известное равенство:
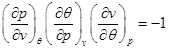 . (2.30)
. (2.30)
Доказать справедливость (2.30) самостоятельно.
3. В формулировке М.Планка третье начало термодинамики имеет вид краевого (предельного) условия для дифференциальных уравнений (2.26), определяющих энтропию. При стремлении температуры к нулю  энтропия системы также стремится к нулю:
энтропия системы также стремится к нулю:
 . (2.31)
. (2.31)
Таким образом, энтропийная константа 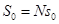 в принципе оказывается определенной, а вся формальная схема макроскопической термодинамики – полностью замкнутой.
в принципе оказывается определенной, а вся формальная схема макроскопической термодинамики – полностью замкнутой.
III-е начало установлено Вальтером Неристом в 1906 г. как обобщение экспериментальных данных по термодинамике гальванических элементов в форме, так называемой, тепловой теоремы Нериста:
Всякий термодинамический процесс, протекающий при фиксированной температуре 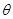 , сколь угодно близкой к нулю (
, сколь угодно близкой к нулю (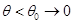 ) не сопровождался бы изменением энтропии S:
) не сопровождался бы изменением энтропии S:
 . (2.32)
. (2.32)
Справедливость выражения (2.32) может быть доказана на основании положений равновесной статической теории.
Формулировка Паули является более жесткой, поскольку она требует равенства нулю не приращения энтропии, а ее абсолютной величины (при стремлении температуры к абсолютному нулю). Эта формулировка является аксиомой. Однако она более удобна для практического использования.
Далее рассмотрим основное следствие, вытекающее из III-го начала термодинамики.
Рассмотрим калорическое уравнение состояния. Пренебрегая внешними полями, проинтегрируем выражение (2.26) для удельной теплоемкости:

по температуре с условием  . Тогда запишем:
. Тогда запишем:
 . (2.33)
. (2.33)
Разложим вблизи 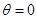 теплоемкость
теплоемкость  в ряд по степеням
в ряд по степеням  :
:
 (2.34)
(2.34)
Здесь 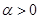 (может не являться целым числом). Подставляя (2.34) в (2.33) – выполняя интегрирование вблизи
(может не являться целым числом). Подставляя (2.34) в (2.33) – выполняя интегрирование вблизи 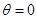 , получим:
, получим:

Поскольку, согласно II началу термодинамики, энтропия является однозначной функцией термодинамического состояния, т.е. конечной величиной при конечных 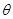 (а не величиной всюду равной бесконечности), то
(а не величиной всюду равной бесконечности), то  . Тогда для систем в области низких температур можем записать
. Тогда для систем в области низких температур можем записать
 ,
, 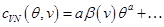 (2.35)
(2.35)
Причем в силу отсутствия особенностей при 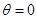 потребуем:
потребуем:  , а, в силу положительности теплоемкости,
, а, в силу положительности теплоемкости,  .
.
Исходя из выражения (2.35) для энтропии при низких температурах могут быть определены все остальные калорические свойства системы в окрестностях низких температур.
Например, используя (2.29') и (2.26), получим выражение при  :
:
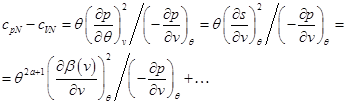 (2.36)
(2.36)
Таким образом, низкотемпературное поведение теплоемкости  определяется поведение величины
определяется поведение величины  . Так, если при
. Так, если при 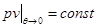 , то
, то
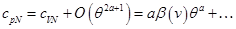
То есть изобарная теплоемкость в главном члене по  не отличается.
не отличается.
Если же при  произведение
произведение  ,
,  , т.к. условие также стремится к нулю по некоторому степенному закону
, т.к. условие также стремится к нулю по некоторому степенному закону  , т.е.
, т.е.
 . (2.37)
. (2.37)
Тогда температурное поведение теплоемкости  зависит от параметра
зависит от параметра  .
.
Рассмотрим дополнительную модель идеального газа. Как известно, его термодинамическое и калорическое уравнения состояния имеют вид:
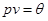 ,
, 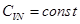 . (2.38)
. (2.38)
Легко заметить «противоречие» между последним выражением для теплоемкости и (2.35). Однако это кажущееся противоречие легко устраняется после указания условий применимости выражения (2.38).
Как будет показано в теме №9, уравнения (2.38) справедливы в области температур, превышающих, так называемую температуру вырождения  . В областях температуры
. В областях температуры 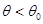 теплоемкость стремится к нулю по степенному закону с
теплоемкость стремится к нулю по степенному закону с 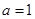 (ферми-газ) и
(ферми-газ) и 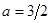 (бозе-газ).
(бозе-газ).
Другим важным следствием III-го начала термодинамики является вывод о недостаточности абсолютного поля.
Вообще говоря, существует только один способ приготовления системы, абсолютная температура которой в точности бы равнялась нулю – заставить систему совершать положительную работу за счет заключенной в ней внутренней энергии  . Очевидно, что этот процесс будет наиболее эффективным, если исключить подвод тепла из вне, т.е. сделать процесс адиабатным (
. Очевидно, что этот процесс будет наиболее эффективным, если исключить подвод тепла из вне, т.е. сделать процесс адиабатным ( ).
).
Рассмотрим возможные варианты перехода системы в это состояние:
1) Предположим, что нам удалось спуститься из некоторого состояния 1 по адиабате  до состояния 2, лежащего на изотерме
до состояния 2, лежащего на изотерме 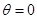 . Но, согласно III-му началу, изотерма
. Но, согласно III-му началу, изотерма 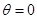 совпадает с нулевой адиабатой
совпадает с нулевой адиабатой 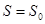 . То есть наше предположение о достижимости нуля температуры означает, что адиабата
. То есть наше предположение о достижимости нуля температуры означает, что адиабата  имеет общую точку с адиабатой
имеет общую точку с адиабатой  , что невозможно в силу нарушения II-го начала термодинамики (требования об однозначности энтропии как функции состояния).
, что невозможно в силу нарушения II-го начала термодинамики (требования об однозначности энтропии как функции состояния).
2) Произвольная начальная адиабата 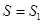 с самого начала была нулевой. Однако это также невозможно, поскольку мы в любом состоянии получили бы
с самого начала была нулевой. Однако это также невозможно, поскольку мы в любом состоянии получили бы  . Тогда все термодинамические процессы носили бы только адиабатический характер:
. Тогда все термодинамические процессы носили бы только адиабатический характер: 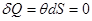 . Последнее положение не соответствует действительности, поскольку запрещает существование неадиабатических процессов, необходимых в эксперименте.
. Последнее положение не соответствует действительности, поскольку запрещает существование неадиабатических процессов, необходимых в эксперименте.
3) Попробуем с помощью какого-либо неадиабатического процесса перейти из состояния 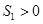 в состояние
в состояние  , а затем «спуститься» по адиабате к
, а затем «спуститься» по адиабате к 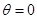 .
.
Невозможность такого перехода следует из неравновесия термодинамики открытых систем. Энтропия в термодинамической системе может быть уменьшена только за счет обмена веществом между этой системой и окружением. При этом термодинамическая система переводится в некоторое стационарное неравновесное состояние, энтропия которого 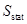 при определенных условиях не изменяется со временем. Однако значение
при определенных условиях не изменяется со временем. Однако значение 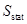 существенно отлично от нуля. То есть предложенный процесс физически нереализуем.
существенно отлично от нуля. То есть предложенный процесс физически нереализуем.
Попытки достичь абсолютного нуля с помощью химических превращений также обречены на провал, поскольку при низких температурах все химические реакции протекают с выделением тепла (эндо(кзо)термические), что соответственно, должно приводить не к уменьшению, а увеличению температуры системы.
4. II-е начало термодинамики для неравновесных процессов также было сформулировано Р.Клаузиусом. Для всякого неквазистатического процесса, происходящего в термодинамической системе:
 .(2.39).
.(2.39).
Выражение (2.39) получило название неравенства Клаузиуса. В интегральной форме это неравенство принимает вид:
∫ 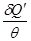 < 0 (2.39').
< 0 (2.39').
Таким образом, при исследовании неравновесных процессов все термодинамические соотношения равновесной теории приобретает оценочный характер, а выводы равновесной термодинамики – характер определенных соотношений.
II-е начало термодинамики для необратимых процессов позволяет определить его направление. Так, в адиабатически изолированной системе (δ 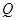 = 0), которая, к тому же, не совершает работы (δW = 0) все неравновесные процессы протекают в сторону увеличения энтропии:
= 0), которая, к тому же, не совершает работы (δW = 0) все неравновесные процессы протекают в сторону увеличения энтропии:
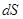 > 0 (2.40)
> 0 (2.40)
Равновесное состояние соответствует максимальному значению энтропии при фиксированных значениях термодинамических параметров системы (ε,a,V,N).
Отметим, что параметры термодинамической системы, вообще говоря, соответствуют ее равновесному состоянию. Для неравновесных систем используют следующий прием. Система “разбивается” на множество макроскопических подсистем, для которых задаются локальные термодинамические характеристики. Тогда о каждой из подсистем говорят как о термодинамической системе с локальными характеристиками неаддитивного типа (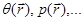 ) и удельными величинами (
) и удельными величинами ( ).Аддитивные величины для всей системы округляются как суммы значений в каждой из макроскопических частей, которую можно записать в виде интеграла:
).Аддитивные величины для всей системы округляются как суммы значений в каждой из макроскопических частей, которую можно записать в виде интеграла:
N =  ,
,  ,
, 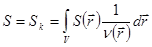 (2.41)
(2.41)
Перейдем к более детальному анализу необратимых процессов. Рассмотрим систему состоящую из двух закрытых подсистем I и II (между этими фазами нет обмена вещества, но допускается обмен энергией). Пусть температура этих подсистем равна ӨI и ӨII. Применяя к каждой фазе уравнение (2.7), получим:
dS = dSI + dSII (2.42)
Равенство (2.42) вытекает из свойства аддитивности энтропии.
Количество тепла, полученное каждой из фаз, можно представить в виде:
 ,
,  (2.43)
(2.43)
Здесь введены обозначения  – количество тепла, полученное от подсистемы I подсистемой II (и наоборот),
– количество тепла, полученное от подсистемы I подсистемой II (и наоборот), 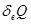 – количество тепла, полученное подсистемами из внешней среды.
– количество тепла, полученное подсистемами из внешней среды.
Учитывая баланс теплоты:
 ,
,
см. 10 лист
 (2.44)
(2.44)
или
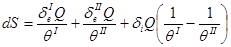 (2.45)
(2.45)
Учитывая (2.9), запишем:
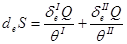 ,
,  (2.46)
(2.46)
Первая часть (2.46) характеризует теплообмен с внешней средой, а вторая создается за счет необратимого перехода тепла внутри системы. В соответствии с (2.10б) приращения энтропии всегда положительно. Прирост энтропии может быть равен нулю только после установления теплового равновесия:
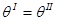
Сделаем важное замечание о невозможности уменьшения энтропии в части з<
|
|
|


