 |
Роль оксидантного стресса в патогенезе токсических повреждений печени
|
|
|
|
Одним из самых распространенных экзогенных факторов повреждения печени является токсическая альтерация гепатоцитов. Наиболее часто ее осуществляют средства бытовой, промышленной, сельскохозяйственной и медицинской химии по причине специфической функции печени, обеспечивающей детоксикацию ксенобиотиков поступивших в организм. Особую опасность представляют хлорированные углеводороды и нафталины, бензол и его производные, соединения меди, железа, мышьяка. Зарегистрировано около 1000 лекарственных препаратов, способных при неправильном применении, повредить гепатоциты [139, 242]. Классическими гепатотропными ядами являются четыреххлористый углерод (СС14) и алкоголь [122, 245].
В патогенезе бактериальных, вирусных и токсических повреждений гепатоцитов большую роль играют активированные кислородные метаболиты (АКМ): О-2, 1О2, Н2О2, НО•, ОСl-, RO2• и др. (Меньщикова Е.Б., 2006). Многие из них являются свободными радикалами, характеризуются наличием в молекуле одного или нескольких непарных электронов и обладают высокой химической активностью (Клебанов Г.И., 2001; Ланкин В.З., 2006).
Понятия «свободные радикалы» и «активированные кислородные метаболиты» в биологических системах совпадают не полностью. В них неспаренный электрон может быть локализован на атомах углерода, серы, азота и др. в виде тиильных радикалов глутатиона (GS•) или радикалов мочевой кислоты (Янковский О.Ю., 2000; Шанин Ю.Н., 2003). С другой стороны, такие кислородсодержащие молекулы, как перекись водорода, синглетный кислород, гипогалогениты не являются радикалами, хотя и реагируют с органическими молекулами через радикальные механизмы. Чтобы объединить данные соединения в одну группу с радикалами, было введено понятие «активные формы кислорода», «активные метаболиты кислорода» или «активированные кислородные метаболиты» (Рис. 1) (Меньщикова Е.Б., 2006).
|
|
|

Рис. 1 – Активированные кислородные метаболиты, активные формы кислорода и радикалы (. Меньщикова Е.Б, 2006).
Активные формы кислорода являются физиологическими метаболитами, образуются и участвуют в работе микросомальной окислительной системы клетки - цитохрома Р450, в функционировании митохондрий, лизосом и пероксисом (НАДФ-зависимые оксидазы). Они обеспечивают нормальный характер обновления фосфолипидного бислоя биомембран, энергетику клетки, активность ее транспортных и рецепторных систем, сигнальную, фагоцитарную и др. функции (Биленко М.В., 1989; Владимиров Ю.А., 2000; Шанин Ю.Н., 2003, Ляхович В.В., 2005), [71, 124, 146, 152, 180, 341, 509].
Все радикалы, образующиеся в организме, подразделяют на первичные, вторичные и третичные (Рис. 2) (Владимиров Ю.А., 2000; Клебанов Г.И., 2001).
Первичные радикалы: радикалы убихинона, супероксид и окись азота образуются в реакциях дыхательной цепи клетки (Клебанов Г.И., 2001; Владимиров Ю.А., Потапенко А.Я., 2006). Первичные радикалы обладают цитотоксическим действием, причем, не только, благодаря образованию из них короткоживущих свободных радикалов, но и непосредственно, как это доказано для пероксинитрита и гипохлорита, а в некоторых ситуациях – и для перекиси водорода (Шанин Ю.Н., 2003).
Вторичные радикалы образуются из первичных при участии ионов металлов переменной валентности (Cu, Fe, Zn). К ним относят гидроксильный радикал, образующийся из перекиси водорода и пероксинитрит (ONOO), являющийся продуктом реакции между оксидом азота (NO) и супероксид анион радикалом кислорода (Владимиров Ю.А., Потапенко А.Я., 2006). Вторичные радикалы значительно более агрессивны, чем первичные и, при избыточном образовании, повреждают клетки организма, участвуя в патогенезе онкотрансформации, атеросклероза, воспаления и др. патологии (Клебанов Г.И., 2001; Саенко Ю.В., 2004; Владимиров Ю.А., Потапенко А.Я., 2006).
|
|
|
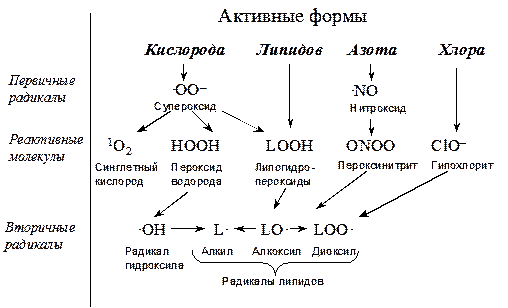
Рис. 2 – Классификация свободных радикалов, встречающихся в организме человека (Владимиров Ю.А., 1998).
Третичные радикалы образуются при взаимодействии первичных и вторичных с молекулами каких-либо легко окисляющихся веществ (Владимиров Ю.В., Потапенко А.Я., 2006).
Поддерживает необходимый для клетки уровень образования АКМ многокомпонентная антиоксидантная система (АОС), своими механизмами блокирующая избыточную генерацию свободных радикалов [73, 74, 75, 196, 235, 239]. АОС может компенсировать увеличение ПОЛ за счет субстратной активации и усиления биосинтеза антиоксидантных ферментов (супероксиддисмутаза, каталаза), восстановления глутатиона, и неферментными системами - витаминной и металлохелаторной.
При исчерпывании резервов и емкости подсистем АОС происходит сдвиг про-/ антиоксидантного равновесия в сторону усиления свободно-радикального переокисления и развитие необратимых изменений в клетке. Подобный сдвиг обозначается как «оксидантный стресс», «окислительный стресс», «кислородный стресс», «синдром пероксидации» [71, 196, 235].
Таким образом, окислительный стресс следует рассматривать как дисбаланс в системе «прооксиданты-антиоксиданты», приводящий к инициации деструктивных процессов. Причем это может быть связано, как с усилением генерации агрессивных форм АКМ [71, 152], так и со снижением резервов АОС [124, 151, 152, 178, 206, 244].
Результатом избытка короткоживущих агрессивных форм АКМ является патологическая инициация в клетке процессов перекисного окисления белков, нуклеиновых кислот и липидов (ПОЛ) биомембран [124, 151].
Как отмечалось выше достаточно часто токсическое повреждение печени вызывается отравлением СС14, которое также широко используется в моделировании печеночной патологии у животных. Гепатотоксичность СС14, в основном, связана с образованием электрофильных алкилирующих интермедиатов и свободных радикалов (СС13, трихлорметилпероксильный радикал), образующихся в ходе его метаболизма на цитохроме Р450. Метаболиты тетрахлорметана ковалентно связываются и модифицируют молекулы белков, нуклеиновых кислот, а также инициируют ПОЛ, атакуя двойные связи боковых цепей ненасыщенных жирных кислот (НЖК) мембранных фосфолипидов. В мембранах образуются кластеры продуктов ПОЛ, вызывающие микроразрывы и формирование неуправляемых ионных каналов [20, 63, 184, 187, 195, 233, 245, 270].
|
|
|
СС14 – индуцированные экспериментальные поражения печени реализуются не только активацией ПОЛ, что идентифицируется по увеличению содержания его интермедиатов (ТБК-активные продукты, диеновых конъюгатов, оснований Шиффа), но и существенным снижением активности ферментной АОС: супероксиддисмутазы (СОД), каталазы и глутатионовой системы (GSH) [11, 30, 201, 264, 270, 414, 418, 557]. Отмечено также повышение содержания в гепатоцитах 8-гидроксидезоксигуанозина (8-(OHdG) – маркера повреждения ДНК [493], а в сыворотке крови – лизосомальных маркеров клеточного цитолиза: АлАт, АсАт, ЩФ, ЛДГ [414, 418].
СС14 – индуцированный гепатит характеризуется разобщением клеточного окисления и фосфорилирования, сопровождающегося снижением синтеза АТФ, белков, ослаблением антитоксической функции печени и холестазом [185, 245]. Его морфологическая картина проявляется некрозом, белковой и жировой дистрофией гепатоцитов с преимущественной локализацией в центролобулярной зоне печеночной дольки, где максимальна активность зависимых от цитохрома Р450 монооксигеназ и преобладает продукция повреждающих метаболитов [233].
Оксидативный стресс играет существенную роль в остром и хроническом этанол - индуцированном повреждении печени [328, 627]. Его возникновение обусловлено особенностями окислительного метаболизма этого субстрата. Его агрессивный метаболит ацетальдегид может окислять или ковалентно связывать SH- NН2-группы ряда ферментов, включая глутатион - редуктазу, что изменяет состояние редокс - системы гепатоцитов: снижает их антиоксидантную защиту и усиливает образование свободных радикалов.Это может быть связано также с инактивацией NADH - дегидрогеназы митохондрий, что тормозит окисление субстратов и утилизацию О2 [94, 260, 480, 483].
|
|
|
Активация ПОЛ свободными радикалами при хроническом употреблении этанола может происходить в результате постоянной индукции цитохрома Р450 2Е1 микросомальной этанолокисляющей системы [480, 481, 482, 483, 484]. Имеются доказательства, что именно этот механизм является центральным в генерации О2-, Н2О2 и ОН. [297, 319, 469]. Кроме того этанольный метаболит печеночной микросомальной фракции 1-гидроксиэтильный радикал инактивирует GSH, α-токоферол и антиоксидантные ферменты - глутатионпероксидазу, глутатионредуктазу и супероксиддисмутазу, подавляя антиоксидантную защиту [322, 548, 613].
Ряд данных свидетельствует, что источником этанол-индуцированной генерации свободных радикалов могут быть клетки Купфера и нейтрофилы воспалительных инфильтратов. В этом случае свободные радикалы играют роль сигнальных молекул, реализующих альтерацию через активацию ядерного фактора транскрипции (NF-kB) и продукцию α-фактора некроза опухолей (TNF-α) [123, 261, 327, 389, 391, 622, 632].
Алкогольная интоксикация всегда сопровождается развитием микроциркуляторных расстройств и печеночной гипоксии, являющейся самостоятельным фактором свободно-радикального повреждения [112, 160, 483].
Существенную роль в гепатотоксичном действии этанола играет активация апоптоза, реализуемая через цитохром-каспазные и рецепторные ((TNF-α) механизмы [258, 377, 499, 605].
Этаноловое повреждение гепатоцитов сопровождается нарушениями метаболизма липидов и их накоплением в клетках (стеатоз), накоплением модифицированных белков, повышением проницаемости клеточных мембран. Все это способствует набуханию клетки и ее ультраструктур и развитию клеточного отека и дистрофий [94, 79, 260, 480].
Таким образом алкогольное повреждение печени является комплексным и обусловлено прямым воздействием этанола, активацией свободнорадикального окисления, метаболическими и воспалительными процессами, как в самих гепатоцитах, так и клеток Купфера [421, 472].
Токсические поражения печени, заканчивающиеся выздоровлением, оставляют «след» метаболических нарушений, способных сохраняться долгие годы. В таких условиях любая повышенная нагрузка на орган способна вызвать рецидив патологии, требующей гепатопротекторной, в том числе и антиоксидантной терапии [145, 487].
Литература Терехова
26. Влияние лекарственного растительного сбора «Диг-да-ши-тан» на течение тетрациклинового гепатита у белых крыс / Ж.Б. Дашинамжилов, Л.В. Лярская, К.С. Лоншакова и др. // Раст. ресурсы – 2000. – вып. 3 – С. 78-83. (26)
54. Комплексное исследование токсического действия циклоплатама на почки и печень / Н.В. Любимова, В.М. Абаев, Н.Е. Кушлинский и др. // Вопр. медицинской, биологической и фармацевтической химии – 2000. – № 3. – С. 38-44. (54)
|
|
|
55. Ветошкина, Т.В. Механизмы гепатотоксического действия противоопухолево препараты вепезида / Т.В. Ветошкина, Т.Ю. Дубская, Е.А. Тимина, В.Е. Гольдберг // Эксперим. и клин. фармакол. – 1998. – Т.61, № 4. – С. 54- 56. (55)
58. Катикова, О.Ю. Эффективность галстены при повреждении печени противотуберкулезными средствами / О.Ю. Катикова, Я.В. Костин // Эксперим. и клин. фармакол. – 2002. – Т.65, №2. – С. 64 – 66. (58)
74. Эффективность растительного полифенольного препарата пифламина при лекарственном поражении печени / Л.В. Яковлев, Н.Д. Бунятян, О.А. Герасимова, В.В. Чикиткина и др. // Эксперим. и клин. фармакол. – 1998. – Т.61, № 6. – С. 48- 50. (74)
112. Венгеровский, А.И. Механизм действия гепатопротекторов при токсических поражениях печени / А.И. Венгеровский, А.С. Саратиков // Фармакол. и токсикол. – 1988. – Т.51, №1. – С. 89 – 92. (112)
239.Асатова, Ш.С. Гепатопротекторные свойства эриксина при острых лекарственных гепатитах / Ш.С. Асатова, А.С. Комарин, М.Ш. Каримов, С.В. Акбаров // Хим.-фармац. журн. – 2003. – Т. 37, № 2. – С. 13 – 19. (239)
240.Степанюк, Г.И. Изониазидо-рифампициновый гепатит у крыс: коррекция нарушений с помощью винборона /Г.И. Степанюк, С.В. Сергеев // Совр. пробл. токсикол. – 2001.- № 3. – С. 95 – 96. (240)
241.Скакун, Н.П. Сезонные особенности гепатотоксичности тетрациклина / Н.П. Скакун, И.Ю. Высоцкий // Антибиотики. – 1984. – Т. 29, № 1. – С. 42 – 45. (241)
242.Скакун Н.П. Тетрациклиновые поражения печени и их лечение / Н.П. Скакун, А.Н. Олейник // Врачеб. дело. – 1984. – Т.11, № 11. – С. 91 – 95. (242)
243.Влияние стимуляции и депрессии макрофагов на развитие острого токсического гепатита у крыс, вызыванного парацетамолом / О.А. Левина, И.А. Гончарова, Т.Г. Филатова и др. // Эксперим. и клинич. фармакол. – 2003. – Т. 66, № 1. – С. 57 – 59. (243)
244.Скакун, Н.П. Состояние перекисного окисления липидов и желчеобразования при поражении печени парацетамолом / Н.П. Скакун, В.В. Шманько // Фармакол. и токсикол. – 1984. – Т.29, № 4. – С. 105 – 109. (244)
245.Муравьев, Ю.В. Токсическое повреждение печени диклофенаком натрия / Ю.В. Муравьев, Е.В. Осипова, А.В. Алексеева, И. С. Дыдыкина // Клинич. фармакол. и терапия. – 2002. – Т. 11, № 2. – С. 94 – 96. (245)
246.Studies on protective effect of total flavonoids of Astragalus on liver damage paracetamol-inducedby / Wang D.Q., Ding B.G., Ma Y.Q. et all // Zhongguo Zhong Yao Za Zhi.. - 2001. - Vol. 26, №7. - P. 483 – 486. (246)
248.Поражения печени у токсикоманов / Л.Ю. Ильченко, Т.М. Царегородцева, А.В. Петраков и др. // Гепатология. – 2003. - № 2. – С. 22 – 26. (248)
249.Ильченко, Л.Ю. Повреждение клеточных мембран при алкогольном и неалкогольном стеатогепатитах, их коррекция / Л.Ю. Ильченко, Е.В. Виницкая // Южно-российский мед. журн. – 2002. - № 2. – С. 31 – 33. (249)
250.Апросина, З.Г. Хронические диффузные заболевания печени (современные тенденции) / З.Г. Апросина// Клинич. фармакол. и терапия. – 1996. – Т. 5, № 1. – С. 14 – 18. (250)
251.Подымова, С.Д. Эффективность легалона при хронических заболеваниях печени / С.Д. Подымова // Клин. фармакол. и тер. – 1996. – Т. 5, №1. – С. 40 – 43. (251)
252.Справочник Видаль. Лекарственные препараты в России: Справочник, OVPEE-АстраФармСервис. – М., 2000. - 532 с.(252)
253.Характеристика гепатопротекторных лекарственных средств, представленных на фармацевтическом рынке России / В.А. Егоров, Л.В. Мошкова, В.А. Куркин и др. // Фармация. – 1999. - № 6. – С. 23 – 25. (253)
Литература Доркиной (см. диссертацию)
Литература Ельцовой
121.Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньщикова [и др.].- М.: Слово, 2006.- 553с.
82.Клебанов, Г.И. Современные проблемы физиологии и патологии пищеварения / Г.И. Клебанов // Прилож. №14 к Рос. Журн. гастроэнтерологии, гепатологии, колопроктологии: материалы XVI сессии Акад. шк.-семинара имени А.М. Уголева.- Пущино-на-Оке, 2001.- Т.11, №4.- С.109-118.
196.Oxidative stress during diabetes and heart failure / V. Lankin [et al.] // Atherosclerosis.- 2006.- Vol.7, №3.- P.354.
191.Янковский О.Ю. Токсичность кислорода и биологические системы (эволюционные, экологические и медико-биологические аспекты) / О.Ю. Янковский. – СПб: 2000 – 294 с.
186.Шанин, Ю.Н. Антиоксидантная терапия в клинической практике / Ю.Н. Шанин В.А., Шанин, Е.В. Зиновьев.- СПб.: ЭЛБИ, 2003.- 128с.
20.Биленко, М.В. Ишемические и реперфузионные повреждения органов (молекулярные механизмы, пути предупреждения и лечения) / М.В. Биленко.- М., 1989.- 368с.
39.Владимиров, Ю.А. Биологические мембраны и незапрограммированная смерть клетки / Ю.А. Владимиров // Соровск. Образовательный журн.- 2000.- Т.6, №9.- С.2-9.
105.Ляхович В.В., Вавилин В.А., Зенков Н.К. Активированные кислородные метаболиты в моноооксигеназных реакциях / В.В. Ляхович, В.А. Вавилин, Н.К. Зенков, Е.Б. Меньщикова // Бюллетень СО РАМН. – 2005 – № 4 (118) – С. 7-12.
45.Владимиров, Ю.А. Физико-химические основы фотобиологических процессов: учебник для вузов / Ю.А. Владимиров, А.Я. Потапенко.- 2-е изд., перераб. доп.- М.: Дрофа, 2006.- 288с.
149.Саенко Ю.В., Шутов А.М. Роль оксидативного стресса в патологии сердечно-сосудистой системы у больных с заболеваниями почек (Сообщение I. Патофизиология оксидативного стресса) / Ю.В. Саенко, А.М. Шутов // Нефрология и диализ. – 2004 – Т. 6 – № 1
|
|
|


