 |
Факторы миграций химических элементов
|
|
|
|
При рассмотрении миграции элементов необходимо выявлять причины, обусловившие данный процесс, так как их различные сочетания способны привести к усиленной миграции одних элементов и концентрации других в пределах даже относительно небольших участков. Причины миграции, с известной степенью условности, возможно разделить на внутренние, связанные со свойствами атомов и их соединений, и внешние, определяющие обстановку миграции.
Внутренние факторы миграций
1. Электростатические (кристаллизационные) свойства ионов. Данную группу факторов следует принимать во внимание только при миграции элементов в виде свободных ионов. Такая миграция характерна для водных растворов, газовых смесей, живого вещества и др. При рассмотрении электростатических свойств ионов традиционно применяется приближённо-количественный показатель ― ионный потенциал (отношение валентности иона к радиусу: Z/10ri, где Z ― валентность, ri ― радиус иона, нм). По величине данного показателя обычно выделяются 3 группы элементов (меньше 3; 3―12; больше 12) (рис.1).
Элементы первой группы (малозарядные и крупные ионы Li, Na, K, Rb, Cs, Mg, Ca, Sr, Ba, Fe2+, Mn2+, Cu, Zn, La, Pb и др.) легко переходят в ионные растворы природных вод, способны перемещаться на далёкие расстояния и не образуют комплексные ионы. Элементы второй группы (Be, Al, Si, Sc, Ti, V, Cr, Mn4+, Fe3+, Co, Ni, Ga, Y, Zr, Nb, Mo4+, Mo6+, Sn, Hf, Lu, Th), именуемые гидролизатами, образуют труднорастворимые гидролизованные и сложные комплексные соединения. Поведение членов данной группы дифференцированно в зависимости от pH среды. В частности, Mn выпадает в осадок в щелочной среде (pH 8―10), Al и Fe2+ ― в кислой (pH 3―5,5). Элементы третьей группы (малый ионный радиус и высокая валентность ― C, N, P, S, As, Se, Te), соединяясь с O2―, образуют растворимые комплексные ионы.
|
|
|
Последовательность кристаллизации минералов из растворов, как правило, в первом приближении контролируется энергией их кристаллических решёток. Последняя зависит от энергетических коэффициентов ионов (ЭК), возрастающих с увеличением валентности и уменьшением ионного радиуса:
ЭКкат = (Z2/20ri) × 0,75(10ri + 0,20); ЭКан = Z2/20ri,
где Z ― валентность, ri ― радиус иона, нм.
Ионы с большими значениями ЭК раньше выпадают из растворов; в процессах выветривания они, как менее подвижные, накапливаются в элювии. Дальность свободной миграции с увеличением радиуса иона возрастает [1], тогда как при диффузии ― уменьшается.
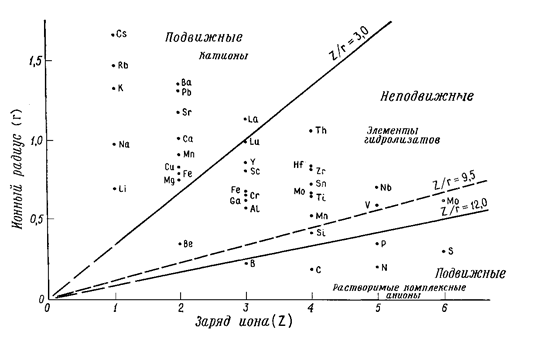
Рис.1. Группировка элементов в соответствии с их ионными потенциалами.
2. Свойство связи соединений. Эти свойства характеризуют способность соединений противостоять усилиям, направленным на их разрушение. Связь элементов в соединении определяется рядом параметров, среди которых необходимо указать на особенности внутреннего строения соединения и энергию его кристаллической решётки. Наибольшей механической прочностью обладают образования с большой энергией кристаллической решётки, с плохо выраженной спайностью и повышенной твёрдостью.
3. Химические свойства соединений. Говоря о наиболее распространённых в условиях земной поверхности соединениях ― карбонатах, хлоридах, сульфатах, ― следует учитывать, что только карбонаты Na, K, Cr растворимы в воде в значительной степени, тогда как прочие либо нерастворимы, либо растворимы незначительно; хлориды Na, Mg, Mn, Ni, K, Ca, Fe, Cu, Zn, Sr, Cd, Sn, Sb, Ba, Pt, Pb растворимы в воде, Cr, Ag, Au, Hg, Bi ― нерастворимы; в свою очередь в воде растворимы сульфаты Na, Mg, K, Mn, Cr, Fe, Co, Ni, Zn, Cd, Sn, Pt, остальные ― не растворимы или слабо растворимы. Мономинеральные породы разлагаются быстрее полиминеральных, присутствие изоморфных примесей может играть роль катализатора или ингибитора процессов выветривания.
|
|
|
4. Гравитационные свойства атомов.
5. Радиоактивный распад ядер атомов.
Внешние факторы миграций
В каждой геосфере Земли создаются специфические внешние факторы миграции в зависимости от изменения соотношений температуры, давления и концентрации раствора. Эти параметры обусловливают специфику термодинамики системы, которая, в свою очередь, создает условия для формирования тех или иных геохимических процессов. Рассмотрим особенности формирования среды, в которой постоянно протекают миграция, концентрация и рассеивание элементов.
Ведущими факторами природной среды являются 1) температура, 2) давление, 3)концентрация раствора, в гипергенной зоне дополнительно влияет тип климата. В зависимости от соотношения факторов изменяются условия от активной миграции элементов в жарком гумидном климате до их концентрации в аридном климате. В гипогенных условиях активная миграция возможна при высоком давлении и температуре, а кристаллизация – при понижении этих параметров. Таким образом, воздействие внешних факторов следует рассматривать самостоятельно в двух сферах: гипергенной и гипогенной.
Гипергенная зона является главным местом действия солнечной радиации. Под ее влиянием прямо или косвенно протекают все гипергенные процессы и связанная с ними миграция элементов. Потребление энергии и ее расход изменяются в зависимости от природной зоны. На ежегодную продукцию растительной массы затраты энергии колеблются от 2,5 кал/см2 в год в тундре до 2000 кал/см2 в год во влажнотропических лесах (для лесов умеренных широт 100–400 кал/см2 в год). На разрушение минералов и освобождение элементов (минеральное преобразование) затрачивается 0,2–0,5 кал/см2 в год в тундре и пустыне и 10–15 кал/см2 в год во влажных тропиках.
Скорость геохимических процессов определяется динамикой температуры. В теплый сезон контрасты температур колеблются от 5–6 °С до 40–50 °С. Повышение температуры активизирует процессы и миграцию. В тундре из-за низких температур геохимические процессы и миграция замедлены, во влажных тропических лесах высокая температура и влажность повышают скорость процессов и миграцию в 9,5 раза. Использование энергии на процессы во влажных тропических лесах в 30–35 раз выше по сравнению с тундрой.
|
|
|
Давление как фактор миграции элементов в зоне гипергенеза имеет меньшее значение, чем температура. В пределах вертикального профиля атмосферное давление составляет 1 атм и изменяется не более чем ± 3 %. Такое колебание давления активизирует лишь растворение газов в воде и косвенно влияет на гидролиз минералов.
Различное соотношение температур и увлажнения приводит к формированию различных типов климата. Среди них наиболее контрастные аридный и гумидный типы. В аридном климате при выпотном водном режиме создаются условия для активизации галогенеза, повышенной концентрации растворов, прежде всего, галогенов, щелочных и щелочноземельных металлов (Na, K, Rb, Cs, Ca, Mg, Ba, Cl, Br, I и др.). Гумидный климат создает промывной тип водного режима, который способствует выносу всех легкорастворимых и концентрации труднорастворимых соединений Fe, Al, Ti, Zr и др. Концентрация растворов минимальная. Моря и океаны отличаются повышенной концентрацией растворов, из которых осаждаются тяжелые элементы.
Гипогенная зона характеризуется высокими и сверхвысокими температурами, давлением и концентрацией химических элементов, что приводит к метаморфизации и магматизации пород, насыщению водных гидротермальных растворов. Во внутренних сферах Земли миграция элементов ограничена. В магме они распределяются более или менее равномерно и дифференцируются под действием гравитации: более легкие оказываются в верхней зоне, а тяжелые – в нижней. Снижение ведущих параметров гипогенной зоны приводит к трансформации фазы в ходе кристаллизации и последовательности образования минеральных видов с включением изоморфных форм более редких элементов. В ходе кристаллизации и других гипогенных процессов вблизи поверхности Земли, при излиянии магмы или извержении вулканов, происходит равномерное или концентрированное распределение элементов на разных глубинах в виде месторождений.
|
|
|
Большинство освоенных месторождений железных руд по генезису обязано формированию под влиянием гипергенных процессов настоящего или геологического времени.
3. Степень электролитической диссоциации.
4. Концентрация водородных ионов (pH).Данный фактор в ряде случаев контролирует осаждение из растворов химических соединений и коагуляцию (пептизацию) коллоидов. Большинство металлов, растворяясь в кислых растворах, образуют катионы, которые с повышением pH обычно выпадают в осадок в виде гидрооксидов. В щелочной среде элементы, обладающие амфотерными свойствами, могут снова перейти в растворённое состояние и образовать комплексные ионы.
Указать точные значения pH, при которых в природных условиях происходит осаждение или растворение элемента, затруднительно, так как на данный процесс оказывают влияние многочисленные сильно варьирующие факторы [2]. Применительно к почвам, различают: активную (pH) ― концентрация водородных ионов в почвенном растворе или суспензии; обменную (pHKCl) ― результат обмена поглощённых коллоидами ионов H+ и Al3+ на катион солевого раствора (KCl); и гидролитическую кислотность (H) ― результат реакции почвы с раствором соли сильного основания и слабой кислоты (CH3COONa). pH почвы влияет на интенсивность микробиологической деятельности, растворение минералов, усвоение питательных веществ растениями и др.
Таблица 1. pH и Eh природных сред
| Среда | рН | Eh |
| Метеорные воды | 3,0―7,2 | +200―+800 |
| Торфяные болота | 2,8―8,0 | ―350―+700 |
| Почвы | 2,8―10,0 | ―350―+750 |
| Грунтовые воды | 5,5―9,0 | ―100―+500 |
| Рудничные воды: | ||
| первичные | 5,0―9,0 | ―100―+200 |
| окисленные | 3,0―9,0 | +200―+800 |
| Пресные воды (реки и озёра) | 5,0―9,0 | ―50―+600 |
| Пресноводные осадки | 5,5―7,5 | -150―+600 |
| Прибрежные морские осадки | 6,5―9,0 | ―350―+500 |
| Морская вода | 6,0―9,5 | ―200―+500 |
| Мировой океан в среднем | 8,0 | +400 |
| Осадки открытого моря | 6,0―8,5 | ―400―+600 |
| Эвапориты | 6,0―10,0 | ―400―+600 |
| Термальные воды | 2,0―9,0 | ―200―+700 |
5. Окислительно-восстановительный потенциал (Eh) ― мера окислительной или восстановительной тенденции, присущей данной системе (табл.1). В сочетании с pH влияет на валентное состояние элементов переменной валентности (Mn2+«Mn4+, Fe2+«Fe3+ и т. д.). Окислительная (кислородная) обстановка способствует накоплению катионогенных элементов (например, Mn, Fe, Co) и увеличению растворимости анионогенных (S, V, Se, Mo, U) (табл. 2).
Таблица 2
|
|
|


