 |
Первое начало термодинамики
|
|
|
|
Лекция 2
Основы биоэнергетики.
Первое начало термодинамики
Значение энергии для каждого человека и для всего человечества столь велико, что трудно подобрать какое-либо сильное определение. Приведу сопоставление. Часто ли приходится слышать в массовой информации о ценах на чугун? Я давно не слышал. Но о биржевых ценах на нефть сообщается каждый день. Понятно, что подразумевается ценность нефти как источника энергоносителей. Подумайте сами, почти все, что нам приходятся предпринимать, связано с затратами энергии. Поехать или пойти, подняться на лифте, включить освещение, нагреть воду, махнуть рукой и т.д. Жизнедеятельность – это непрерывное потребление энергии, которая здесь же, в живом организме, и вырабатывается. И поэтому главный предмет нашей беседы – это энергетика человеческого организма.
Ряд систем организма полностью или частично функционируют для получения и преобразования энергии. Дыхательная система (легкие, дыхательные пути) для снабжения кислородом, непременным компонентом биологических процессов окисления; пищеварительная система в значительной степени работает для снабжения клеток окисляющимися веществами – углеводами и продуктами расщепления жиров, система кровообращения – транспорт веществ в организме, среди которых крайне важен кислород. Митохондрии – интереснейшая внутриклеточная структура, в каторой потенциальная энергия первичных энергоносителей (углеводов, жиров) переносится на образующиеся молекулы АТФ. Далее они отдают энергию на осуществление всех клеточных процессов, связанных с синтезом биологически необходимых веществ и производством работы (сокращение мышц, активный транспорт веществ, то есть перенос молекул и ионов против самопроизвольной диффузии). Система терморегулирования тоже составная часть биоэнергетики.
|
|
|
Процессы передачи и превращения энергии рассматриваются в термодинамике (физическое учение). Частью термодинамики является химическая термодинамика, а частью последней – биотермодинамика. Одновременно это и раздел биохимии. Биоэнергетику вы и будете изучать в биохимии, а ее фундаментальные основы – в курсе общей химии.
Одной из важнейших задач термодинамики является нахождение путей повышения коэффициента полезного действия всевозможных устройств, связанных с энергетикой. Как максимальную долю энергии использовать на производство работы, и меньше потерять в виде теплоты? В процессах жизнедеятельности к. п. д. весьма высок, но переход некоторой доли энергии в теплоту очевиден – при беге, погрузочных работах ощущается перегрев. Не откладывая, уточним понятия теплоты и работы.
Теплота и работа. Это формы передачи энергии.
Теплота, Q – неупорядоченная передача энергии в результате контакта движущихся микрочастиц и/или излучения в инфракрасной области спектра. Условием передачи теплоты является возникновение разности температур. Прежде чем при экзотермической реакции выделится теплота, в системе должна повыситься температура.

Работа, W – упорядоченная передача энергии, связанная с преодолением внешнего сопротивления. Соответствующие условия создаются в специальных устройствах. Печка дает только теплоту, а сложное устройство двигатель – работу и теплоту.
В качестве форм передачи энергии теплота и работа могут условно считаться как положительными, так и отрицательными:

Работа в конечном счете переходит в теплоту (шляпка забиваемого гвоздя нагревается). Поэтому теплоту процесса (реакции) используют в качестве меры энергетической способности реакции. Практически одновременно может передаваться теплота и совершаться работа (Q + W) в одном или противоположных направлениях.
|
|
|
Системы. В термодинамике центральным объектом рассмотрения является система. Все, что подлежит изучению, рассматривается в качестве систем: раствор с оседающими на дно кристаллами, смесь газов в баллоне, амеба, куст роз, и, конечно, человек. Важные для термодинамики разновидности систем: изолированные (нет обмена с окружающей средой), закрытые (возможен только обмен энергией), открытые – возможен обмен как энергией, так и веществом.

| Обмен веществом | Обмен энергией | |
| Изолированная | отсутствует | отсутствует |
| Закрытая | отсутствует | возможен |
| Открытая | возможен | возможен |
К системам какого типа относится организм человека? (Открытая система).
Может ли быть постоянной масса и энергия в открытой системе? (Да, в стационарном состоянии).
Теоретическое рассмотрение всевозможных вопросов упрощается для изолированных и закрытых систем. Изолированные системы, в принципе не существуют, но процесс (химическая реакция) даже в открытой системе может протекать так же, как в изолированной системе. Это возможно в случае быстрых процессов. Представим себе проведение реакции нейтрализации. Температура смеси повышается вследствие перехода скрытой (потенциальной) энергии веществ в кинетическую энергию молекул. Вы будете проводить такой опыт:

За время реакции теплота не успевает перейти в окружающую среду, а вода в ощутимом количестве испариться. В строго изолированной системе процесс шел бы также.
Состояние системы – совокупность внешних (p, T, V) условий и состава системы (концентраци всех имеющихся веществ). Состояние характеризуется параметрами – температура, давление, объем (это внешние параметры), концентрации веществ. Число задаваемых параметров должно быть минимально.
|
|
В термодинамике необходимо условиться о выборе стандартного состояния.
Стандартное состояние индивидуального вещества – устойчивая форма вещества при температуре 298,15°К и давлении 101,3 кПа. Эти значения температуры и давления приняты за стандартные условия. Но понятие стандартного состояния включает и другие характеристики. В частности – агрегатное состояние вещества. Стандартное состояние может относиться не только к стандартной температуре, но и к какой-либо другой, например, физиологической температуре 310 К.
|
|
|
Стандартное состояние раствора – определенная температура (часто 298,15°К) и концентрации всех растворенных веществ 1 моль/л.
Стандартное состояние смеси газов – определенная температура (часто 298,15°К) и парциальное давление каждого газа 101,3 кПа (1 атм).

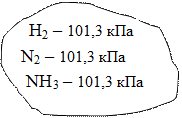
На рисунке слева показано стандартное состояние системы (раствора) для случая реакции
Фруктоза + Глюкоза = Сахароза + Н2О
При получении аммиака в стандартном состоянии системы (рисунок справа) общее давление 303,9 кПа.
Функции состояния – физические характеристики системы, однозначно определяемые параметрами состояния. Простой пример – плотность газа зависит от р и Т:

Более сложный пример – внутренняя энергия. Аналитическое выражение можно получить лишь для некоторых систем, но доказано, что это функция состояния:
U=f(p,V,T,ci)
Процесс – изменение состояния системы. Самопроизвольный процесс – идет сам, без внешнего воздействия на систему, связанного с непрерывной затратой работы. Не самопроизвольный (вынужденный) процесс – идет под воздействием на систему с передачей ей энергии в виде работы.
Рассмотрение процессов упрощается при постоянстве условий:
Изохорный процесс – при постоянном объеме V. Близки к изохорным все процессы без участия газов.
Изобарный процесс – при постоянном давлении р. Сюда относятся всевозможные процессы в условиях атмосферного давления.
Изотермический процесс – при постоянной температуре.
Изобарно-изотермический процесс при постоянных р и Т. В таких условиях (приближонно) проходят процессы в организме человека.
Адиабатический процесс – без передачи теплоты. Быстрые реакции протекают адиабатически (пример реакции нейтрализации дан выше).
|
|
|
Необратимые и обратимые процессы. Это важнейшие понятия термодинамики.
Необратимый процесс идет самопроизвольно до достижения конечного, устойчивого состояния. Обратимый процесс идет в условиях преодоления сопротивления, почти равного движущей силе процесса. Если в процессе преодолевается некоторое сопротивление, меньшее движущей силы процесса, то это также необратимый процесс, но несколько приближенный к обратимому. В обратимом процессе совершается максимальная работа. Рассмотрим пример расширения газа в цилиндре.

Газ находится под давлением, создаваемым цилиндром массой m 1 и грузом массой m 2. При удалении груза газ расширяется, производя работу поднятия цилиндра. Это необратимый процесс. Можно видоизменить опыт. Вместо компактного груза m 2 поместить на цилиндр мелкие кубики той же суммарной массы. Снимая один за другим кубики, мы дадим возможность газу расширяться в условиях, более близких к равновесию. Газ будет поднимать не только поршень, но и оставшиеся кубики. Следовательно, совершаемая работа будет больше. При бесконечно малых размерах кубиков процесс стал бы обратимым, и совершалась бы максимальная работа.
Добавим, что необратимый процесс оставляет изменения в окружающей среде, а обратимый не оставляет.
Первое начало термодинамики.
Теперь сформулируем первое начало термодинамики (Р. Майер, 1840 г.). Началом принято называть закон, выведенный из практики. Первое начало термодинамики является следствием закона сохранения энергии, который принимался как аксиома значительно раньше, по крайней мере, с XVIII в. Конкретизация его стала возможной в результате открытия эквивалентности теплоты и работы. Это было осуществлено немецким врачом и физиком Робертом Майером.
В любом процессе сумма теплоты и работы равна изменению запаса энергии системы. В аналитической форме запишем это положение так:
DU = Q – W (DU = Q + (– W)),
где DU – изменение внутренней энергии системы, Q – теплота процесса, W – работа процесса. Поскольку для теплоты и работы приняты противоположные знаки (см. схему выше), в уравнении записана не сумма, а разность теплоты и работы.
Теплота и работа зависят от условий проведения процесса. В процессе, проходящем при постоянном давлении, меняется объем (особенно значительно при участии газов), и становится неизбежной работа расширения (сжатия) W = pDV. Следовательно, работу процесса можно разделить на полезную работу W′ и работу расширения (сжатия) pDV:
W = W′ + pDV
Процесс может проходить без совершения полезной работы (без преодоления сопротивления). Тогда, при W′ = 0,
|
|
|
DU = Q – pDV,
или
DU + pDV = Q
Сумму слева в этом уравнении рассматривают в качестве изменения особой функции состояния – энтальпии системы Н:
H º U + pV;
DH º DU + pDV.
Итак, в изобарно-изотермическом процессе без совершения полезной работы (необратимом процессе)
DH = Q (встречается и более старое обозначение DH º QP)
Следовательно, энтальпия это функция состояния системы, изменение которой равно теплоте необратимого изобарно-изотермического процесса.
В необратимом изохорном процессе (DV = 0) нет не только полезной работы, но и работы расширения, и для него
DU = Q (DU º QV). QV + pDV = QP.
Следующая схема показывает теплоту и работу реакции
СаО(тв) + СО2(г) = СаСО3(тв)
при постоянном давлении. При постоянном объеме в этой реакции теплоты выделилось бы меньше, так как не была бы затрачена внешняя работа на сжатие системы.

Для сравнения теплот различных процессов (реакций) и для расчетов применяются стандартные значения термодинамических функций, обозначаемые (°)
Стандартная теплота реакции Dr Н °, – это теплота одного оборота реакции при определенных условиях. В таблицах обычно даются значения для Т = 298,15 К (25°С).
(Оборот реакции – превращение, в котором количества участвующих веществ численно равны стехиометрическим коэффициентам; удобное, но редко используемое понятие).
Теплота реакции зависит от состояния веществ, поэтому состояние требуется указывать для каждого вещества в скобках после формулы, например
СаО (кр) + СО2 (г) = СаСО3 (кр), Dr Н ° = = -177 кДж
Это так называемое термохимическое уравнение.
Теплоты реакций определяют экспериментально в особых приборах, называемых калориметрами. Особенно подходящими для такого экспериментального изучения являются реакции сгорания (вещество + кислород), а также многие реакции в растворах. Есть и такие реакции, теплоту которых экспериментально определить затруднительно или невозможно. Для таких реакций теплота получается расчетным путем на основе закона Гесса (1840 г, Петербург), являющегося следствием первого начала термодинамики.
Теплота химической реакции равна сумме теплот любого ряда последовательных реакций с теми же исходными веществами и конечными продуктами.
Закон строго выполняется при проведении реакции или при постоянном объеме, или при постоянном давлении.
Сущность закона Гесса состоит в том, что теплота реакции зависит только от начального и конечного состоянием системы, и не зависит от пути процесса. Невозможно изменить теплоту реакции (например, получить дополнительную теплоту) изменением промежуточных стадий реакции.

Перекись водорода невозможно получить непосредственно из простых веществ; поэтому нельзя определить и теплоту реакции образования Н2О2. Но определена теплота ее разложения, а также теплота образования воды. По закону Гесса рассчитывается теплота образования Н2О2.
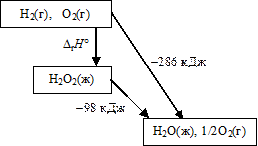
DrH° + (-98 кДж) = -286 кДж, DrH° = -188 кДж.
Этот же расчет можно провести в виде сложения (вычитания) уравнений реакций так, чтобы получить желаемое окончательное уравнение реакции:
 Н2 + ½О2 = Н2О; DrH° = -286 кДж
Н2 + ½О2 = Н2О; DrH° = -286 кДж
х (-1) Н2О2 = Н2О + ½О2; DrH° = -98 кДж)
 Н2 + О2 = Н2О2; DrH° = -188 кДж
Н2 + О2 = Н2О2; DrH° = -188 кДж
Теплота любой химической реакции может быть рассчитана на основе закона Гесса с применением табличных данных по стандартным теплотам образования и стандартным теплотам сгорания веществ, фигурирующих в уравнении реакции. (Показать в Практикуме таблицу на с. 221)
Стандартная теплота образования Df H °, кДж/моль, численно равна изменению энтальпии при образовании 1 моль сложного вещества из простых веществ. Дополнительные условия: состояние простых веществ.
Стандартная теплота сгорания Dс H °, кДж/моль, численно равна изменению энтальпии при сгорании 1 моль вещества в кислороде. Дополнительные условия: образование высших оксидов, кроме азота.
При наличии необходимых табличных данных, теплоты реакций вычисляется по формулам


Доказать эти уравнения можно на основе схем типа

Аналогично и для второго уравнения.

Пример. Рассчитайте стандартную теплоту реакции
2H2S(г) + 6NO(г) = 2H2O(ж) + 2SO2(г) + 3N2(г).
(записываем под формулами веществ значения Df H ° из таблицы)
| Df H °, кДж/моль | -20,5 | -286 | -297 |
Вычислим Dr H °:
Dr H ° = [2(-286) + 2(-297)] - [2(-20,5) + 6×90] = -1665 кДж/моль.
|
|
|


