 |
Физические и физико-химические свойства
|
|
|
|
Теория Брёнстеда
Согласно теории Брёнстеда, кислота — это соединение, способное отдавать основанию катионы водорода Н+ (является донором протонов). Основания — это соединения, способные принимать у кислоты катионы водорода Н+ (является акцептором протонов). Таким образом, в этой теории одно и то же вещество в зависимости от взаимодействия может быть и кислотой, и основанием. Например, вода при взаимодействии с протоном H2O + H+ = H3О+ является основанием, а реагируя с аммиаком NH3 + H2O = NH4+ + OH− — является кислотой.
АМФОЛИТЫ – ampholites – вещества, проявляющие в зависимости от условий основные или кислотные свойтва, т.е. им присущи амфотерные свойства. К таким веществам, в частности, относятся гуминовые вещества.
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
По определению Льюиса, кислота — это электролит (вещество, участвующее в реакциях с переходом электрона), принимающий электронную пару в реакции с основанием, то есть веществом, отдающим электронную пару (см. кислота Льюиса). В теории Бренстеда-Лоури, кислота — вещество, отдающее протон (основание — вещество, принимающее протон).
В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.
Основа́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
67.
|
|
|
Промышленное производство и применение
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых
катализаторах (метод Габера) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Физические и физико-химические свойства
Азот в азотной кислоте четырехвалентен, степень окисления +5. Азотная кислота - бесцветная, дымящая на воздухе жидкость, температура плавления -41oС, кипения +80oС с частичным разложением. Растворимость азотной кислоты в воде неограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют “дымящей азотной кислотой”, с массовой долей 0,6-0,7 - концентрированной азотной кислотой.
|
|
|
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
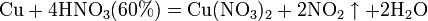
Разбавленная HNO3

б) с металлами, стоящими в ряду напряжений левее водорода:

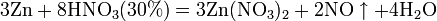


Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
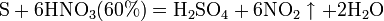


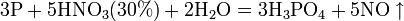
Нитраты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200—600°C), зачастую с разложением.
Нитраты щелочных металлов разлагаются до нитритов с выделением кислорода (а при длительном нагревании ступенчато разлагаются на оксид металла, молекулярные азот и кислород, ввиду чего являются хорошими окислителями).
Нитраты металлов средней активности разлагаются при нагревании до оксидов металлов с выделением диоксида азота и кислорода.
Нитраты самых малоактивных металлов (благородные металлы) разлагаются в основном до свободных металлов с выделением диоксида азота и кислорода
68.
Металлы платиновой группы (МПГ, Платиновая группа, Платиновые металлы, Платиноиды) — коллективное обозначение шести переходных металлических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. В связи с этим, имеют схожую историю открытия и изучения, добычу, производство и применение. Металлы платиновой группы являются благородными и драгоценными металлами.
Свойства платиновых металлов[1]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | p, г/см³ | tпл, °C | tкип, °C |
| Рутений Ru | [Kr]4d75s1 | 0, +2, +3, +4, +5, +6, +7, +8 | 12,5 | |||
| Родий Rh | [Kr]4d85s1 | 0, +1, +2, +3, +4, +6 | 12,4 | |||
| Палладий Pd | [Kr]4d10 | 0, +2, +3, +4 | 12,0 | |||
| Осмий Os | [Xe]4f145d66s2 | 0, +2, +3, +4, +5, +6, +8 | 22,6 | |||
| Иридий Ir | [Xe]4f145d76s2 | 0, +1, +2, +3, +4, +5, +6 | 22,7 | |||
| Платина Pt | [Xe]4f145d96s1 | 0, +1, +2, +3, +4, +5, +6 | 21,4 |
Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов:
|
|
|

При окислении металлов кислородом воздуха образуются оксиды различного состава:




При нагревании все платиновые металлы реагируют с хлором и фтором:


В растворах платиновые металлы существуют только в виде комплексных соединений. Соединения платины используют в медицине в качестве препаратов, обладающих противоопухолевой активностью[3].
69.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А + В ⇄ С + D
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
|
|
|
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (или исходных продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом:
N2 + 3H2 ↔ 2NH3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400°С:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
70.
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
сли нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды). В молекуле воды главное действующее лицо - атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
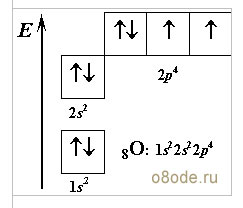
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):

Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)

Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород - кислород не прямой (90°), а немного больше - 104,5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода - положительный. Поэтому и вся молекула воды тоже попадает в отряд "химических полярников" - веществ, молекулы которых представляют собой электрические диполи.
|
|
|
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.

Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см. Г.Грей "Электроны и химическая связь",М., изд-во "Мир", 1967, с.155-62 и G.L.Miessier, D.A.Tarr, "Inorganic Chemistry", Prantice Hall Int.Inc., 1991, p.153-57).
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей. Взаимодействие (перекрывание) 1s- атомной орбитали водорода, 2s- и 2рz- атомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.

Рис. Перекрывание 2s- (а), 2px- (б) и 2pя- (в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Ассоциация (от лат. accosiare — соединять) — объединение простых молекул или ионов в более сложные, не вызывающие изменения химической природы вещества. Различают ассоциацию ионов и ассоциацию молекул. Образование ионных ассоциатов основано на проявлении электростатических сил. Простейшие ионные ассоциаты состоят из двух или трех ионов и представляют собой нейтральные или заряженные частицы:
Ассоциация молекул обусловливается действием межмолекулярных сил. Примером ассоциации молекул является вода (Н2О)x (см. Водородная связь). Ассоциация влияет на свойства растворов, играет важную роль в процессах образования комплексных соединений.

Диссоциация термическая – химическая реакция обратимого разложения вещества под влиянием нагревания.
Диссоциация электролитическая – полный или частичный распад на ионы молекул кислот, щелочей и солей при их растворении.
|
|
|


