 |
Математическая обработка результатов эксперимента
|
|
|
|
УСТАНОВЛЕНИЕ СОСТАВА ХИМИЧЕСКИХ СОЕДИНЕНИЙ
И ИХ ФОРМУЛ
Отчет к лабораторной работе №1
по дисциплине: «Общая и неорганическая химия»
Выполнил
студент гр.______
________/ __________
«___» ________201_ г.
Проверил доцент, к.х.н.
_______/____________
«___» ________201_ г.
 Северск – 201_
Северск – 201_
Цель работы -установить формулу кристаллогидратаор – это однородная система из двух или более компонентов, состав кото рой
Теоретическая часть
Законы постоянства состава и кратных отношений
Для установления формулы любого химического соединения необходимо знать его качественный и количественный состав. Формула химического соединения показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы.
Согласно закону постоянства состава: каждое чистое химическое соединение имеет постоянный качественный и количественный состав. Это обусловлено тем, что массовый состав молекул данного соединения постоянен и выражается определенным массовым соотношением элементов.
Массовые соотношения элементов в молекулах можно представить как отношение произведений соответствующих атомных масс на число атомов каждого из элементов в молекуле. Поэтому можно записать:
m1: m2: m3 = x Ar1: y Ar2: z Ar3,
где m1, m2, m3 – содержания элементов в данном соединении, г или % (доли);
x, y, z – число атомов соответствующих элементов в молекуле;
Ar1 , Ar2 , Ar3 – атомные массы элементов.
Из уравнения следует, что:
 . (1)
. (1)
Входящие в уравнение частные от деления процентного содержания (количества грамм) на атомную массу называются атомными факторами. Таким образом, отношение количеств атомов в молекуле равно отношению атомных факторов. Отсюда находят отношения между числами атомов в молекуле.
|
|
|
Уравнение (1) является математическим выражением закона кратных отношений: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
При этом для закона кратных отношений существует три исключения:
- закон справедлив для веществ, находящихся в парообразном или газообразном состояниях;
- закон не применим для соединений переменного состава (дальтонидов), например TiO1,2-2,0 или TiO1,46-1,56;
- закон не применим для высокомолекулярных соединений, например C20H42 или C21H44; числа весовых частей углерода, приходящихся в этих соединениях на одну весовую часть водорода относятся к друг другу как целые числа, но назвать эти числа небольшими нельзя.
Закон необходим для установления формул химических соединений (простейшей и истинной).
Простейшая формула показывает лишь соотношение атомов элементов, входящих в данное соединение, но не показывает истинного соотношения атомов в молекуле.
Для вывода простейшей формулы необходимо:
1) знать химический состав соединения;
2) атомные массы образующих данное вещество элементов (Ar).
Например, для химических соединений С2Н2, С4Н4, С6Н6 простейшая формула имеет вид (СН)n.
Истинная (молекулярная) формула показывает истинное число атомов в молекуле и для ее установления необходимо знать молекулярную массу этого вещества (Mr).
Молекулярную массу можно установить различными способами:
1) расчетным – по уравнению Менделеева-Клапейрона или исходя из относительной плотности по водороду или воздуху;
2) опытным путем – исходя из значений молекулярных масс простейшей и истинной формулы.
Экспериментальная часть
В качестве неизвестной соли будет использована соль в виде так называемого кристаллогидрата - химического соединения, содержащего в твердом состоянии кристаллизационную воду. Например,  – пентагидрат сульфата меди (II). Известно, что кристаллогидраты при нагревании теряют кристаллизационную воду, переходя в безводные соли, например
– пентагидрат сульфата меди (II). Известно, что кристаллогидраты при нагревании теряют кристаллизационную воду, переходя в безводные соли, например
|
|
|

| 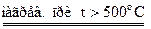
|  . .
|
Пользуясь этим, можно определить процентное содержание воды в кристаллогидрате, а отсюда, зная формулу безводной соли, рассчитать число молекул кристаллизационной воды, присоединяющихся к одной молекуле безводной соли.
Для работы берут кристаллогидрат одной из следующих солей: CuCl2; CuSO4; NiSO4; Na2CO3; CaCO3. Получив соль у преподавателя, и установив ее химический состав, приступают к определению количественного состава соли.
1) Для определения массового состава кристаллогидрата на предварительно выверенных технохимических весах взвешивают с точностью до 0,01 г тигель.
2) Затем, взяв его тигельными щипцами, ставят тигель на электрическую плитку для прокаливания. Через 10-15 мин тигель переносят в эксикатор.
Эксикатор служит для охлаждения предметов в атмосфере, лишенной влаги. В нижней части эксикатора находятся вещества, поглощающие влагу (конц. H2SO4; CaCl2; P2O5 и т.д.).
3) После первого взвешивания необходимо повторить прокаливание тигля в течение 3-5 мин (брать тигель только щипцами!) и после охлаждения тигля в эксикаторе снова его взвесить.
Если результаты первого и второго взвешиваний совпадают, считается, что тигель прокалён до «постоянной массы».
В случае расхождения данных первого и второго взвешивания прокаливание повторяют еще раз. Так поступают до тех пор, пока два раза не будет получен одинаковый результат. Описанный здесь прием – проведение обработки до постоянной массы, находит широкое применение в самых различных химических исследованиях.
4) Следующий этап работы заключается в том, что в прокаленный тигель аккуратно и осторожно (не просыпая мимо!) насыпают около 2,00 г кристаллогидрата (примерно).
5) Взвешивают на весах с точностью до 0,01 г и ставят тигель с исследуемым веществом для прокаливания сначала на край, а затем по мере прокаливания, передвигают на середину электрической плитки. По мере удаления влаги цвет кристаллогидрата будет изменяться. Изменение цвета необходимо отметить в рабочей тетради.
|
|
|
Прокаливание проводится до тех пор, пока цвет соли не станет однородным.
6) После этого тигель охлаждается в эксикаторе и взвешивается. Операцию прокаливания и взвешивания проводят до «постоянной массы» по методике, описанной выше. Результаты взвешивания записывают в таблицу 1.
Таблица 1 – Результаты экспериментальных данных
| № п/п | Масса, г | Цвет | ||||
| тигля | тигля с солью | соли в виде кристаллогидрата | безводной соли | воды | ||
| Первое взвешивание | 25,97 | 28,40 | 2,43 | – | – | зеленый |
| Второе взвешивание | 25,97 | 27,31 | – | 1,34 | 1,09 | коричневый, ближе к желтому |
| Третье взвешивание | – | 27,31 | – | 1,34 | 1,09 | светло-желтый |
По окончании опыта (достижения постоянной массы) проводят необходимые расчеты и находят формулу кристаллогидрата. Для установления формулы кристаллогидрата поступают следующим образом.
Пример. Требуется определить формулу кристаллогидрата сульфата никеля.
Решение. 1) Записываем формулу кристаллогидрата в следующем виде:
 .
.
2) Составляем уравнение:
 ,
,
где  – масса безводного сульфата никеля, г;
– масса безводного сульфата никеля, г;
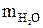 – масса испарившейся воды, г;
– масса испарившейся воды, г;
 – молекулярные массы соединений.
– молекулярные массы соединений.
3) В уравнение подставляем значения массы безводной соли и массы воды из таблицы 1 и рассчитываем значения x и y:


Для получения целых чисел делим оба значения на наименьшее, т.е. на 0,0087, и получаем

 .
.
4) Полученную формулу кристаллогидрата записываем в виде  .
.
Для расчета погрешности эксперимента полученное значение сравниваем с истинной формулой кристаллогидрата (даётся преподавателем) в соответствии с формулой
D =  ,
,
где  - количество молекул воды, полученное в результате расчетов;
- количество молекул воды, полученное в результате расчетов;
 - количество молекул воды в истинной формуле кристаллогидрата.
- количество молекул воды в истинной формуле кристаллогидрата.
Если истинная формула кристаллогидрата имеет формулу  , то погрешность составит
, то погрешность составит
 .
.
5) Процентное содержание влаги определяем, используя формулу
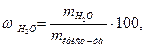
где 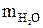 – масса испарившейся воды, г;
– масса испарившейся воды, г;
mкрист-та – масса кристаллогидрата, г.
В соответствии с данными, представленными в таблице 1, процентное содержание влаги составляет
|
|
|
 .
.
Безопасность труда
Во время выполнения работы необходимо соблюдать в лаборатории чистоту и тишину, работать только в халатах. Приступать к выполнению работы только после полного ознакомления с методикой ее выполнения и с разрешения преподавателя.
Рабочее место необходимо содержать в чистоте и порядке, не загромождать его ненужными для работ предметами.
При нагревании соли не наклонять над тиглем, беречь глаза.
Тигель снимать с электрической плиты и ставить его в эксикатор необходимо только специальными тигельными щипцами.
Соблюдать правила, изложенные в инструкции по технике безопасности.
Математическая обработка результатов эксперимента
Для установления формулы кристаллогидрата заполним таблицу 2 и рассчитаем соотношение x:y.
Таблица 2 – Результаты экспериментальных данных
| № п/п | Масса, г | Цвет | ||||
| тигля | тигля с солью | соли в виде кристаллогидрата | безводной соли | воды | ||
| Первое взвешивание | – | – | ||||
| Второе взвешивание | – | |||||
| Третье взвешивание | – | – |
Расчеты: 1) Записываем формулу кристаллогидрата в следующем виде:
 .
.
2) Составляем уравнение:
 ,
,
где  – масса безводной соли (по результатам третьего взвешивания), г;
– масса безводной соли (по результатам третьего взвешивания), г;
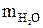 – масса испарившейся воды, г;
– масса испарившейся воды, г;
 – молекулярные массы безводной соли и воды.
– молекулярные массы безводной соли и воды.
3) В уравнение подставляем значения массы безводной соли и массы воды из таблицы 2 и рассчитываем значения x и y:


Для получения целых чисел делим оба значения на наименьшее и получаем
 .
.
4) Полученную формулу кристаллогидрата записываем в виде _____________.
Погрешность составит
 .
.
5) Процентное содержание влаги составляет
 .
.
|
|
|


