 |
АЕМ равна 1/12 массы атома углерода-12,
|
|
|
|
Основы радиационной безопасности
Учебно-методическое пособие
Минск-2012
Авторы: Антоненков А.И.,Батян О.Н.,Марцуль И.Н.,
Молош Т.В., Ермоленко Г.Л., Саевич К.Ф.,
Волосатова Н.Т.,Гапанович С.Е.,Кузнецова
Е.И., Тригубович О.В.
Рекомендовано кафедрой безопасности жизнедеятель-
ности и курортологии (протокол заседания кафедры
№ 7 от 12 марта 2012 г.)
Объём, уч.-изд.л – 2,4
Учебно-методическое пособие сдано в библиотеку
БГЭУ (научный читальный зал) 6 апреля 2012 г.
СОДЕРЖАНИЕ
Глава 1. Строение атома………………………4
Глава 2. Радиоактивный распад и радиоактивные превращения……………….….8
Глава 3. Взаимодействие радиоактивных излучения с веществом………………………...14
Глава 4. Единица измерения активности и доз радиоактивных излучений………………….....20
Глава 5. Естественные источники ионизирующих излучений…………………….25
Список литературы ………………………......39
Глава 1. Строение атома
Природа состоит из простых и сложных веществ. К простым веществам относятся химические ЭЛЕМЕНТЫ, к сложным – их химические соединения. Мельчайшей частицей элемента, обладающей его химическими свойствами, является АТОМ. Датский физик Нильс Бор в 1913 году предложил модель атома, за основу которой была принята планетарная модель Э.Резерфорда, согласно которой атом состоит из положительно заряженного, расположенного в центре ЯДРА, вокруг которого движутся по своим строго определенным орбитам отрицательно заряженные частицы – ЭЛЕКТРОНЫ (е), точно так же, как планеты вокруг Солнца. В свою очередь ядро состоит из положительно заряженных частиц – ПРОТОНОВ (p) и электрически нейтральных – НЕЙТРОНОВ (n). Протоны и нейтроны в ядре называют НУКЛОНАМИ.
|
|
|
Размеры ядра, протонов и электронов чрезвычайно малы по сравнению с размерами атома. Размер атома оценивается в 10-10 м, а его ядра – в 10-15 м. Если для примера увеличить радиус атома до радиуса Земного шара, то электроны можно представить в виде футбольных мячей на его поверхности, а диаметр ядра в этом случае будет всего лишь около 130 м. Таким образом, атом практически пуст и почти вся его масса сконцентрирована в ядре.
Массы нейтрона и протона приблизительно одинаковы. Масса же электрона приблизительно в 1836 раз меньше массы протона. Поэтому общее число протонов и нейтронов в ядре М характеризует массу атома элемента и его называют МАССОВЫМ ЧИСЛОМ. Массы атома, ядра и его составных частей измеряется в так называемых атомных единицах массы – АЕМ.
АЕМ равна 1/12 массы атома углерода-12,
что составляет 1,66·10-27 кг.
Электрон и протон обладают единичными электрическими зарядами разных знаков. Атом же электрически нейтрален, иначе говоря, число электронов на орбитах вокруг ядра равно числу протонов в ядре, и их суммарные заряды компенсируют друг друга. Заряд ядра или число протонов в нем определяют его АТОМНЫЙ НОМЕР или порядковый номер Z в таблице Менделеева.
По теории Н. Бора электроны в атоме сгруппированы по ЭЛЕКТРОННЫМ ОБОЛОЧКАМ, номера которых k возрастают по мере их удаления от ядра. Энергия электронов, расположенных на них, принимает дискретный ряд значений Е1, Е2,..., Еk. Таким образом электроны k -й оболочки характеризуются одинаковой энергией, которую называют ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ АТОМА. У атома бесконечное число электронных оболочек. Небольшая доля оболочек полностью или частично заполнена Z электронами, а на остальных оболочках электронов нет. На каждой k -й оболочке может быть не более 2k2 электронов. При таком расположении электронов обеспечивается длительное устойчивое состояние атома. Если на атом действуют внешние силы, то электрон, получив определенную порцию энергии, переходит на одну из свободных внешних оболочек, и атом возбуждается. Возбужденный атом неустойчив. Время его жизни в возбужденном состоянии примерно 10-8 с. Затем электрон переходит на более близкие к ядру оболочки, и атом возвращается в устойчивое состояние, испуская при этом энергию в виде фотонов электромагнитного излучения.
|
|
|
Аналогично атомным энергетическим уровням энергия атомного ядра также может принимать только дискретный ряд значений энергий. В основном, в устойчивом состоянии энергия ядра минимальна. При получении определенной порции энергии ядро переходит на один из своих возбужденных уровней. Затем в зависимости от полученной энергии ядро, стремясь к устойчивому состоянию, испускает один или несколько фотонов ядерного происхождения или распадается.
Условно каждый химический элемент (нуклид) записывается следующим образом:
 , где
, где
М – массовое число,
Z – заряд ядра или порядковый номер элемента.
Число нейтронов в ядре равно M-Z. Например, запись  означает, что в атоме урана 92 протона, 143 нейтрона в ядре, 92 электрона на орбитах вокруг ядра и в таблице Менделеева он находится под номером 92.
означает, что в атоме урана 92 протона, 143 нейтрона в ядре, 92 электрона на орбитах вокруг ядра и в таблице Менделеева он находится под номером 92.
Химические свойства элемента определяются общим числом электронов в атоме и числом электронов на его внешней орбите и не зависят от его массового числа. Вследствие этого атомы элемента с одинаковым Z и различными М имеют одинаковые химические свойства и их называют ИЗОТОПАМИ. Изотопы элемента различаются по числу нейтронов в ядре. Таким образом, все элементы представляют собой смесь изотопов. В состав природных элементов входит от одного до нескольких изотопов. Термин изотопы следует применять только в тех случаях, когда речь идет об атомах одного и того же элемента. Например, изотопы урана  ,
,  ,
,  , изотопы углерода
, изотопы углерода  и
и 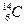 .
.
Когда речь идет об атомах различных элементов (включая изотопы), рекомендуется использовать термин нуклиды. НУКЛИДЫ – разновидности атомов с данным массовым числом и атомным номером. Например, смесь нуклидов  ,
,  ,
,  ,
,  ,
, 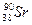 ,
,  .
.
Часто при наименовании нуклида значение атомного номера Z опускают. Тогда запись имеет вид 235U, 236U, 238U, 137Cs, 90Sr, 131I.
|
|
|
Если просуммировать массы протонов и нейтронов в атомном ядре (масса протона 1,007277 АЕМ, нейтрона – 1,086652 АЕМ), то обнаружится, что эта сумма больше массы ядра, в состав которого они входят. Данное явление получило название ДЕФЕКТА МАССЫ М. Дефект массы всех известных ядер – положительная величина. Дефект массы, переведенный в эквивалентную энергию, согласно знаменитому уравнению Эйнштейна:
Е = М*С2, где С – скорость света,
дает значение энергии, выделяемой при синтезе ядра данного нуклида из протонов и нейтронов. Такую же энергию необходимо затратить при расщеплении ядра на составляющие его нуклоны. Это определяет понятие энергии связи ядра.
ЭНЕРГИЯ СВЯЗИ (Ес) – это та энергия, которую необходимо затратить, чтобы разделить ядро на его составляющие нуклоны или та энергия, которая выделится при объединении протонов и нейтронов в ядро.
Энергия связи измеряется в электрон-вольтах (эВ). Один ЭЛЕКТРОН-ВОЛЬТ – это энергия, которую приобретает электрон, проходя разность потенциалов в один вольт. Так, например, электроны в кинескопе телевизора за счет напряжения по трубке 16000 вольт разгоняются, соответственно, до энергии в 16 кило-электрон-вольт (кэВ) или 0,016 мега-электрон-вольт (МэВ). Один электрон-вольт равен
1,6·10-19 джоулей.
Если дефект массы М выражен в атомных единицах массы, то
Ес = 931*М МэВ.
Величина энергии связи ядра зависит от его массового числа М и меняется от 2,224 миллиона электрон-вольт (МэВ) для дейтерия до сотен МэВ для тяжелых элементов таблицы Менделеева. Сами по себе значения Ес сравнительно невелики, но соотнесем их с энергией химических превращений. При сгорании килограмма самого высококалорийного топлива – водорода, выделяется 1,2·108 джоулей, что в переводе на один атом вещества составит всего лишь 12 эВ. Из сравнения рассмотренных величин видно, что ЯДЕРНЫЕ СИЛЫ, проявлением которых и является энергия связи, имеют иную природу нежели силы, определяющие химическое взаимодействие атомов. Ядерные силы в миллионы раз превышают силы химического взаимодействия атомов в молекуле, действуют на коротком расстоянии, не зависят от электрического заряда и определяют взаимодействие между нуклонами в ядре атома. Эти силы являются силами притяжения, компенсируют кулоновское отталкивание протонов в ядре и определяют стабильность или НЕСТАБИЛЬНОСТЬЯДЕР.
|
|
|
В зависимости от соотношения числа протонов и нейтронов в ядре могут преобладать те или иные силы. Для элементов, расположенных в начале и середине таблицы Менделеева, преобладают ядерные силы, что приводит к стабильности элементов, а чем ближе к ее концу, тем сильнее влияние сил кулоновского отталкивания и, начиная с 84 атомного номера, все элементы являются нестабильными. Причиной нестабильности может быть также и избыток в ядре нейтронов, что объясняет существование нестабильных изотопов.
Нестабильные изотопы наряду с тяжелыми элементами с атомным номером выше 83 составляют многочисленное семейство нестабильных ядер нуклидов, претерпевающих радиоактивный распад и объединяемых единым понятием РАДИОНУКЛИДЫ.
|
|
|


