 |
Решение задач по формулам. (I уровень)
|
|
|
|
Тема 1.1.3 Простейшие количественные отношения в химии. Расчеты по формулам и уравнениям.
Теория.
- Количество вещества. Постоянная Авогадро. Молярная масса.
- Закон Авогадро. Молярный объем. Относительная плотность газов.
- Основной закон стехиометрии. Расчеты по уравнениям.
Количество вещества - физическая величина, которая определяется числом структурных частиц (молекул, атомов и т.д.), содержащихся в данной порции вещества. Обозначается:  - «ню». Единица количества вещества - моль.
- «ню». Единица количества вещества - моль.
Один моль любого вещества содержит одно и то же число структурных частиц. Это число – величина постоянная и равно 6 . 1023. Это число названо в честь итальянского химика «постоянная Авогадро»



 Задача №1. Какое число молекул содержит аммиак (NH3) количеством вещества 3 моль?
Задача №1. Какое число молекул содержит аммиак (NH3) количеством вещества 3 моль?

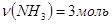
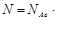

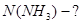

N= 6.1023 моль -1. 3 моль =18.1023 (молекул)
Ответ: 1,8 .1024 молекул.
Задача №2. Какое количество вещества составляет 3 . 1023 молекул кислорода (О2)?
 |




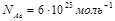
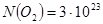

Ответ: 0,5 моль.
Т.к. масса частиц величина постоянная, то масса 1 моль любого вещества тоже величина постоянная и называется «молярная масса». Числовое значение молярной массы равно относительной молекулярной массе, но выражается в г/моль. Например: Мr (H2SO4)= 98; M (H2SO4)= 98 г/моль 
Задача №3. Вычислить количество вещества, которое соответствует 288 г фосфорной кислоты(H3PO4).




 M (H3PO4)=1 . 3+31+16 . 4=98 г/ моль
M (H3PO4)=1 . 3+31+16 . 4=98 г/ моль
𝛎 = 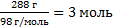
Ответ: 3 моль
Задача №4. Найти массу 3 моль оксида углерода (IV) CO2.
 |

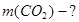

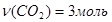

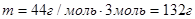
Ответ: 132 г
Но газы отличаются от других веществ тем, что расстояние между частицами в сотни раз превышают размеры самих частиц. Поэтому объем газов определяется не размерами частиц газа, а их количеством.
ЗАКОН АВОГАДРО: в равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул.
|
|
|
Но особое практическое значение имеют СЛЕДСТВИЯ ИЗ ЗАКОНА АВОГАДРО
1 следствие т.к. в 1 моль любого газа одинаковое число молекул => 1 моль любого газа при одинаковых условиях занимает одинаковый объем. При нормальных условиях – н.у. (0*С и 1 атм) 1 моль любого газа занимает объем 22,4 л, этот объем называют молярным и обозначают Vm т.е. Vm= 22,4 л/ моль.
Зная количество вещества (ν), легко найти V = ν ·Vm

 Задача №5 Найти объем углекислого газа количеством вещества 0,2 моль.
Задача №5 Найти объем углекислого газа количеством вещества 0,2 моль.
ν = 0,2 моль СО2 V = ν · Vm Vm = 22,4 л/моль
V = 0,2 моль·22,4 л/моль = 4,48 л
V -? Ответ: 4,48 л
Задача №6 Найти количество вещества, если сернистый газ занимает 5,6 л.
 V(SO2) = 5,6 ν =
V(SO2) = 5,6 ν = 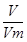 Vm = 22,4 л/моль
Vm = 22,4 л/моль
ν -? ν =  Ответ: 0,25 моль
Ответ: 0,25 моль
2 следствие из закона Авогадро: т.к. в одинаковых объемах газов одинаковое число молекул => то для 1 моля любого газа V1= V2= Vm, а масса m1= M1,a m2 = M2 (Mвозд.= 29) => относительная плотность газа определяется отношением масс молекул этих газов или их молярных масс, т.е. 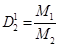
Например:
Задача №7 Найти относительную плотность кислорода по гелию

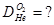
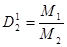
 =
= 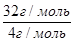 =8
=8
 М(О2)=32г/моль Ответ: т.е. кислород в 8 раз гелия
М(О2)=32г/моль Ответ: т.е. кислород в 8 раз гелия
М(Не)=4г/моль
Задача №8 Найти молекулярную массу природного газа, если его плотность по водороду равна 8.
 М(Х)=?
М(Х)=? 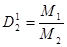 => M(Х) = D
=> M(Х) = D 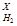 · M(H2)
· M(H2)
M(Х) = 2· 8 = 16 г/моль
D 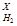 = 8
= 8 
M(H2) = 2 г/моль Ответ: природный газ метан М(СН4) = 16 г/мол
Решение задач по формулам. (I уровень)
№9. Какое число молекул содержит кислород (О2) количеством вещества 5 моль?
№10. Сколько атомов содержит медь (Cu) количеством вещества 4 моль?
№11. Какое количество вещества составляет 1,5·1023 молекул водорода (Н2)?
№12. Какое количество вещества составляет 18·1023 атомов железа(Fe)?
№13. Вычислить массу 0,5 моль сероводорода(H2S)?
№14. Вычислить массу 5 моль серной кислоты(H2SO4)?
№15. Какое количество вещества составляет 4,4 грамм углекислого газа(CO2)?
|
|
|
№16. Какое количество вещества составляет 1,6 грамм оксида железа (III) (Fe2O3)?
№17. Найти количество вещества, которое соответствует 306 г оксида алюминия(Al2O3).
№18. Найти массу 4 моль водорода (Н2).
№19. Найти число молекул кислорода (О2) В 0,1 моль.
№20. Найти количество вещества, если известно, что порция оксида кремния (SO2) содержит 9·1023 молекул.
№21 Найти объем 0,5 моль Н2(водорода)
№22 Найти количество вещества, если объем кислорода 22,4 л
№23 Найти относительную плотность кислорода по воздуху (средняя Мвозд.=29 г/моль)
№24 Найти молекулярную массу бурого газа, если его плотность по водороду равна 23.
№25 Найти объем 0,1 моль сернистого газа (SO2).
№26 Найти количество вещества, если объем угарного газа (CO) равен 5,6 л.
№27 Найти относительную плотность углекислого газа (CO2) по водороду
№28 Найти молекулярную массу ацетилена, если его плотность по водороду равна 13.
 Решение задач (II уровень)
Решение задач (II уровень)
№29. Сколько атомов содержится в 32 граммах меди?
 N (Cu)-?
N (Cu)-?
 N=NАв·ν NАв =6·1023 моль -1
N=NАв·ν NАв =6·1023 моль -1
m (Cu)=32г ν-? 
M (Cu)= 64 г/моль ν = 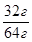 = 0,5 моль
= 0,5 моль
N (Cu) = 6· 1023 моль -1·0,5 моль = 3· 1023 (атомов)
Ответ: 3· 1023 атомов
 №30. Найти массу 9· 1023 молекул воды.
№30. Найти массу 9· 1023 молекул воды.
m (H2O)-?  M (H2O)= 1·2 + 16 = 18 г/моль
M (H2O)= 1·2 + 16 = 18 г/моль

N (Н2О) = 9· 1023 молекул ν-? 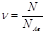 NAb = 6· 1023 моль-1
NAb = 6· 1023 моль-1
ν (H2O) = 
m = 18 г/ моль · 1,5 моль = 27 г Ответ: 27 г
Решите задачи самостоятельно, пользуясь образцами.
№31. Сколько атомов в 80 г кальция (Са)?
№32. Сколько молекул в 17 г сероводорода (H2S)?
№33. Найти массу 12·1023 атомов серы (S).
№34. Найти массу 3·1023 молекул серной кислоты(H2SO4).
№35 Рассчитайте массу 156,8 л метана (CH4).
№36 Найти массу 179,2 л водорода (H2).
№37 Найти объем 38,4 г кислорода (O2).
№38 Найти объем 320 г сернистого газа (SO2)
№39 Сколько молекул содержится в 5,6 л водорода (H2)?
№40 Какой объем занимает 9· 1023 молекул кислорода?
№41*. В какой массе воды содержится столько же молекул, сколько атомов содержится в 36 г магния (Mg)?
№42*. Сколько атомов азота содержится в 280 г молекулярного азота (N2)?
№43*. Сколько г кислорода (O2) надо взять, чтобы там содержалось столько же молекул, сколько их в 10 г водорода (Н2)?
№44*. Сколько молекул воды (Н2О) надо взять, чтобы там содержалось столько же атомов кислорода, сколько их содержится в 8 г О2?
№45* Где больше молекул: в 2 л кислорода или в 3 л водорода (H2)?
№48* Какой объём займёт при испарении (н.у.) 80 т жидкого кислорода?
|
|
|
№49* Что легче: аммиак (NH3) или азот (N2)?
№50* Может ли существовать соединение серы, пары которого легче воздуха?
|
|
|


