 |
Спазм поврежденных сосудов.
|
|
|
|
2. Адгезия (adhaesio, лат. – прилипание) тромбоцитов к месту травмы. Связана с изменением отрицательного заряда сосудистой стенки в этом участке на положительный. Это вызывает приклеивание тромбоцитов, на поверхности которых имеется отрицательный заряд, к обнажившимся волокнам коллагена базальной мембраны. Адгезии способствуют фибриноген плазмы и тромбоцитов и фактор Виллебранда (см. ниже VIII-фВ плазменный фактор). Последний содержит 3 активных центра, 2 из которых связываются с тромбоцитами, а 1 – д с субэндотелием и коллагеновыми волокнами. В результате тромбоциты оказываются подвешенными к месту ранения. При этом они выпячивают до 10 ложноножек, проницаемость их мембраны увеличивается и из них выделяются вещества, способствующие сужению сосудов и вызывающие скучивание тромбоцитов – следующий этап первичного гемостаза. Адгезия тромбоцитов завершается за 3-10 сек.
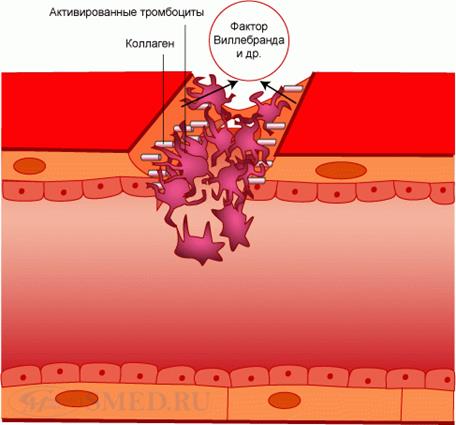
Адгезия
3. Обратимая агрегация (aggregatio, лат. – присоединение) тромбоцитов. Начинается почти одновременно с их адгезией. Осуществляется с участием фибриногена и фактора Виллебранда, которые образуют мостики между тромбоцитами. Важное значение для агрегации, как и для адгезии, имеют интегрины – комплексы белков и полипептидов, которые обеспечивают связь тромбоцитов друг с другом и с сосудистой стенкой. Тромбоциты соединяются своими центральными частями (хромомерами) и образуют «розетки». В результате формируется рыхлая пробка, проницаемая для плазмы крови. Ингибируют агрегацию тромбоцитов простагландин I2 (PgI2), или простациклин, вырабатываемый сосудистой стенкой, и гепарин. Первоначальная (первичная) агрегация имеет обратимый характер, т.е. при недостатке агрегирующих факторов происходит распад агрегатов тромбоцитов – дезагрегация.
|
|
|
4. Необратимая агрегация тромбоцитов. Происходит под влиянием АДФ, главным образом «внешнего», выделяющегося из поврежденной стенки сосуда, и «внутреннего», освобождающегося из тромбоцитов и эритроцитов, а также под воздействием других клеточных факторов – адреналина, норадреналина, тромбоксана А2. Необратимая (вторичная) агрегация резко усиливается тромбином, образующимся в процессе коагуляционного гомеостаза через 5-10 сек после повреждения сосуда. Тромбин разрушает мембрану тромбоцитов и поэтому вызывает нарушение их структуры – «вязкий метаморфоз». Процесс завершается слиянием тромбоцитов в гомогенную массу. Это приводит к высвобождению из них новых количеств факторов свертывания, среди которых имеются те, которые участвуют во вторичном гемостазе. Так, тромбоцитарный тромбопластин инициирует образование тромбоцитарной протромбиназы, обеспечивающей гемокоагуляцию. В результате на агрегатах тромбоцитов образуются нити фибрина, в сети которых задерживаются отдельные эритроциты и лейкоциты. Сформировавшийся белый тромб непроницаем для плазмы крови.
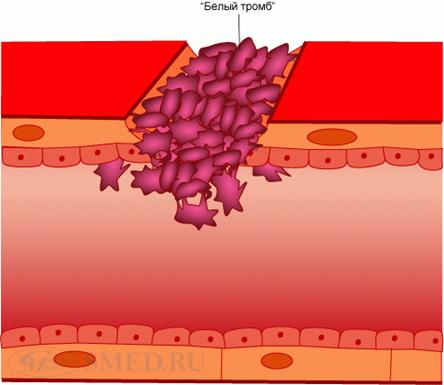
Агрегация
5. Ретракция тромбоцитарного тромба – процесс его уплотнения. Обеспечивается тромбостенином. В результате происходит закрепление тромба в месте повреждения сосуда.
Таким образом, в ходе первичного гемостаза тромбоциты образуют, по меткому выражению французского гематолога Жоржа Гайема, «гемостатический гвоздь» – провизорный тромб. Эта «заплата» является основой для формирования более прочного фибринового тромба на II стадии гемостаза.
МОДЕЛЬ КОАГУЛЯЦИОННОГО КАСКАДА (ВОДОПАДА)
Механизмы инициации свёртывания крови подразделяют на внешние и внутренние. Такое деление искусственно, поскольку оно не имеет места in vivo, но данный подход облегчает интерпретацию лабораторных тестов in vitro.
|
|
|
Большинство факторов свёртывания циркулируют в крови в неактивной форме. Появление стимулятора коагуляции (триггера) приводит к запуску каскада реакций, завершающихся образованием фибрина (рис. 10). Триггер может быть эндогенным (внутри сосуда) или экзогенным (поступающим из тканей). Внутренний путь активации свёртывания крови определяется как коагуляция, инициируемая компонентами, полностью находящимися в пределах сосудистой системы. Когда процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, говорят о внешней системе свёртывания крови. В результате запуска реакций системы гемостаза независимо от источника активации образуется фактор Xa, обеспечивающий превращение протромбина в тромбин, а последний катализирует образование фибрина из фибриногена. Таким образом, и внешний и внутренний пути замыкаются на единый – общий путь свёртывания крови.
ВНЕШНИЙ ПУТЬ АКТИВАЦИИ СВЁРТЫВАНИЯ КРОВИ
Основным путём активации свёртывания крови in vivo считается внешний путь (рис. 10 п. 1). Толчком для образования тканевой протромбиназы служит повреждение стенок сосудов с выделением из них в кровь тканевого тромбопластина (фосфолипиды) – это комплекс состоящий из III, IV,VIIa факторов.
Компоненты этого пути следующие: тканевой фактор (ТФ, фактор III, тканевая тромбокиназа, тканевой тромбопластин), его ингибитор (ингибитор пути тканевого фактора, ИПТФ) и плазменный фактор VII. Тканевой фактор представляет собой внутренний мембранный гликопротеин (масса 47 кДа), имеющийся во многих клетках; он не поступает в кровь до тех пор, пока не образуются протеазы или не произойдёт повреждение клеток in vivo. Тканевой фактор функционирует в качестве кофактора/рецептора, который в присутствии ионов кальция активирует фактор VII. Активация фактор VII приводит к открытию (обнажению) его активного серинового центра. Активация фактора VII может также происходить за счёт незначительного протеолитического действия других сериновых протеаз (тромбина, ФXIIa, ФIXa, и ФXa), а также за счёт самоактивации, однако самоактивация in vivo идёт незначительно. Комплекс ТФ/ФVIIa/Ca 2+ действует на два субстрата: фактор X (запуск общего пути) и ФIX (фактор внутреннего пути).
ВНУТРЕННИЙ ПУТЬ АКТИВАЦИИ СВЁРТЫВАНИЯ КРОВИ
|
|
|


