 |
Электрохимическая коррозия
|
|
|
|
Работа № 15
КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется самопроизвольный процесс разрушения металлов в результате их взаимодействия с окислителями из окружающей среды. Выплавка металлов из руд требует затраты энергии. При коррозии происходит самопроизвольное высвобождение из металлов накопленной свободной энергии Гиббса. Это делает металлы химически активными веществами:
Меn+ + ne- → Me (∆G > 0) Me0 – ne- → Меn+ (∆G < 0)
металлургия коррозия
Коррозия металлов есть необратимый процесс и приводит к большим прямым и косвенным потерям.
Следует отметить, что коррозии не подвержены такие металлы, как золото, серебро, платина, ртуть, так как эти металлы в природе находятся в свободном состоянии и не требуют энергетических затрат на их получение.
По механизму различают два типа коррозионных процессов: химическую и электрохимическую коррозию.
Химическая коррозия
Основным признаком этой коррозии является отсутствие в коррозионной среде конденсационной влаги. Поэтому этот тип коррозии нередко называют коррозией сухими газами или термической коррозией. При химической коррозии протекает химическая окислительно - восстановительная реакция между металлом и окислителем (коррозионным агентом) из внешней среды. При этой реакции поверхность металла окисляется, а коррозионный агент – восстанавливается.
Химической коррозии подвержены детали и узлы машин, работающих при высокой температуре – поршневые двигатели, камеры внутреннего сгорания топлива, химические реакторы и т.д.
При химической коррозии металлов происходит изменение состава поверхности металла. Рассмотрим это на примерах коррозии металла газами.
|
|
|
Химическая коррозия стали в среде воздуха или кислорода
В большинстве случаев активным коррозионным агентом является кислород:
Fe+ O2 ® FeO + Fe2O3 + Fe3O4
Химическая коррозия под действием сухого хлора
2Fe + 3Cl2 ® 2FeCl3
Химическую коррозию можно наблюдать при контакте металла с неводными средами, например, при контакте нефти или ее продуктов с поверхностью стальных цистерн. В составе нефти находятся органические соединения, особенно опасны соединения, содержащие хлорид-ионы и серу, они образуют легко растворимые хлориды и сульфиды металлов.
Химическая коррозия стали в неводных средах:
2R- Cl + Me → MeCl2 + R-R
R1-S-R2+ Me →MeS + R1-R2
Разрыв ковалентных связей, способствующий переходу хлорида и сульфида в ионное состояние, совершается легче при повышенных температурах.
Электрохимическая коррозия
При наличии в коррозионной среде конденсационной влаги коррозия идет по электрохимическому механизму. Этот вид коррозии самый распространенный.
Причиной протекания электрохимической коррозии является неоднородность металла из-за наличия в нем различных примесей. В результате на поверхности возникают участки, имеющие разный потенциал и образующие микрогальванические элементы. Роль анода в таком элементе выполняет металл, который окисляется, а роль катода – присутствующие в металле примеси других металлов или их соединений, а также загрязнения.
На аноде осуществляется окисление металла по реакции Me – ne- → Men+, образующиеся электроны по металлу переходят на катодный участок, где связываются окислителем из окружающей среды. В качестве окислителя выступает кислород воздуха в присутствии влаги либо ионы водорода (Н+).
На катоде могут протекать следующие процессы:
1) Если окислителем является кислород:
О2 + 2Н2О + 4е- → 4ОН- в нейтральной и щелочной среде
О2 + 4Н+ + 4е- → 2Н2О в кислой среде
Такая коррозия называется коррозией с кислородной деполяризацией.
|
|
|
2) Если в среде отсутствует кислород, то в качестве окислителя выступают ионы водорода (Н+) в кислой, нейтральной или щелочной средах:
2Н+ + 2е- → Н2 в кислой среде
2Н2О + 2е- → Н2 + 2ОН- в нейтральной и щелочной средах
Атмосферная коррозия углеродистой стали
Рассмотрим коррозию углеродистой стали с кислородной и водородной деполяризацией.
В углеродистой стали присутствует в качестве примеси карбид железа (Fe3C). Возникают микроконтакты Fe (анод) - Fe3C (катод).
На аноде: Fe – 2e- → Fe2+
На катоде: О2 + 2Н2О + 4е- →4ОН- (в присутствии кислорода воздуха в нейтральной среде)
Суммарное уравнение коррозии имеет вид:
Fe + О2 + 2Н2О →2Fe(ОН)2
Это уравнение первичного процесса. Образующийся гидроксид железа (II) на воздухе окисляется до Fe(OH)3 – вторичный процесс, в результате которого образуется бурая ржавчина.
2Fe(ОН)2 + 1/2О2 + Н2О →2Fe(ОН)3
Fe(OH)3 → FeOOH +H2O
ржавчина
Коррозионный процесс углеродистой стали в кислой среде в отсутствие кислорода выглядит так:
На аноде: Fe – 2e- → Fe2+
На катоде: 2Н+ + 2е- → Н2
Суммарное уравнение коррозии:
Fe + 2HCl → Н2 + FeCl2
Атмосферная коррозия на границе контакта двух разных металлов.
Рассмотрим коррозию железа в контакте с оловом.
При контакте двух металлов в среде электролита возникает макрогальванический элемент, в котором роль анода будет играть металл более активный, с меньшим значением потенциала, т.е. железо (φFe2+/Fe = -0,44 В), а катодом будет олово, имеющее больший потенциал (φSn2+/Sn = -0,136 В). Электродные процессы в этом случае описываются уравнениями:
На аноде: Fe – 2e- → Fe2+
На катоде: (Sn) О2 + 2Н2О + 4е- → 4ОН-
Fe2+ + 2ОН- → Fe(ОН)2
Коррозия при неравномерной аэрации
Схема коррозии стали при неравномерном поступлении окислителя к поверхности металла показана на рис.
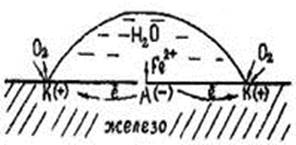
Рис. Коррозия при неравномерной аэрации
При попадании капли воды на поверхность металла на ней образуются катодные и анодные участки ввиду неодинакового поступления окислителя, в данном случае кислорода. В точках «К» кислород поступает в максимально возможном количестве и здесь будет идти катодный процесс:
О2 + 2Н2О + 4е- → 4ОН-
На участок «А» поверхности металла количество кислорода ограниченно из-за высоты слоя капли. Поэтому потенциал этого участка меньший (относительно катодного) и будет представлять анодную зону, на которой идет процесс окисления металла:
|
|
|
Fe – 2e- → Fe2+
Термодинамика коррозии
Возможность коррозии конкретного металла данным окислителем возможна при положительном значении ЭДС:
Е = φокис-ля – φвосст-ля > 0
Для определения возможности протекания коррозии необходимо знать потенциалы катодных процессов в различных средах. Данные приведены в таблице.
Таблица. Значения потенциалов окислителей при кислородной и водородной деполяризации в различных средах
| Катодная реакция | рН | j, В | |
| Водородная деполяризация | 2Н+ + 2е– → Н2 | ||
| 2H2O + 2e– → H2 + 2OH– | –0,413 | ||
| 2H2O + 2e– → H2 + 2OH– | –0,826 | ||
| Кислородная деполяризация | O2 + 4e– + 4H+ → 2H2O | 1,23 | |
| O2 + 4e– + 2H2O → 4OH– | 0,82 | ||
| O2 + 4e– + 2H2O → 4OH– | 0,40 |
Чтобы определить, возможна ли коррозия в данных условиях из потенциала окислителя вычитаем потенциал металла. Если ЭДС > 0, коррозия идет. Например, свинец (j° Pb2+/Pb = - 0,126 В) будет подвергаться коррозии под действием кислорода (в кислой, нейтральной и щелочной средах), под действием кислот в отсутствие кислорода и будет устойчив к коррозии во воде и растворе щелочи.
|
|
|


