 |
Зависимость скорости реакции от концентрации реагирующих веществ
|
|
|
|
Работа № 7
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Скорость химической реакции показывает изменение количества одного из веществ в реакции в единицу времени.
При расчете скорости реакции необходимо учитывать условия ее протекания, а именно, идет ли реакция в объеме реакционной системы, как в случае гомогенных реакций или на границе раздела фаз, в случае гетерогенных реакций. Напомним:
Гомогенные реакции – реакции между веществами, находящимися в одинаковых фазовых состояниях, за исключением твердых.
Например: N2(г) + 3H2(г) = 2NH3
BaCl2(ж) + Na2SO4(ж)= BaSO4↓ + 2NaCl
Гетерогенные реакции – реакции между веществами, находящимися в разных агрегатных состояниях.
Например: Zn(т)+ H2SO4(ж) = ZnSO4 + H2↑
Расчет скорости для этих типов реакций осуществляют по формулам:
для гомогенной реакции:
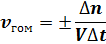
или
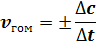
для гетерогенной реакции:
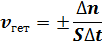
в этих формулах: Δn – изменение количества одного из веществ в реакции, моль;
∆ t – промежуток времени реакции, с;
∆c = ∆n/V – изменение концентрации реагирующего вещества, моль/л;
V – объем реакционной системы, л либо м3;
S – поверхность соприкосновения фаз, м2.
Знак «–» в формулах используется в случае, если расчет ведут по концентрациям исходных веществ, которые уменьшаются в ходе реакции, а знак «+» в случае, если рассматриваются концентрации продуктов реакции, которые увеличиваются в ходе реакции (скорость реакции всегда положительна).
В системе СИ единицами измерения скорости реакции являются: моль·м-3·с-1 или моль·л-1·с-1 (для гомогенных реакций) и моль·м-2·с-1 (для гетерогенных реакций).
Химические реакции бывают простые и сложные.
Простая реакция – реакция, протекающая в одну стадию, элементарный акт взаимодействия частиц. В элементарной реакции может участвовать либо одна частица (реакция распада), либо две, либо (очень редко) три частицы. Т.е. в простой реакции одновременно могут участвовать не более трех частиц.
|
|
|
Число частиц, участвующих в элементарном акте реакции, называется молекулярностью. Реакции бывают мономолекулярными, бимолекулярными и тримолекулярными.
Примеры простых реакций:
J2 ® 2J мономолекулярная
2СН3· ® С2Н6 бимолекулярная
2NO + O2 ® 2NO2 тримолекулярная
Сложная реакция включает в себя несколько различных стадий, приводящих к конечным продуктам. Сложные реакции бывают параллельными (одновременно идет несколько реакций) или последовательными (через образование промежуточных продуктов).
Простые реакции встречаются достаточно редко. Чаще реакции бывают сложными, и символизирующие их уравнения отражают лишь конечный итог химических превращений.
Скорость химических реакций зависит от:
· природы реагирующих веществ
· концентрации реагирующих веществ
· давления (в газовых реакциях)
· температуры
· катализатора
· от среды (для реакций в растворе)
· от площади поверхности соприкосновения (для гетерогенных реакций)
Зависимость скорости реакции от концентрации реагирующих веществ
В 1867 г. К. Гульдбергом и П. Вааге был сформулирован закон действующих масс (ЗДМ):
Скорость простой химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам (коэффициентам в уравнении реакции).
Для реакции аА + bB ® cC + dD,
протекающей в одну стадию, математическое выражение ЗДМ примет вид:
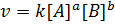
здесь k – константа скорости реакции;
[А], [B] – концентрации реагирующих веществ;
а, b – коэффициенты в уравнении реакции.
Константа скорости k зависит от температуры и природы реагирующих веществ. Физический смысл константы скорости: она равна скорости реакции, если концентрации реагирующих веществ – 1 моль/л.
|
|
|
В том случае, когда одно из реагирующих веществ находится в твердом агрегатном состоянии (т.е. реакция гетерогенная), концентрация этого твердого вещества не учитывается в уравнении ЗДМ.
Закон действующих масс для:
гомогенной реакции:
2NO(г) + O2(г) ® 2NO2(г)

| гетерогенной реакции:
C(тв) + O2(г) ® CO2(г)

|
Подчеркнем, что ЗДМ выполняется только для простых реакций. Для сложных реакций зависимость скорости от концентрации реагирующих веществ приобретает вид:
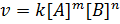
где числа m, n – так называемые порядки реакции по веществу А и В. Порядок реакции определяют экспериментальным путем.
|
|
|
12 |


