 |
Кафедра общей и биоорганической химии - теоретическая
|
|
|
|
Реферат на тему:
«Марганец и хром. Биологическая роль, нормы потребления. Пищевые источники микроэлементов»
Содержание
Глава 1. Общая характеристика марганца и хрома
История открытия марганца, общие сведения
Получение марганца
Химические свойства марганца и его соединений
История открытия хрома, общие сведения
Получение хрома
Химические свойства хрома и его соединений
Глава 2. Биологическая роль марганца и хрома
Глава 3. Нормы потребления марганца и хрома
Нормы потребления марганца, недостаток и переизбыток микроэлемента
Нормы потребления хрома, недостаток и переизбыток микроэлемента
Глава 4. Пищевые источники микроэлементов
Пищевые источники марганца
Пищевые источники хрома
Список литературы
Глава 1. Общая характеристика марганца и хрома
История открытия марганца, общие сведения
Один из основных минералов марганца - пиролюзит <https://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%80%D0%BE%D0%BB%D1%8E%D0%B7%D0%B8%D1%82> - был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка <https://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B5%D1%82%D0%B8%D1%82>, а тот факт, что он не притягивается магнитом <https://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B8%D1%82>, Плиний Старший <https://ru.wikipedia.org/wiki/%D0%9F%D0%BB%D0%B8%D0%BD%D0%B8%D0%B9_%D0%A1%D1%82%D0%B0%D1%80%D1%88%D0%B8%D0%B9> объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле <https://ru.wikipedia.org/wiki/%D0%A8%D0%B5%D0%B5%D0%BB%D0%B5,_%D0%9A%D0%B0%D1%80%D0%BB_%D0%92%D0%B8%D0%BB%D1%8C%D0%B3%D0%B5%D0%BB%D1%8C%D0%BC> показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану <https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BD,_%D0%AE%D1%85%D0%B0%D0%BD_%D0%93%D0%BE%D1%82%D0%BB%D0%B8%D0%B1>, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz - марганцевая руда).
|
|
|
Ма́рганец - элемент <https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> побочной подгруппы седьмой группы четвёртого периодапериодической системы химических элементов <https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> Д. И. Менделеева <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87> с атомным номером <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 25. Обозначается символом Mn (лат. <https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 - калий марганец о четыре). Простое вещество <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE>марганец - металл <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> серебристо-белого цвета <https://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82>. Наряду с железом <https://ru.wikipedia.org/wiki/%D0%96%D0%B5%D0%BB%D0%B5%D0%B7%D0%BE> и его сплавами относится к чёрным металлам <https://ru.wikipedia.org/wiki/%D0%A7%D1%91%D1%80%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>. Известны пять аллотропных модификаций марганца - четыре с кубической и одна с тетрагональной кристаллической решёткой.Конфигурация валентных электронов Mn 4s23d54p0. Для марганца характерны степени окисления: +2 (например, MnO, Mn(OH)2), +3, +4(MnO2, Mn(OH)4, H4MnO4, H2MnO3), +6 (MnO3, H2MnO4, K2MnO4), +7 (Mn2O7, HMnO4, KMnO4).
1.2 Получение марганца
· Алюминотермическим <https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%BE%D1%82%D0%B5%D1%80%D0%BC%D0%B8%D1%8F> методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
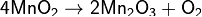

· Восстановлением железосодержащих оксидных руд марганца коксом <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D1%83%D0%B3%D0%BE%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%BA%D0%BE%D0%BA%D1%81>. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn).
|
|
|
· Чистый металлический марганец получают электролизом.
1.3 Химические свойства марганца и его соединений
Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2). Марганец при нагревании разлагает воду, вытесняя водород <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4> (Mn + 2H2O →(t) Mn(OH)2 + H2↑), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом <https://ru.wikipedia.org/wiki/%D0%90%D0%B7%D0%BE%D1%82>, образуя различные по составу нитриды <https://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D1%82%D1%80%D0%B8%D0%B4%D1%8B>.
Углерод <https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4> реагирует с расплавленным марганцем, образуя карбиды <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%B8%D0%B4%D1%8B> Mn3C и другие. Образует также силициды <https://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%BB%D0%B8%D1%86%D0%B8%D0%B4%D1%8B>, бориды <https://ru.wikipedia.org/wiki/%D0%91%D0%BE%D1%80%D0%B8%D0%B4%D1%8B>, фосфиды <https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%B8%D0%B4%D1%8B>.соляной <https://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D1%8F%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0> и серной <https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0> кислотами реагирует по уравнению:

С концентрированной серной кислотой реакция идёт по уравнению:

С разбавленной азотной кислотой <https://ru.wikipedia.org/wiki/%D0%90%D0%B7%D0%BE%D1%82%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0> реакция идёт по уравнению:

В щелочном растворе марганец устойчив.
Устойчивые степени окисления марганца +2, +4, +7 в соединениях кислородного и солевого характера. В медицинской практике используются соединения марганца (II) и марганца (VII).
Марганец (II) оксид MnOвстречается в природе в виде мелких зеленых кристаллов, плохо растворимых в воде. При нагревании на воздухе превращается в оксид:
MnO +3O2→6MnO2
Марганец (II) оксид растворяется в кислотах:
+ 2H+ + 5H2O→[Mn(H2O)6]2+
Марганец (II) гидроксид обладает слабоосновными свойствами, окисляется кислородом воздуха и другими окислителями до марганцеватистой кислоты или ее солей манганитов:
|
|
|
(OH)2 + H2O2→H2MnO3↓ + H2O
В щелочной среде Mn2+ окисляется до MnO42-, а в кислой до МnO4-:
+ 2KNO3 + 4KOH→K2MnO4 + 2KNO2 + K2SO4 + 2H2O
Образуются соли марганцовистой H2MnO4 и марганцовой HMnO4 кислот.
Марганец (IV) оксид MnO2 является устойчивым природным соединением марганца, которое встречается в четырех модификациях. Все модификации имеют амфотерный характер и обладают окислительно-восстановительной двойственностью.
Соединения Mn(VI) - неустойчивы. В растворах могут превращаться в соединения Mn(II), Mn(IV), Mn(VII): оксид марганца (VI) MnO3 - темно-красная масса, вызывающая кашель. Гидратная форма MnO3 - слабая марганцовистая кислота H2MnO4, которая существует только в водном растворе. Ее соли (манганаты) легко разрушаются в результате гидролиза и при нагревании. При 50̊ С MnO3 разлагается:
MnO3→2MnO2 +O2
и гидролизуется при растворении в воде:
MnO3 + H2O→ MnO2 +2HMnO4
Производные Mn(VII) - это марганец (VII) оксид Mn2O7 и его гидратная форма кислота HMnO4, известная только в растворе. Mn2O7 устойчив до 10̊ С, разлагается со взрывом:
2O7 → 2 MnO2 +O3
При растворении в холодной воде образуется кислота:
2O7 + H2O →2HMnO4
История открытия хрома, общие сведения
В 1766 году <https://ru.wikipedia.org/wiki/1766_%D0%B3%D0%BE%D0%B4> в окрестностях Екатеринбурга <https://ru.wikipedia.org/wiki/%D0%95%D0%BA%D0%B0%D1%82%D0%B5%D1%80%D0%B8%D0%BD%D0%B1%D1%83%D1%80%D0%B3> был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название - крокоит <https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%BE%D0%BA%D0%BE%D0%B8%D1%82>. В 1797 <https://ru.wikipedia.org/wiki/1797> французский химик Л. Н. Воклен <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%BA%D0%BB%D0%B5%D0%BD,_%D0%9B%D1%83%D0%B8_%D0%9D%D0%B8%D0%BA%D0%BE%D0%BB%D0%B0> выделил из него новый тугоплавкий металл <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> (скорее всего Воклен получил карбид хрома <https://ru.wikipedia.org/w/index.php?title=%D0%9A%D0%B0%D1%80%D0%B1%D0%B8%D0%B4_%D1%85%D1%80%D0%BE%D0%BC%D0%B0&action=edit&redlink=1>).
Название элемент <https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)> получил от греч. <https://ru.wikipedia.org/wiki/%D0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> χρῶμα - цвет <https://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82>, краска - из-за разнообразия окраски своих соединений.
|
|
|
Хром - элемент <https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов <https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> Д. И. Менделеева <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87> с атомным номером <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 24. Обозначается символом Cr(лат. <https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Chromium). Простое вещество <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> хром - твёрдый металл <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> голубовато-белого цвета <https://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82>. Хром иногда относят к чёрным металлам <https://ru.wikipedia.org/wiki/%D0%A7%D1%91%D1%80%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>. Конфигурация валентных электронов Cr 4s13d54p0. Для хрома характерны степени окисления: +2 (CrO, Cr(OH)2- основные, восстановительные свойства), +3 (Cr2O3, Cr(OH)3 - амфотерные свойства), +6.
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома - хромистый железняк (хромит <https://ru.wikipedia.org/wiki/%D0%A5%D1%80%D0%BE%D0%BC%D0%B8%D1%82>) FeO·Cr2O3. Вторым по значимости минералом является крокоит <https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%BE%D0%BA%D0%BE%D0%B8%D1%82>PbCrO4.
Самые большие месторождения хрома находятся в ЮАР <https://ru.wikipedia.org/wiki/%D0%AE%D0%90%D0%A0> (1 место в мире), Казахстане <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%B7%D0%B0%D1%85%D1%81%D1%82%D0%B0%D0%BD>, России <https://ru.wikipedia.org/wiki/%D0%A0%D0%BE%D1%81%D1%81%D0%B8%D1%8F>, Зимбабве <https://ru.wikipedia.org/wiki/%D0%97%D0%B8%D0%BC%D0%B1%D0%B0%D0%B1%D0%B2%D0%B5>,Мадагаскаре <https://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B4%D0%B0%D0%B3%D0%B0%D1%81%D0%BA%D0%B0%D1%80>. Также есть месторождения на территории Турции <https://ru.wikipedia.org/wiki/%D0%A2%D1%83%D1%80%D1%86%D0%B8%D1%8F>, Индии <https://ru.wikipedia.org/wiki/%D0%98%D0%BD%D0%B4%D0%B8%D1%8F>, Армении <https://ru.wikipedia.org/wiki/%D0%90%D1%80%D0%BC%D0%B5%D0%BD%D0%B8%D1%8F>, Бразилии <https://ru.wikipedia.org/wiki/%D0%91%D1%80%D0%B0%D0%B7%D0%B8%D0%BB%D0%B8%D1%8F>, наФилиппинах <https://ru.wikipedia.org/wiki/%D0%A4%D0%B8%D0%BB%D0%B8%D0%BF%D0%BF%D0%B8%D0%BD%D1%8B>.
Главные месторождения хромовых руд в РФ известны на Урале <https://ru.wikipedia.org/wiki/%D0%A3%D1%80%D0%B0%D0%BB> (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире).
Получение хрома
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром <https://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D1%80%D1%80%D0%BE%D1%85%D1%80%D0%BE%D0%BC> восстановлением в электропечахкоксом <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D1%83%D0%B3%D0%BE%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%BA%D0%BE%D0%BA%D1%81> (углеродом):
|
|
|

Феррохром <https://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D1%80%D1%80%D0%BE%D1%85%D1%80%D0%BE%D0%BC> применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:

) растворяют хромат натрия и отделяют его от оксида железа;
) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
) получают чистый оксид хрома восстановлением дихромата натрия углём:
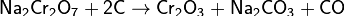
) с помощью алюминотермии <https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%BE%D1%82%D0%B5%D1%80%D0%BC%D0%B8%D1%8F> получают металлический хром:

) с помощью электролиза <https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D0%B7> получают электролитический хром из раствора хромового ангидрида <https://ru.wikipedia.org/wiki/%D0%A5%D1%80%D0%BE%D0%BC%D0%BE%D0%B2%D1%8B%D0%B9_%D0%B0%D0%BD%D0%B3%D0%B8%D0%B4%D1%80%D0%B8%D0%B4> в воде, содержащего добавку серной кислоты <https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>. При этом на катодах совершаются в основном 3 процесса:
· восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
· разряд ионов водорода с выделением газообразного водорода;
· разряд ионов, содержащих шестивалентный хром <https://ru.wikipedia.org/wiki/%D0%A8%D0%B5%D1%81%D1%82%D0%B8%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D1%8B%D0%B9_%D1%85%D1%80%D0%BE%D0%BC>, с осаждением металлического хрома;

Химические свойства хрома и его соединений
марганец хром микроэлемент организм
Хром устойчив на воздухе <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B7%D0%B4%D1%83%D1%85> за счёт пассивирования <https://ru.wikipedia.org/wiki/%D0%9F%D0%B0%D1%81%D1%81%D0%B8%D0%B2%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5>. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D1%84%D0%BE%D1%82%D0%B5%D1%80%D0%BD%D0%BE%D1%81%D1%82%D1%8C>.
Синтезированы соединения хрома с бором <https://ru.wikipedia.org/wiki/%D0%91%D0%BE%D1%80_(%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82)> (бориды <https://ru.wikipedia.org/wiki/%D0%91%D0%BE%D1%80%D0%B8%D0%B4%D1%8B> Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом <https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4> (карбиды <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%B8%D0%B4> Cr23C6, Cr7C3 и Cr3C2), c кремнием <https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%B5%D0%BC%D0%BD%D0%B8%D0%B9> (силициды <https://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%BB%D0%B8%D1%86%D0%B8%D0%B4%D1%8B> Cr3Si, Cr5Si3 и CrSi) и азотом <https://ru.wikipedia.org/wiki/%D0%90%D0%B7%D0%BE%D1%82> (нитриды <https://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D1%82%D1%80%D0%B8%D0%B4%D1%8B> CrN и Cr2N).
Большинство соединений хрома имеет яркую окраску самых разных цветов.
Соединения трехвалентного хрома химически инертны.
В природе хром находится в трех- (шпинель - двойной оксид MgCrO4 - магнохромит) и шестивалентном состоянии (PbCrO4 - крокоит). Образует оксиды основного, амфотерного и кислотного характера.
Хром (II) оксид CrO - кристаллы красного (красно-коричневого) цвета или черный пирофорный порошок, нерастворимый в воде. Соответствует гидроксиду Cr(OH)2. Гидроксид желтого (влажный) или коричневого цвета. При прокаливании на воздухе превращается в Cr2O3 (зеленого цвета):
2Cr(OH)2 + 0,5O2= Cr2O3 + 2 H2O
Катион Cr2+ - бесцветен, его безводные соли белого, а водные -синего цвета. Соли двухвалентного хрома являются энергичными восстановителями. Водный раствор хром (II) хлорида используется в газовом анализе для количественного поглощения кислорода:
CrCl2 + 2 HgO + 3H2O + 0,5O2 = 2HgCl2 + 2 Cr(OH)3↓
(грязно-зеленый осадок)
Хром (III) гидроксид обладает амфотерными свойствами. Легко переходит в коллоидное состояние. Растворяясь в кислотах и щелочах, образует аква- или гидроксокомплексы:
(OH)3 + 3H3O+ = [Cr(H2O)6]3+ (сине-фиолетовый раствор)
Cr(OH)3 + 3OH- = [Cr(OH)6]3- (изумрудно-зеленый раствор)
Соединения трехвалентного хрома, как и двухвалентного, проявляют восстановительные свойства:
(SO4)3 + KClO3 + 10 KOH = 2K2CrO4 + 3 K2SO4 + KCl + 5H2O
Соединения хрома(VI), как правило, кислородосодержащие комплексы хрома оксид шестивалентного хрома соответствует хромовым кислотам.
Хромовые кислоты образуются при растворении в воде CrO3. Это сильно токсичные растворы желтого, оранжевого и красного цвета, обладающие окислительными свойствами. CrO3 образует полихромовые кислоты, например, H2CrO4, H2Cr2O7, H2Cr3O10, H2Cr4O13. Цвета растворов меняются от желтого до красного.
Глава 2. Биологическая роль марганца и хрома
Марганец- биогенный элемент, один из десяти металлов жизни, необходимых для нормального протекания процессов в живых организмах.
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом <https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BA%D1%80%D0%BE%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D1%8B>. В теле взрослого человека содержится 12 мг (1,6 * 10-5%). Марганец концентрируется в костях (43%), остальное - в мягких тканях, в том числе и мозге.
В организме марганец образует металлокомплексы с белками, нуклеиновыми кислотами, АТФ, АДФ, отдельными аминокислотами. Содержащие марганец металлоферменты аргиназа, холинэстераза, фосфоглюкомутаза, пирувакарбоксилаза.
Марганец участвует в синтезе витамина С и В12.
Атомный радиус марганца 128 пм. Это объясняет то обстоятельство, что марганец может замещать магний (атомный радиус 160 пм) в его соединении с АТФ, существенно влияя на перенос энергии в организме.
Почти одинаковое значение атомного радиуса марганца (128 пм) и железа (126 пм) объясняет способность марганца замещать железо в порфириновом комплексе эритроцита. По той же причине марганец может замещать и цинк (атомный радиус 127 пм) в цинкзависимых ферментах, изменяя при этом их каталитические свойства.
Для организма перманганаты являются ядами, их обезвреживание может происходить следующим образом:
KMnO4+5H2O2+6CH3COOH=2Mn(CH3COO)2+2CH3COOK+8H2O+5O2
Для лечения острых отравлений перманганатом используется 3%-ный водный раствор H2O2, подкисленный уксусной кислотой.
Калий перманганат KMnO4 - наиболее известное соединение марганца, применяемое в медицине. Используют водные растворы с содержанием KMnO4 от 0,01 до 5%. В качестве кровоостанавливающего средства применяют 5%-ный раствор. Растворы калия перманганата обладают антисептическими свойствами, которые определяются его высокой окислительной способностью. MnSO4 применяют при лечении малокровия.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также легкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Хром - один из биогенных элементов <https://ru.wikipedia.org/w/index.php?title=%D0%91%D0%B8%D0%BE%D0%B3%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82&action=edit&redlink=1>, постоянно входит в состав тканей растений и животных. В организме взрослого человека содержится примерно 6 г Cr (0,1%) У животных хром участвует в обмене липидов <https://ru.wikipedia.org/wiki/%D0%9B%D0%B8%D0%BF%D0%B8%D0%B4%D1%8B>, белков <https://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BA%D0%B8> (входит в составфермента <https://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D1%80%D0%BC%D0%B5%D0%BD%D1%82> трипсина <https://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B8%D0%BF%D1%81%D0%B8%D0%BD>), углеводов <https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D1%8B>.
В чистом виде хром довольно токсичен, металлическая пыль <https://ru.wikipedia.org/wiki/%D0%9F%D1%8B%D0%BB%D1%8C> хрома раздражает ткани лёгких <https://ru.wikipedia.org/wiki/%D0%9B%D1%91%D0%B3%D0%BA%D0%B8%D0%B5>. Металлический хром нетоксичен, а соединения Cr (III) и Cr(VI) опасны для здоровья. Они вызывают раздражение кожи, что приводи к дерматитам. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. Есть предположение, что производные хрома (VI) обладают канцерогенными свойствами. 0,25-0,3г дихромата калия вызывают летальный исход. Соединения хрома (VI) применяют как фунгициды (протравливающие вещества). Соединения хрома (III) благоприятно влияют на рост растений.
Сr+3- влияет на углеводный обмен, обеспечивает чувствительность ткани к инсулину.
CrO3 обладает прижигающим действием, это свойство используют в медицине.
Смертельная доза K2Cr2O7 для взрослого человека составляет 0,3г.
Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина <https://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%B5%D1%81%D1%82%D0%B5%D1%80%D0%B8%D0%BD> в крови.
Глава 3. Нормы потребления марганца и хрома
Нормы потребления марганца, недостаток и переизбыток микроэлемента
Марганец (Mn) необходим для правильного развития клеток. Его присутствие в организме - обязательное условие для полноценного усвоения витамина В1 (тиамина), меди и железа, необходимых для осуществления кроветворной функции. Без тиамина невозможен процесс строительства клеток, в частности нервных. При дефиците этого витамина возникают запоры, полиневриты, склонность к развитию анемии и остеопороза.
Суточная потребность марганца для взрослого организма составляет 0,2-0,3 мг на 1 кг массы тела.
Для детей и подростков норма рассчитывается так: 5-7 лет - 0,07-0,1 мг/кг, для подростков - 0,09 мг/кг веса.
В пересчёте на организм взрослого человека норма потребления марганца составляет от 2,5 до 5 мг в сутки.
Детский же организм требует, естественно, меньшее количество - около 1-2 мг в день.
Интенсивность физической нагрузки оказывает влияние на потребность в микроэлементе, поэтому норма потребления марганца для спортсменов несколько больше, чем среднестатистическая потребность взрослого организма и составляет от 7 до 8,5 мг в день.
При длительном недостатке марганца в организме могут возникнуть патологические состояния, плохо поддающиеся коррекции. Например, если будущая мать испытывает дефицит Mn, то плод развивается неправильно: ребёнок может получить патологию развития конечностей, родиться со сращиванием подвижных суставов, с деформацией черепа.
Дефицит марганца приводит к различным формам анемии, нарушениям функций воспроизводства у обоих полов, задержке роста детей, проявлениям дефицита массы тела и др.
Недостаток марганца может наблюдаться у людей со следующими клиническими симптомами и заболеваниями:
хроническая усталость, слабость, раздражительность;
аллергический насморк, склонность к бронхоспазмам;
остеопороз и артроз, в группе риска - женщины и пожилые люди;
избыточный вес, в сочетании с повышенном уровнем липидов в крови;
склонность к судорогам у детей, задержка их психомоторного развития.
Опасно не только недостаточное содержание марганца в организме, но и его избыток. Повышенное содержание марганца в тканях организма вызывает следующие нарушения: ухудшается всасывание железа и возникает риск развития анемии <http://fitfan.ru/health/bolezni/2305-anemiya.html>, ухудшается состояние нервной системы, возникает нарушение всасывания кальция, что приводит к нарушению функционирования костно-мышечной системы.
Основными клиническими симптомами интоксикации марганцем являются:
потеря аппетита;
прогрессирующие галлюцинации;
потеря способности правильной оценки ситуации;
значительное ухудшение памяти;
болезненная сонливость;
мышечные боли, судороги.
Определенные категории людей наиболее подвержены к возникновению избытка марганца в организме. Им необходимо снижать концентрацию данного микроэлемента в организме, исключая из рациона продукты богатые Mn. В эту категорию входят люди страдающие болезнью Паркинсона, а также работающие на вредном производстве: нефтеперерабатывающих и сталеплавильных заводах, электротехнических станциях. Если же говорить о профессиях, то это преимущественно электросварщики, шахтёры и т.д.
Также избыток марганца приводит к патологиям, идентичным рахиту. Заболевание названо марганцевым рахитом. К полному выздоровлению от данного недуга приводит лечение витамином D при полноценном питании.
Если предстоит назначение приёма марганецсодержащих препаратов, следует непременно проверить в крови его уровень, так как неконтролируемый приём витаминных и минеральных препаратов часто приводит к нарушению баланса микроэлемента в организме.
Нормы потребления хрома, недостаток и переизбыток микроэлемента
Хром - критически важный микроэлемент. В природе он встречается в трех различных формах, причем в нашем рационе преобладает одна из них (хром III).
Суточная потребность взрослого человека в хроме составляет 0,20-0,25 мг.
Дефицит хрома в организме может развиваться при длительном питании преимущественно продуктами, бедными хромом, использовании больших количеств сахара, который способствует выведению хрома с мочой. К числу таких продуктов относятся хлеб из муки высших сортов, кондитерские изделия.
Дефицит хрома в организме ведет к снижению чувствительности тканей к инсулину, ухудшению усвоения ими глюкозы, увеличению ее содержания в крови.
Опыты показали, что, если в организме крыс мало хрома, уровень холестерина и сахара в крови повышается, а жировые вещества оседают на стыках аорты. Когда крыс докармливают этим элементом, уровень холестерина и сахара в крови снижается.
У здоровых людей содержание хрома несколько выше нормы. Это является признаком полноценного усвоения глюкозы. Если усвоение сахаров нарушено, содержание этого элемента снижается.
Хром очень нужен больным диабетом, он "сотрудничает" с инсулином, помогая регулировать уровень сахара или глюкозы в крови. Несмотря на то что получен синтетический GTF, все-таки лучше предпочесть натуральный хром, содержащийся в дрожжах - самом богатом его источнике, как более эффективный. Кроме того, биологически активный хром находится в телячьей печени и проросших зернах пшеницы.
Там, где люди работают в контакте с хромом и вынуждены вдыхать хромовую пыль, они, к сожалению, в 29 раз чаще, чем другие жители тех же мест, и в 11 раз чаще, чем рабочие других отраслей промышленности, заболевают раком легких или бронхов.
Слишком много хрома обычно около фабрик и вообще в промышленных районах, где из-за отсутствия хорошей системы пылеулавливания этот металл в больших количествах уносится в воздух.
Глава 4. Пищевые источники микроэлементов
Пищевые источники марганца
Для поддержания оптимального количества микроэлемента в организме необходимо знать, как восполнить его недостаток в организме и как не допустить его избыточного накопления. Для ответа на эти вопросы необходимо знать, с какими продуктами питания Mn в организм попадает и в каких количествах. Очень много марганца содержится в таких напитках, как чай и кофе. Клюква, съедобные каштаны, перец также им богаты. Ниже приведены данные по продуктам и количеству Mn (в миллиграммах) на 1 килограмм продукта.
Продукт Содержание марганца, мг/кг продукта
Молоко 0,04
Мясо (всех видов, кроме свинины, птица и яйца) 0 - 50
Свинина, почки, сыр 2-10
Рыба (крабы и раки) 0,5-2
Масло оливковое 0,5-2
Мёд светлый 0,5 - 2
Лимон 0,5
Сельдерей 0,5 - 2
Капуста белокочанная, цветная, ревень, редька, оливки, морковь, огурцы, грибы, картофель, спаржа, репа, помидоры, ржаная мука, сливы, финики, виноград 2 - 10
Печень, свекла, фасоль, хлеб пшеничный и ржаной, лук, зеленый горошек, брусника, бананы, петрушка, смородина, черника, чернослив, тёмный мёд, устрица, инжир, дрожжи 2 - 10
Мука пшеничная 10 - 70
Шпинат, салат, малина, шоколад, сухой в зёрнах горох и фасоль, рис, орех кокосовый, ячмень, желатин 30
Какао 35
Мука и хлопья овсяные 36
Перец 65
Соевая мука, съедобный каштан 40
Клюква 40 - 200
Чай (все сорта) 150 - 900
Употребляя вышеперечисленные продукты можно достаточно легко удовлетворить потребность организма в марганце. При дефиците микроэлемента следует больше употреблять продуктов натуральных, нерафинированных, без тепловой обработки. Для предотвращения избыточного накопления марганца необходимо избегать употребления продуктов, с большим содержанием данного микроэлемента, или подвергать их тщательной термической обработке.
Пищевые источники хрома
Хром является эссенциальным (жизненно необходимым) элементом.
Организм взрослого человека содержит 5-6 мг хрома.
Наибольшие концентрации хрома наблюдают в печени и почках (0,6 мкг/кг), а также в хрящевой и костной ткани, кишечнике, щитовидной железе.
Наиболее важными источниками хрома являются субпродукты (печень), мясо <http://eat-info.ru/references/encyclopedia/>, продукты из цельного зерна, сыр, бобовые и специи, яйца, морепродукты, рыба, бананы, апельсины, яблоки, кукуруза, зеленый лук, капуста, морковь, томаты, сладкий перец, картофель, грибы, черника, рябина, голубика, клюква, облепиха, пивные дрожжи, молочные продукты и молоко.
Список литературы
1. Учеб. для вузов/ Ю.А.Ершов, В.А.Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. - 3-е изд., стер. - М.: Высш. шк., 2002. - 263-276с.: ил.
. А.Я Губергриц "Лечебное питание"
3. http://sovetik.ucoz.ru/publ/pishhevye_dobavki/khrom_naznachenie_istochniki_dozirovanie_issledovanija/5-1-0-181
. <http://fitfan.ru/nutrition/vitamins/3239-marganec.html>
|
|
|


