 |
д)третичные алифатические с HNO2 не взаимодействуют
|
|
|
|
Влияние электронных эффектов и сопряжения на О-Н и S-H кислотность.
Амины - органические основания. Строение и основность алифатических и ароматических аминов. Реакции распознавания аминов (с азотистой кислотой и уксусным ангидридом).
Химические свойства аминов.
I. Основные свойства.
 | |||
 |
IV Реакция с HNO2 – азотистой кислотой – реакция идентификации аминов.
А) первичные алифатические амины реакция дезаминирования, выделяется N2 и образуется спирт
 С2H5NH2 + HNO2 C2H5OH + N2 + H2O
С2H5NH2 + HNO2 C2H5OH + N2 + H2O
этиламин (H-O-N=O
Б) первичные ароматические амины реакция диазотирования
 NaN
NaN
= хлорид фенилгидрозония
+ HNO2
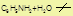 |
Смотри лекции
В) вторичные (алифатические и ароматические амины) – реакция образования нитрозаминов
д)третичные алифатические с HNO2 не взаимодействуют
3. Моносахариды. Наиболее важные представители альдогексоз. Реакции окисления и восстановления.
4. Напишите уравнения реакций взаимодействия кротонового альдегида с: а) бромом; б) водным раствором КМnО4; в) СН3ОН; г) NH3; д) NaHSO3.
CH3-CH=CH-C=OH+бром= CH3-CHBR-CHBr-C=OH
+ водным раствором КМnО4= CH3-CHOH-CHOH-C=OH
+CH3OH=HClсух =СH3-CH=CH-C-OCH3(H)+CH3OH=CH3-CH=CH=CO(CH3)2H
+NH3=CH3-CH=CH-C=NH
+ NaHSO3.= CH3-CH=CH-C(HSO3)ONA(H)
Билет№ 41.
1.Некоторые понятия органической химии: сопряжение, ароматичность, кислотность.
Сопряжение — явление выравнивания связей и зарядов в реальной молекуле по сравнению с идеаьной, но несуществующей структурой.
Сопряженные системы — соединения, содержащие кратные связи, отделенные одной простой связью от соседнего атома, имеющего p-орбиталь.
Учавствующие в сопряжении делокализованные р-орбитали могут пренадлежать двум и более п-связям, либо п-связи и одному атому с р-орбиталью. Поэтому делиться на п,п-сопряжение и р,п-сопряжение.
|
|
|
п,п-сопряжение с открытой цепью сопряжения. Представитель бутадиен-1,3. В нем все атомы находяться в sp2-гибридизации, образуют плоский сигма-скелет. Образуют общую п-электронную систему (за счет перекрывания атомов С1 и С2, С3 и С4, а также С2 и С3. Расстояние между С2 и С3 укороченно, процесс делокализации электронов приводит к выравниванию длин связей. К ним относяться каротины,?,?-ненасыщенные карбонильные соединения.
р,п-сопряжение. В системе есть электроотрицательный атом (О2), тогда в сопряжение с п-орбиталью вступает р-орбиталь атома О. В таких системах происходит делокализация электронной плотности, что приводит к выравниванию связей и зарядов. Представители: карбанионы, карбакатионы, свободные радикалы, виниловые эфиры, винилгалагениды.
Обладают повышенной термодинамической устойчивостью.Занимают более низкий энергитический уровень по сравнению с несопряженными.
Соединение обладают ароматичностью, если имеют плоский замкнутый цикл и единую п-систему, охватывающие все атомы цикла и соединяющую (4n+2p)электроны, учавствующие в сопряжении.
Имеют плоский сигма-скелет из 6 sp2-гибридизированных атомов С. Электроны имеютсвободную рz-орбиталь. Перекрываются между собой, образуя единую 6 п-электронную систему охватывающуе все атомы С в цикле.
Реакционная способность ароматических УВ:
-бензольное кольцо является источником электроннов, т.е. основание т.к. п-электроны удерживаются слабо и доступно для реагентов
-Вещества реагирующие с ним, имеют дефецит электронов, являются электрофильнимы реагентами. Характерны реакции электрофильного замещения.
п,п-сопряжение характерно для 6-членных гетероциклов с одним или несколько гетероатомами (пиридин). В результате большей электроотрицательности по сравнению с атомом С пиридиновый атом N понижает электроную плотность на атомах С ароматического кольца. Поэтому они называются п-недостаточными.
|
|
|
р,п-сопряжение характерно для 5-членных гетероциклов с атомами N,O,S (пирол). 6-электронное облако в пироле делокализовано на 5 атомах цикла, поэтому пиррол п-избыточен.
Кислоты Бренстеда- вещество, способное отдавать протоны т.е. донор Н. Для слабых электролитов кислотность количественно оценивается константой равновесия К реакции.Чем больше К, тем сильнее кислота. В зависимости от природы деляться на: ОН-(спирты, фенолы, карбоновые кислоты), SH-(тиоспирты), NН-(амины, амиды, имины), СН-(Алканы, алкены, арены).
Факторы определяющие кислотность:
-электроотрицательности атома, чем больше ЭО, тем меньше кислотность и стабильней анион
-радиус атома, чем больше радиус, тем больше кислотность и стабильней анион
-природа заместителей: электродонорные заместители уменьшают кислотность и стабильность аниона, а электроакцептроы увеличивают.
-участки сопряжения увеличивают кислотность и стабильность аниона.
Кислоты Льюиса- акцепторы пары электронов.
2.Функциональные производные карбоновых кислот: соли, сложные эфиры, ангидриды, галагенангидриды, амиды, нитрилы, уреиды. Строение, реакционная способность и взаимные превращения.
Замещение атома Н на металл приводит к образованию солей. Соли щелочных метталов и высших карбоновых жирных кислот — мыло. В водных растворах они в значительной степени гидролизованы, в связи с чем эти растворы имеют щелочную реакцию.
R-COOH + NaOH?-?RCOONa+1\2H2
Свойства ОН — нуклеофильное замещение. Этерификация — взаимодействие карб. кислот со спиртами, приводящее к образованию сложных эфиров, т.е. реакции этерефикации — наиболее важнай процесс. Эта реакция в отсутствии катализаторов протекает медленно вследствие низкой способности карбонильной группы в кислотах подвергается нуклеофильной атаке. В присутствии минеральных кислот ускоряется.
R-COOH+R-OH?-?R-COO-R+H2O. Процесс обратим. Для усиления реакции удаляют один из продуктов. Реакция гидролиза, щелочной гидролиз необратим.
Ангидриды могут содержать остатки одинаковых кислот RCO-COR или смешанными RCO-O-COR”. Простые ангидриды — продукты образованные за счет отщепления молекул воды от двух молекул кислоты; смешанные-продукты отщепления молекул воды от молекул двух разных карб. кислот или карбоновых и минеральных кислот. Реакции: о-фталевый ангидрид+вода образуется малоновая кислота. Также реакция декарбоксилирования с образованием углекислого газа: ССL3-COOH>CO2+CH3CL
|
|
|
Галагенангидриды-активные ацилирующие реагенты среди производных карб. кислот. Ацетилхлорид легко гидролизуются водой с выделением тепла и образования кислоты. Реакции с участием галагенангидридов почти необратимы. Также учавствуют в реакции ацилирования с аналином. Образуется ацетатанилид.
Амиды — могут быть первичными RCONH2, RCONHR — вторичные и третичные RCONRR'. Амиды имеют амфотерные свойства. Склонны к реакциям нуклеофильного замещения. Реакции: +NaNH2, образуются натрий ацетамид и амиак. При температуре и P2O5 с образованием этанонитрилов и воды CH3-C?N.
Нитриллы R-C?N производные карб. кислот, в которых атом О карб. группы и гидроксильная группа замещены на трехвалентный атом N. Гидратация нитрилов проходит в кислой или щелочной среде. Гидратация проходит как нуклеофильное присоединение воды к поляризованной тройной связи нитрила с образованием промежуточного иминола, который далее изомеризуется в амид. Более слабые основания чем амиды.
Уреиды-производные карб. кислот, содержащими остаток мочевины в качестве заместителя. Действующие на ЦНС уреиды — барбитураты, производные малоновой кислоты.
CH3-CHCH3-CHBr-COOH+ NH2-C=O-NH2>CH3-CHCH3-CHBr-C=O-NH-C=O-NH2/
3.Моносахариды. Строение, классификация. Наиболее важные представители альдопептоз. Реакции с участием гидроксогрупп. Качественные реакции на пептозы.
Моносахариды-твердые вещества, легко растворимые в воде, плохо в спирте и совсем нерастворимы в эфире. Большинство обладают сладким вкусом. Структурная единица полисахаридов. Существуют в открытой и циклической формах. В молекулах содержиться как карбонильная так и несколько гидроксогрупп т.е. представляют собой полигидроксиальдегиды и полигидроксикетоны.
|
|
|
Стереоизомерия. Молекулы имеют несколько центров хиральности, что служит причиной большого числа стереоизомеров, соответствующей одной и той же структурной формуле. Открытые формы записываются в виде формул Фишера.
Все оптические деятельные соединения — аминокислоты, углеводы и др., которые по конфигурации т.е. по пространственному строению молекулы сходны с конфигурацией правовращающегося глицеринового альдегида относят к D-ряду.При совпадении конфигурации с L-глицериновым альдегидом, то моноза принадлежит к L-ряду. Конфигурация непосредственно не связана со знаком вращения. Знак вращения-только признак, позволяющий отличить друг от друга пространственные изомеры.
Диастереомеры моноз, различающиеся конфигурацией только одного ассиметричного атома С, называют эпимером. D-глюкози и D-галактоза отличаются только конфигурацией С-4. Вычесление эпимеров N=х?. Доказательства открытого строения сахаров:
при энергитическом восстановлении глюкозы НI получается 2-йодгексан, соединение с неразветвленной прямой цепью; наличие альдегидной группы было доказано реакцией Ag2O, к карб. группе может присоединятся НСN.
Циклические формулы. Формулы Колли-Толленса. Являются циклическими полуацеталями многоатомных альдегидо-кетоспиртов. В них возникает хиральный центр-атом С, с которым связана полуацетальная гидроксильная группа. Этот атом называют аномерным, соответствующие стереоизомеры?- и?-аномерами. Образовавшуюся полуацетальную гидроксильную группу называют гликозидной. Гликозид-это продукт замещения амома Н в полуацетальной гидроксильной группе на R. В результате внутримолекулярного взаимодействия образуются устойчивые 5-членные — фуранозные, и 6-членные — пиранозные — циклы.
Формулы Хеоруса. Циклические формулы изображаются «непрерывными» формулами, которые изображаются в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом О распологается в пиранозном цикле в дальнем правом углу, в фуранозном за плоскостью. Сиволы в формуле не пишутся.
Таутомерия: изменеие во времени угла вращения плоскости поляризации света растворами — муторатация. Химическая сущность-способность моноз к существованию в виде равновесной смеси таутомеров. Такой вид таутомерии называют — цикло-оксо-таутомерией. Конформация в виде двух наиболее устойчивых формах: кресло и ванна.
Классификация: по количеству атомов С на триозы, тетрозы, пентозы, гексозы и гептозы; по характеру функциональной группы на альдозы и кетозы.
Важные представители альдопептоз: рибоза и дезоксирибоза входят в состав нуклеиновых кислот. Отличаются тем что у С-2 два Н у дезоксирибозы. Также есть ксилоза.
|
|
|
Реакции с участием ОН-групп.
1)Реакция образования сахара Сu Cu(ОН)2 при комнатной температуре с получением ярко-синего цвета.
2)Реакция образования сложных эфиров — реакция ацетилирования. Добавление 5 молекул ацетилангидрида с образованием уксусной кислоты и ацетилглюкозида.
3)Реакция фосфолиирования с фосфорной кислотой, образуется глюкозо-6-фосфоат.
4)Образование аминосахаров, получаем 2-глюказамин
Качествееные реакции на пептозы: в отличие от гексоз они могут при кипячении с концентрированной соляной кислотой циклизоваться, образуя фурфурол, который при конденсации с амином дает ярко малиновый цвет.
4.Напишите уравнение реакции галактозы со свежеприготовленным гидроксидом меди: а)без нагревания б) при нагревании
а) без нагревания образуется комплексное соелинение
б) при нагревании происходит окисление «реакция серебренного зеркала» с образованием галактоновой кислоты СОН переходит в СООН.
Билет№42
1.Влияние гетероатома на основность и ароматичность на примере пиррола и пиридина.
Гетероатомы, в частости N и О, находяться в одинаковом с атомом С состоянии гибридизации и имеют небольшой объем, потому существенно не меняют конформационного строения аналогичного карбоцикла. Некоторые изменения происходят только в велечинах длин связей и валентных углов.
Пиридин содержит в цикле один атом N. Он находиться в состоянии sp?-гибридизации. Постовляет в ароматичный секстет один р-электрон. Неподеленная пара электронов на sp?-гибридной орбитали обуславливает свойства пиридина как основания. Атом N с таким электронным строением называют пиридиновым. В результате большой электроотрицательности по сравнению с атомом С пиридиновый атом понижает электронную плотность на атомах С ароматического кольца. Поэтому системы с пиридиновым атомом называют?-недостаточными.
В пирроле от атома N в ароматичный секстет включается находящийся на негибридизированной р-орбитали неподеленная пара электронов. Три электрона на sp?-гибридных орбиталях учавствуют в образовании трех сигма-связей. Атом N в таком электоронном состоянии называют пиррольным. Шестиэлектронное облако в пирроле делокализовано на пяти атомах цикла, пэтому пиррол?-избыточен. Повышается электронная плотность.
В пиридине неподелленая пара электронов не учасивует в образовании?-электронного секстета и ответственна за проявление его основных свойств. Основность пиридина значительно меньше чем алифатических аминов. Так как неподеленная пара электронов атома N занамает sp?-гибридную орбиталь. Атом N в пиридине более электроотрицателен, чем sp?-гибридизированный атом N в обычных аминах и прочнее удерживает свою электронную пару. Поэтому атом N проявляет нуклеофильные свойства.
В пирроле неподеленная пара электронов не проявляет склонности к связыванию протонов, в результате практически лишена основных свойств.
2.Биологически важные реакции карбонильных соединений: окисление-восстановление, дисмутация, ацетализация, галоформные реакции.
Реакции окисления-восстановления: окисление сложным окислителем
СН3-СОН+2[Ag(NH3)2]OH=(при температуре) СН3-СООNН4+3NН3+Н2О+2Ag при окислении сложными окислителями в щелочных средах (аммиакатом серебра, гидроксидом меди2) альдегиды окисляются в карбоновые кислоты, при этом происходит восстановление окислителя.
Дисмутация (реакция Канниццаро-Тищенко) — самоокисление-самовосстановление
С6Н5-СОН+НСОН=(при NaОН 40%) С6Н5СООNa+СН3ОН бензоат натрия или С6Н5-СН2ОН+НСООNа получаем набор кислот и спиртов; НСООН+НСООН=(условия те же) СН3ОН+НСООН
Ацетализация — присоединение спиртов в минеральных кислот. Альдегид+спирт=полуацеталь+спирт+ацеталь; кетоны+спирт=кетоны (легко только с метиловым спиртом и этиленгликолем) С2Н5ОН+СН3СОН=(НСl газ)СН3-СН(ОН)-О-С2Н5
Эфир альдегида и спирта, существующий только в растворе. Полуацеталь — жидкость с неприятным запахом, плохо растворим в воде.
полуацеталь+спирт=(уходит ОН) СН3-СН(О-С2Н5)-О-С2Н5 диэтилацеталь
Галоформные реакции: характерны для тех альдегидов и кетонов, которые имеют группу СН3-С=О ацил. Эти реакции лежат в основе получения иодоформа, хлороформа
СН3-СОН+3Сl-(при квантосвете) Ссl3-CОН+3НСl
CСl3-COH+NaOH=CHCl3+NaO-COH муравьинокислый натрий
хлороформ
3.Моносахариды: строение, классификация. Кетозы. Реакции алкилирования и ацилирования. Фосфорно-кислые эфиры моносахаридов. Качественная реакция на фруктозу.
Моносахариды-твердые вещества, легко растворимые в воде, плохо в спирте и совсем нерастворимы в эфире. Большинство обладают сладким вкусом. Структурная единица полисахаридов. Существуют в открытой и циклической формах. В молекулах содержиться как карбонильная так и несколько гидроксогрупп т.е. представляют собой полигидроксиальдегиды и полигидроксикетоны.
Стереоизомерия. Молекулы имеют несколько центров хиральности, что служит причиной большого числа стереоизомеров, соответствующей одной и той же структурной формуле. Открытые формы записываются в виде формул Фишера.
Все оптические деятельные соединения — аминокислоты, углеводы и др., которые по конфигурации т.е. по пространственному строению молекулы сходны с конфигурацией правовращающегося глицеринового альдегида относят к D-ряду.При совпадении конфигурации с L-глицериновым альдегидом, то моноза принадлежит к L-ряду. Конфигурация непосредственно не связана со знаком вращения. Знак вращения-только признак, позволяющий отличить друг от друга пространственные изомеры.
Диастереомеры моноз, различающиеся конфигурацией только одного ассиметричного атома С, называют эпимером. D-глюкози и D-галактоза отличаются только конфигурацией С-4. Вычесление эпимеров N=х?. Доказательства открытого строения сахаров:
при энергитическом восстановлении глюкозы НI получается 2-йодгексан, соединение с неразветвленной прямой цепью; наличие альдегидной группы было доказано реакцией Ag2O, к карб. группе может присоединятся НСN.
Циклические формулы. Формулы Колли-Толленса. Являются циклическими полуацеталями многоатомных альдегидо-кетоспиртов. В них возникает хиральный центр-атом С, с которым связана полуацетальная гидроксильная группа. Этот атом называют аномерным, соответствующие стереоизомеры?- и?-аномерами. Образовавшуюся полуацетальную гидроксильную группу называют гликозидной. Гликозид-это продукт замещения амома Н в полуацетальной гидроксильной группе на R. В результате внутримолекулярного взаимодействия образуются устойчивые 5-членные — фуранозные, и 6-членные —пиранозные — циклы.
Формулы Хеоруса. Циклические формулы изображаются «непрерывными» формулами, которые изображаются в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом О распологается в пиранозном цикле в дальнем правом углу, в фуранозном за плоскостью. Сиволы в формуле не пишутся.
Таутомерия: изменеие во времени угла вращения плоскости поляризации света растворами — муторатация. Химическая сущность-способность моноз к существованию в виде равновесной смеси таутомеров. Такой вид таутомерии называют — цикло-оксо-таутомерией. Конформация в виде двух наиболее устойчивых формах: кресло и ванна.
Классификация: по количеству атомов С на триозы, тетрозы, пентозы, гексозы и гептозы; по характеру функциональной группы на альдозы и кетозы.
Кетозы — моносахариды содержащие кетонную группу, наиболее важные: пентозы — рибулеза, ксилуоза; гексозы- фруктоза.
Реакция ацилирования: глюкоза взаимодействует с СН3СООН и образуется ацетил-глюкопираноза, происходит присоединение к С-2 за место атома Н у группы ОН. Уходит вода.
Реакция алкилирования: глюкоза регирует со спиртом в присутствии неорганических кислот образуется продукт-гликозид, например метил-глюкопиранозид.
Фосфорно-кислые эфиры: играют большую роль в обмене веществ. Получаются реакцией фосфолиирования. Например, глюкоза+Н3РО4, образуется глюкоза-6-фосфат.
Качественная реакция на фруктозу: реакция Селиванова позволяет открыть фруктозу —?-глюкопираноза при нагревании с концентрированной соляной кислотой образуется оксиметилфурол. 5-оксиметилфурфурол дает красное окрашивание с резорцином.
4.Путем последовательных реакций превратите метан в малоновую кислоту.
СН4 дегидрируем в С2Н2, С2Н2 превращаем реакцией Кучерова +Н2О при Hg в этаналь, этаналь реакцией окисления Аg2O превращаем в уксусную кислоту, СН3СООН+Сl в СН2ClСООН, хлоруксусную кислоту +КСN в СН2СNСООН, СН2CNСООН+Н2О в СН2(СООН)2+NH3
Билет№43
1.Стереоизомерия винных кислот. Мезоформа. Рацемические смеси и способы их разделения.
Стереоизомеры-соединения, молекулы которых имеют одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
Энантиомеры — стереоизомеры, молекулы которых относятся между собой как премет и несовместимое с ним зеркальное изображение.
Винная кислота обладает оптической изомерией, которая связана с оптической активностью вещества. Она проявляется в способности вещества взаимодействовать с поляризованным светом. Отклонять плоскость поляризованного света либо вправо на определенный угол и называется правовращающим (+), либо влево — левовращающим (-). Причиной оптической активности является наличие в соединении ассиметричного хирального атома углерода. Ассиметричный атом С называется такой атом С, который связан с четырмя различными группами. С появлением хирального атома молекула утрачивает центр симетричности и становиться оптически активной. Величину угла и направление отклонения плоскости света определяют с помощью поляриметра, измерив удельное вращение. Оптическая активность завиститот различного расположения группировки относительно хирального атома: а) для правовращающих — расположение по часовой стрелки; б) для левовращающих — против;
СООН СООН
| |
Н-С-ОН НО-С-Н
| |
НО-СН Н-С-ОН
| |
СН3 (+) СН3 (-)
(+) винная кислота — виннокаменная кислота, из-за осадка выпадающего при брожении виноградного сока.
(-) - содержиться во многих растениях (виноград, рябина).
Отличаются друг от друга:
а) различным физиологическим действием на организм
б) разной способностью кристаллизоваться
в)по-разному вращают плоскость поляризованного света
Химические свойства одинаковы.
Мезовинная кислота — молекула содержащая центры хиральности, но в целом являющейся ахиральной из-зи наличия плоскости симметрии. Мезовинная кислота не обладает оптической активностью, она представляет собой «внутрений» рацемат: два идентичных центра хиральности имеют различные конфигурации (см. стр. 262 Тюкавкина).
Смесь равных количеств право и левавращающих энантиомеров называется рацемичекой смесью.Это непрочное, оптически неактивное соединение.
Способы разделения смеси:
а) механический — основан на отборе кристаллов по внешнему виду. Кристаллы энантиомеров отличаются противоположно скошенными гранями. Зеркально построеные кристаллы не тождественны т.е. при наложении они не совпадают всеми точками
б) микробиологичеки — антиподы разделяют по физиологическому действию на микроорганизмы. Раствор рацемата помещают в среду микроорганизмов, которые избирательно уничтожают один антипод, а другой накапливается в среде.
в) химический метод основан на химической реакции энантиомера с оптически деятельным веществом.
2.Двухосновные карбоновые кислоты: предельные и непредельные. Строение и реакционая способность. Спецефические реакции.
Все двухосновные карбоновые кислоты кристаллические вещества, причем кислоты с четным числом углеродных атомов плавяться при более высоких температурах, чем соседние гомологи с нечетным числом атомов С.
Дикарбоновые кислоты диссоциируют последовательно, т.к. отрыв протона от молекулы кислоты всегда происходит легче, чем от ее аниона: НООС-СООН=НООС-СОО+Н
Кислотные свойства этих кислот, особенно первых представителей, значительно выше, чем монокарбоновых. Эт объясняется электроакцепторным влиянием второй карбоксидьной группы, а в случае щавелевой кислоты еще и большей возможнстью делокализации отрицательного заряда в ее анионах. Наиболее сильная кислота — щавелевая НООС-СООН. Дикарбоновые кислоты могут образовывать два вида функциональных производных: неполные, т.е. по одной функциональной группе, и полные — по обеим.
Реагируют с металлами: НООС-СООН+Са=НООС-СООСа — гидрооксалат кальция — малорастворимые соли, являются причиной образования оксалатных камней в почках.
Со спиртами: малоновая кислота НООС-СН2-СООН+С2Н5ОН=НООС-СН2-СООС2Н5 этилмалонат. Еще есть НООС-(СН2)2-СООН янтарная кислота, НООС-(СН2)3-СООН глутаровая кислота.
Спецефические свойства обусловлены наличием в молекулах двух карбоксильных групп, проявляется прежде всего в их склонности к реакциям окислительно-восстановительной дисмутации и реакциям дегидратации.
НООС-СООН=(нагревание) СО2+НСООН; НООС-СН2-СООН=(нагревание) СО2+СН3СООН; НООС-(СН2)2-СООН=(нагревание) янтарный ангидрид СН2-С=О
/ |
СН2-С-O
?
О
Янтарная кислота содержит две активированные метильные группы, и потому в организме она легко дегидрируется окисленой формой конфермента ФАД:
НООС-(СН2)2-СООН+ФАД=(сукцинатдегидрогеназа)НООС-СН=СН-СООН фумаровая.
Непредельные: СООН-СН=СН-СООН бутендиовая. Существует в цис и тран-изомерах. Цис-малеиновая, транс- фумаровая. Малеиновая кислота термодинамически неустойчивая. Поэтому при нагревании под действием радикалообразующих веществ (I2, HNО2, оксидов азота) малеиновая кислота превращается в фумаровую с выделением теплоты.
НООС-СН=СН-СООН+Н2О=СООН-СН(ОН)-СН2-СООН яблочная кислота.
При наревании образуют ангидриды (стройте по примеру янтарного).
3.Моносахариды. Наиболее важные представители альдогексоз. Реакции окисления и восстановления.
Важные представители — глюкоза (виноградный сахар), галактоза (молочный сахар — диастереомер глюкозы).
При восстановлении моносахаров образуются многоатомные спирты-пиолы или альдиты.
Глюкоза+Н2 образуется сорбит, ксилоза+Н2 — ксилит, фруктоза+ NaBН4 — глюцит и маннит, при восстановлении альдоз получают один полиол, кетоз — смесь двух полиолов.
Окисление может быть в двух средах.
В щелочной получается смесь продуктов. Альдоза + Аg(NH3)2OH – Ag+ глюконовая кислота, +Сu (реактив Фелинга) комплекс — Сu2О и глюконовая кислота.
В нейтральной или кислой среде приводит к образованиям кислот.
Глюкоза с разбавленной HNO3 — гликаровая кислота, с концентрированной — глюкаровая кислота; +Вr2(бромная вода) — гликоновая кислота; +О2 — уроновая кислота.
4.Из 1-бормбутана получить кислоту: а) с тем же количеством атомов углерода; б)с большим количеством атомов углерода.
а) СН2Вr-СН2-СН2-СН3+КОН(водн) — СНОН-СН2-СН2-СН3+КВr
СНОН-СН2-СН2-СН3+[O] — СН3-СН2-СН2-СОН+Аg2O — СН3-СН2-СН2-СООН
б)СН2Вr-СН2-СН2-СН3+КСN=СН2(СN)-СН2-СН2-СН3+КВr
СН2(СN)-СН2-СН2-СН3+2Н2О=СООН-СН2-СН2-СН2-СН3+NН3
Билет№44
1.Кислотности органических соединений по Бренстоду-Лоури. О-Н и S-Н кислоты.
Кислоты Бренстеда — нейтральные молекулы или ионы, способные отдавать протон.
Для слабых электролитов кислотность количественно оценивается константой равновесия (К) реакции, заключающийся в переносе протона от кислоты к воде как основанию. Используя значение константы равновесия этой реакции и учитывая, что концентрация воды практически постоянна, можно определить произведение К*[H2O], называемое константой кислотности. Чем она больше, тем сильнее кислота.
В зависимости от природы элемента, с которым связан протон, бренстедовские кислоты делятся на ОН-кислоты (спирты, фенолы, карбоновые кислоты), SН-кислоты (тиолы), NН- и СН-кислоты. Элемент и связаный с ним атом Н называют кислотным центром. Большинство органических соединений, кроме карбоновых кислот, проявляют низкую кислотнось (рК).
Чем стабильнее анион, тем сильнее сопряженная кислота.
Стабильность аниона определяется степенью делокализации отрицательного заряда. Зависит:
а)от природы атома в кислотном центре
б)от возможности стабилизации аниона за счет сопрядения
в)от характера связанного с кислотным центром органического радикала
г)от влияния растворителя
Природа атома в кислотном центре. Для делокализации отрицательного заряда наибольшее значение имеет электроотрицательность атома в кислотном цетнре и его поляризуемость.
СН-кислоты NН-кислоты ОН-кислоты — в этом ряду увеличивается электроотрицательность, уменьшается стабильность анионов и сила кислот.
ОН-кислоты SН-кислоты - в этом ряду увеличивается поляризуемость, увеличивается стабильность аниона и сила кислот. Поэтому в отличие от спиртов тиолы образуют соли с водными растворами щелочей, а также оксидами, гидроксидами и солями тяжелых металлов.
Стабилизация аниона за счет сопряжения. Пример действия этого фактора в группе ОН-кислот является повышение кислтности карбоновых кислот RСООН по сравнению со спиртами RОН. Объясняется образованием при диссоциации карбоновых кислот ацилат-ионов RСО? самых стабильных органических анионов.
В ацилат-ионе отрицательный заряд за счет р,?-сопряжения распределен поровну между двумя атомами О, менее концентрирован, чем в RО. Фенолы по кислотности значительно превосходят спирты из-за безольного кольца.
Влияние органического радикала. Независимо от механизма передачи электроного влияния заместителя в радикале (индуктивный или мезомерный), электроакцепторные заместители способствуют делокализации отрицательного заряда, стабилизации анионы и тем самым увеличивают кислотность.
СН3СООН СН2СlСООН СНСlСООН — увеличение кислотности, при смещении галогена из?-положения в? по отношению к карбоксильной группе кислотность падает из-за затухания I-эффекта. В ароматическом ряду электродонорные заместители уменьшают кислотность фенолов и ароматических кислот, а электроакцепторные-увеличивают. Влиянеие оказывают заместители в орто- и пара-положениях.
Влияние растворителя. Стабильность зависит от его сольватации в растворе: чем более сольватирован ион, тем устойчевее. Сольватация тем больше, чем меньше размер иона и чем меньше делокализован в нем заряд. Сольватацияя – образование водородных связей с окружающими молекулами ратсворителя. В газовой среде — увеличивается с ростом длины и с увеличением разветвления радикала. В водном растворе наоборот.
В газовой среде-спирты сильнее чем вода, в водном — вода сильнее.
2.Амины — органические соединения. Строение и основность алифатических и ароматических аминов. Реакции распознования аминов (с азотистой кислотой и уксусным ангидридом).
Амины — соединения, котрые можно представить как производные аммиака, полученные заменой атомов Н на радикал.
Классификация: а) в зависимости от количества замещенных атомов Н — первичные, вторичные, третичные; б) в зависимости от природы органического радикала, амины деляться на алифатические, ароматические, смешанные, гетероциклические (гистамин).
Атом N в алифатических аминах имеет пирамидальное строение. Соединение с тремя различными заместителями у атома N хиральны, однако вследствие чрезвычайно легкой инверсии энантиомеры у аминов обычно не могут быть выделены. В ароматических аминах атом N имеет плоское строение, что связано с сопряжением пары n-электронов N с?-электронами безольного кольца. Амины достаточно полярны, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи. За счет водородных связей с водой амины хорошо в ней растворяются. Амины проявляют основные свойства за счет неподеленной электроной пары атома N, являются слабыми основаниями. На основность аминоввлияют природа радикала и их количество:
а)алифатические амины R-NН2, алкильный радикал (СН3-, С2Н5-, и т.д.) обладает +I-эффектом, увеличивая электонноую плотность атома N, увеличивая основные свойства. Изменение основных свойств NH3 CH3NH2 CH3-NH-CH3 усиление основных свойств алифатических аминов в водных растворах. Третичные амины в водных растворах имеют наименьшую основность из-за пространственных факторов и специфической гидратации.
б)ароматические амины — арильный радикал (С6Н5-) - уменьшает основность т.к. неподеленная электронная пара N учавствует в р-?-сопряжении с бензольным кольцом.
Итак, радикал увеличивает основность, Аr уменьшает, электроакцепторные заместители и сопряжение уменьшают, электродонорные увеличивают.
Реакции распознования: а) с НNО2 — реакция идентификации аминов
1)первичные алифатические амины — реакция дезаминирования, выделяется N2 и образуется спирт С2Н5NН2+НNО2=(условия NaNО2+Н2О)С2Н5ОН+N2+Н2О
2)первичные ароматические амины — реакция диазотирования С6Н5-NН2+НNО2=(при условии NaNO2+HCl) [C6H5N?N]Cl
3)вторичные (алифатические и ароматические) — реакция образования нитрозаминов
СН3-NH-CH3+H-O-N=O=(условие NaNO2+HCl) СН3-N-N?O+Н2О
|
СН3
4)третичный ароматичный амин СН3-N-C6H5+H-O-N=O =(те же условия) СН3-N-C6H5-N=O
| |
CH3 CH3
б)ацилирование аминов: реагенты RCOOH, RCOCl, (RCO)2O
CH3-NH2+CH3-COCl=CH3-NH-COCH3 N-метилацетамид
Основные свойства N значительно ослабевают, реакции используют для защиты NH2-группы
3.Аминокислоты с неполярными гидрофобными радикалами. Химические свойства за счет групп -NН2, -СООН и радикалов.
К ним относяться АК с алифатическим и ароматическим боковым радикалами. Это аланин, валин, лейцин,изолейцин, пролин, фенилаланин, триптофан, метионин.
Химические свойства за счет -СООН: кислотно-основные свойства образуется зарядов в кислых и щелочных средах. Заряды формируются в процессе гидролиза ионов.
Аланин+NaОН — натриевая соль аланина; аланин+NaОН — солянокислый аланин
Со свежеприготовленым Сu(ОН)2 все АК образуют в мягких условиях внутрикомплексные соли синего цвета.
За счет -NН2: а) реакция с ингиндрином — образуется уксусный альдегид, амиак, СО2
б) реакция 2,4-динитрофторомбензолом (ДНФБ)-используется для отщепления N-концевой АК образуется комплекс желтого цвета;
в) реакция с НNО2 используется для количественного определения NН2 группы по объему N2.
аланин+NaNO2+HCl — N2+молочная кслота и вода;
г) реакция карбоксилирования -NН2 приводит к получению двухосновной кислоты
д) формольное титрование — аланин+СН2=О -метиленаланин и вода
е)образование N-ацильных производных
ж)реакция используется для защиты NН2-группы при синтезе пептида. Реакция дезоминирования(удаление амино-группы в виде аммиака) аланин при окислении-аммиак и пировиноградная кислота; аланин при гидралитическом образуется аммиак и молочная кислота; аланин при внутримолекулярном — аммиак и акриловая кислота; аланин при восстановлении — аммиак и пропановая кислота;
За счет радикала: используется для индефикации АК — цистеин + Рb(СН3СОО)2 — осадок черного цвета цистеид свинца;
4.Осуществите превращения: акриловый альдегид — акриловая кислота — хлорпропионовая кислота-аланин.
СН2=СН-СОН+Сu(ОН)2 — СН2=СН-СООН+Cu2О+Н2О
СН2=СН-СООН+НСl — СН3-СНСl-СООН
СН3-СНCl-СООН+NH3 — СН3-СНNH2-СООН
Ъ
Билет№45
1.Влияние электронных эффектов и сопряжения на О-Н и S-Н кислоты.
На О-Н и S-Н кислоты оказывают влияние индуктивный эффект, при этом -I-эффект усиливает кислотность, +I-эффект ослабивает.
Стабилизация аниона за счет сопряжения. Пример действия этого фактора в группе ОН-кислот является повышение кислтности карбоновых кислот RСООН по сравнению со спиртами RОН. Объясняется образованием при диссоциации карбоновых кислот ацилат-ионов RСО? самых стабильных органических анионов.
В ацилат-ионе отрицательный заряд за счет р,?-сопряжения распределен поровну между двумя атомами О, менее концентрирован, чем в RО. Фенолы по кислотности значительно превосходят спирты из-за безольного кольца. Введение электроакцептров в кольцо усиливает кислотность.
2.Реакции дегидратации и дезаминирования?-,?-,?-окси и аминокислот. Причины устойчивости пяти- и шестичленных циклов.
?-окси и аминокислоты. При нагревании притерпивают межмолекулярную дегидратацию с образованием шестичленных кислород- и азотсодержащих гетероциклов — лактидов и дикетопиперазинов. R-C-OH =(при нагревании) R-C=O+HCOOH
|
COOH
?-окси и аминокислоты — внутримолекулярная элиминирование воды с образованием?,?-ненасыщенных кислот.
?-Гидромасляная СН3-СН(ОН)-СН2-СООН = СН3-СН=СН-СООН кротоновая кислота
?-аминомасляная СН3-СН(NН2)-СН2-СООН= СН3-СН=СН-СООН
?-окси и аминокислоты — при нагревании претерпивают внутримолекулярную дегидратацию с образованием лактонов и лактамов соответственно (см. Тюкавкина стр.259)
Дезаминирование: при удалении NН2-группы в виде аммиака происхдит у?-аминокислот с образованием оксикислот. СН
|
|
|


