 |
Использование трансгенных животных и растений для получения лекарственных препаратов белковой природы
|
|
|
|
Лекция № 12
Получение лекарственных препаратов белковой природы на основе методов генной инженерии
Получение инсулина.
Инсулин - гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний - сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин - небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника - препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую пространственную ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Со времени открытия инсулина в 1921 году Бантингом и Бестом, которые выделили гормон из поджелудочной железы новорожденного теленка и показали снижение уровня глюкозы в сыворотке крови экспериментального животного после введения препарата, прошло больше 80 лет. За это время была создана индустрия производства инсулина.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800 -1000 кг исходного сырья. Однако такой инсулин отличается по строению (аминокислотной последовательности) от инсулина человека и его использование напрямую малоэффективно. Например свиной инсулин отличается от человеческого на одну аминокислоту у С-конца В-цепи (аланин вместо треонина- на) Поэтому предварительно проводят химическую модификацию животного инсулина с целью придания ему структуры человеческого инсулина. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединение вместо него защищенного по карбоксильной группе остатка треонина, присутствуещего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.
|
|
|
Развитие с середины 1970-х годов технологии получения рекомбинантных ДНК значительно изменило характер исследований, проводимых в области генетики, молекулярной биологии и биотехнологии. Разработка методов изменения генетического аппарата клеток, позволяющих вводить в них чужеродные гены, клонировать их, экспрессировать и получать биосинтетические белки в необходимом количестве обеспечила возможность создания новой отрасли фармацевтической промышленности и обеспечения здравоохранения различными белковыми препаратами (инсулином, эритропоэтином, интерферонами и др.)
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli. Каждый из полученных синтетических генов последовательно подстраивался к 3 '-концу гена фермента (β-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные, рекомбинантные) белки, состоящие из фрагмента β-галактозидазы, соединенной через остаток метионина с А и В цепями инсулина. При обработке in vitro химерного белка бромцианом пептид А-В высвобождался и далее ферментативно расщеплялся на фрагменты А и В. Однако замыкание дисульфидных мостиков между несвязанными С-пептидом А и В-звеньями инсулина происходило с трудом и данный метод получения инсулина не получил своего развития.
|
|
|
Поэтому в дальнейшем был разработан метод получения проинсулина человека целиком, с последующей его трансформацией в инсулин in vitro. Для этого искусственно была синтезирована нуклеотидная последовательность кодирующая структуру проинсулина, которая затем была встроена в плазмиду к 3 '-концу гена β-галактозидазы. Трансформированные такими плазмидами клетки Е. coli синтезировали химерный белок, состоящий из фрагментов проинсулина и β-галактозидазы, который далее in vitro последовательно превращали в инсулин человека (рис.1.).

Получение соматостатина
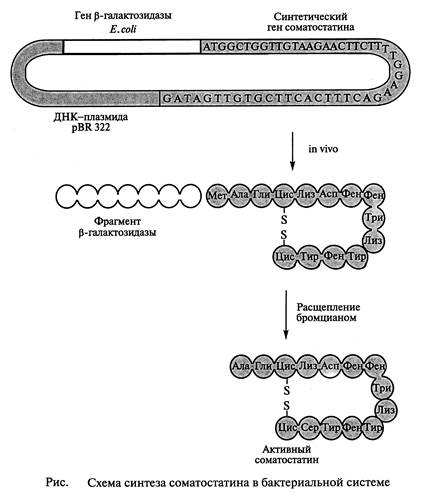
В Национальном медицинском центре “Хоуп” (Калифорния, США) был синтезирован гормон гипоталамуса – соматостатин. Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. Ученые из “Хоуп” осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем последовательного соединения тринуклеотидов, отвечающих определенной аминокислоте. Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coli или к β-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.
Основные этапы генно-инженерного синтеза соматостатина показаны на (рис.2.) Синтетический ген соматостатина был встроен в плазмиду pBR322 E. coli вблизи конца гена, кодирующего фермент β-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от β-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10 000 молекул на одну клетку. Из 100 г биомассы Е. coli, выращенной в ферментере объемом 8 л, удалось вьщепить 5 мг соматостатина, т.е. столько, сколько можно его вьщепить из 100 г овечьих мозгов.
|
|
|
СИНТЕЗ СОМАТОТРОПИНА
В ряду гормональных препаратов, получаемых биотехнологическими методами, особое место занимает соматропин – гормон роста человека (ГРЧ, рГРЧ). Нарушения роста у детей занимают третье место в структуре детской эндокринной патологии. Наиболее выраженные клинические проявления и тяжелый прогноз заболевания имеют дети, страдающие соматотропной недостаточностью.
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию - гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители - Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют молекулярную массу 22 кДа, другие являются димерами, а остальные - фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
|
|
|
Определение аминокислотной последовательности ГРЧ и клонирование его гена позволило уже в начале 80-х годов ХХ века получить первые препараты рекомбинантного ГРЧ (рГРЧ) для применения в медицинской практике.
Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метионина на H2N-концe молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д.Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, - с фен (—NH2) до лей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку. Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной био-
логической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетех» (Сан-Франциско, США) было начато широкомасштабное производство бактериального соматотропина.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагается, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
|
|
|
4. β-Эндорфин
β-Эндорфин - опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. β-Эндорфин получен в клетках Е. coli в виде гибридного белка с β-галактозидазой. Процедура синтеза β-эндорфина включала: получение путем обратной транскрипции мРНК - кДНК, кодирующей белок-предшест-венник, содержащий помимо последовательности β-эндорфина последователь-ность АКТГ и (β-липотропина (β-ЛТТ), в дальнейшем удаляемые. (β-Эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против β-эндорфина. От β-эндорфина человека генно-инженерный β-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
В 1978 г. сотрудниками Института биоорганической химии под руководством акад. Ю. А. Овчинникова был осуществлен синтез двух структур-ных генов, кодирующих синтез нейропептидов: лейцин-энкефалина и брадикинина.
Иммуномодуляторы
Иммуномодуляторы - это природные или синтетические препараты, способные оказывать регулирующее действие на функции иммунной системы; кроме того, их влияние распространяется на другие системы организма: сосудистую, нервную, эндокринную, кроветворную.
Иммуномодуляторы синтезируются клетками организма (цитокины, гормоны, биологически активные пептиды), их также получают путем биосинтеза или химического синтеза и применяют в качестве лечебных и профилактических средств при различных заболеваниях и трансплантации.
Интерлейкины получают, используя в качестве продуцентов культуры нормальных лимфоцитов или макрофагов, культуры Т-клеточных гибридов и рекомбинантные клетки микроорганизмов. Т-клеточные гибридомы -это продукты слияния Т-лимфоцитов, продуцирующих определенный интерлейкин, и опухолевых клеток, способных к неограниченному росту. В качестве рекомбинантных продуцентов используют Е. coli, Saccharomyces cerevisiae и другие микроорганизмы, в геном которых методами генетической инженерии введены гены, контролирующие синтез интерлейкина (ИЛ-1, ИЛ-2).
Колониеспшмулирующие факторы (КСФ) - это разновидность цитокинов с преимущественным действием на гемпоэз, служат факторами выживаемости и роста кроветворных предшественников. Рекомбинантные препараты КСФ (лейкомакс, молграстим, лейкоген, ленограстим) используют для нормализации подавленного гемопоэза и активации иммунной системы, в частности, на фоне цитотоксической терапии опухолей и индуцированной иммунодепрессии при трансплантации.
Среди цитокинов ранее всего в медицинскую практику вошли препараты интерферона, которые используют при вирусных и некоторых злокачественных заболеваниях.
Интерфероны (ИФН) - это группа белков и гликопротеинов, каждый из которых синтезируется определенными клетками организма и выполняет специфические функции. Известно около 20 природных ИФН, различающихся по структуре и биологическим свойствам: α-ИФН состоит из 12 подвидов, β-ИФН - из 3-4 подвидов, γ-ИФН - из 2-3 подвидов. Рекомбинантные ИФН также имеют разновидности.
Продуцентом α -ИФН являются лейкоциты периферической крови человека, которые культивируют на специальной среде в присутствии вируса -интерфероногена. Нативный ИФН выделяют из культуральной жидкости осаждением и хроматографией. Метод имеет ограниченное применение из-за необходимости использования большего количества донорской крови.
β-ИФН синтезируется в культуре фибробластов (клеток соединительной ткани человека) в присутствии в качестве интерфероногена двухцепочечной РНК.
γ -ИФИ - в культуре иммунных Т- или В-лимфоцитов, в том и другом случае с низким выходом, поэтому производство с использованием культур клеток человека - процесс дорогостоящий. Экономически оправдано получение ИФН с использованием рекомбинантных культур микроорганизмов: Bacillus subtilis, Pseudomonas aeruginosa, Saccharomyces cerevisiae. Очистку ИФН проводят методом аффинной хроматографии с использованием моноклональных антител.
Технологическая схема получения генно-инженерных интерферонов (как одна из возможных) принципиально сводится к следующему:
1. индукция синтеза и выделение интерфероновой мРНК из клеток,
2. получение кДНК, комплементарной интерфероновой мРНК из
лейкоцитов,
3. встраивание кДНК в плазмиду,
4. введение реконструированной плазмиды в клетки Е. coli,
5. размножение бактерий, содержащих реконструированную плазмиду, в
культуральной среде,
6. сепарирование клеток Е. coli,
7. дезинтеграция и экстракция клеток Е. coli,
8. осаждение (например, полиэтиленамином) с последующим центрифуги-
ованием,
9. высаливание интерферона из супернатанта сульфатом аммония
10. диализ осадка интерферона,
11. растворение интерферона, пропускание раствора через колонку с имму-
носорбентом (пришитыми моноклональными антителами),
12. элюция интерферона с последующей хроматографией на целлюлозном
катионообменнике.
Использование трансгенных животных и растений для получения лекарственных препаратов белковой природы
Применение методов генетической инженерии в животноводстве и растениеводстве открывает перспективу изменения ряда свойств организма: повышение продуктивности, резистентности к заболеваниям, увеличение скорости роста, улучшение качества продукции и др. Животных и растения, которые несут в своем геноме рекомбинантный (чужеродный) ген, принято называть трансгенными, а ген, интегрированный в геном реципиента, - трансгеном. Продукт этого гена (белок) является трансгенным. Благодаря переносу генов у трансгенных организмов возникают новые качества, а дальнейшая селекция позволяет закрепить их в потомстве и создавать трансгенные линии.
Введение чужеродной ДНК животным можно осуществить разными методами:
1) с помощью ретровирусных векторов, инфицирующих клетки эмбриона на ранних стадиях развития перед имплантацией эмбриона в самку-реципиента;
2) микроинъекцией в увеличенное ядро спермия (мужской пронуклеус) оплодотворенной яйцеклетки;
3) введением генетически модифицированных эмбриональных стволовых клеток в предимплантированный эмбрион на ранних стадиях развития.
У родившихся потомков исследуют экспрессию трансгена на уровне транскрипции и трансляции. Трансгенное потомство получают путем использования традиционных методов разведения животных.
Эксперименты по генетической модификации многоклеточных организмов путем введения в них трансгенов требуют много времени. Тем не менее трансгеноз стал мощным инструментом для исследования молекулярных основ экспрессии генов млекопитающих и их развития, для создания модельных систем, позволяющих изучать болезни человека, а также для генетической модификации
клеток молочных желез животных с целью получения с молоком важных для медицины белков. Был даже предложен новый термин «фарминг», относящийся к процессу получения из молока трансгенных домашних ("pharm") животных аутентичных белков человека или фармацевтических препаратов. Использование молока целесообразно потому, что оно образуется в организме животного в большом количестве и его можно надаивать по мере надобности без вреда для животного. Вырабатываемый молочной железой и секретируемый в молоко новый белок не должен при этом оказывать никаких побочных эффектов на нормальные физиологические процессы, протекающие в организме трансгенного животного, и подвергаться посттрансляционным изменениям, которые по крайней мере близки к таковым в клетках человека. Кроме того, его выделение из молока, которое содержит и другие белки, не должно составлять большого труда.
Молочная железа - великолепный продуцент чужеродных белков, которые можно получать из молока и использовать в фармацевтической и пищевой промышленности. Из молока трансгенных животных извлекают следующие рекомбинантные белки: человеческий белок С (антитромбин), антигемофильный фактор IX, α-1-антитрипсин, тканевой плазменный активатор, лактоферин, сывороточный альбумин, интерлейкин-2, урокиназу и химозин. В большинстве проектов, за исключением α-1-антитрипсина и химозина, эти исследования пока еще на стадии разработки и ведутся в основном на трансгенных мышах, поэтому оценивать их с точки зрения коммерческого интереса еще рано.
Вышесказанное можно проиллюстрировать следующими примерами. В США осуществлен метод микроинъекции ДНК, отвечающий за экспрессию β-лактоглобулина, который способен продуцироваться только в молочных железах животных. В Эдинбурге в 1992 г. были выведены трансгенные овцы с геном α-1-антитрипсина человека и β-глобулиновым промотором. Содержание этого белка у разных трансгенных овец составляло от 1 до 35 г/л, что соответствует половине всех белков в молоке. При таком уровне продукции белка может быть получено около 10 кг трансгенного белка от одного животного в год, что достаточно для 50 пациентов при лечении эмфиземы легких. Для сравнения, выход рекомбинантных белков в системах с использованием культуры клеток составляет обычно не более 200 мг/л. Следует заметить, что создание клеточных культур и их выращивание в промышленных реакторах, а также выведение трансгенных животных и их обслуживание - дорогие и сложные процедуры. Однако трансгенные животные легко размножаются, содержание их сравнительно дешево, что делает этих животных хорошими продуцентами разнообразных белков с низкой стоимостью. В России группой ученых под руководством Л. К. Эрнста получены трансгенные овцы с геном химозина, в 1 л молока которых содержится 200 - 300 мг химозина - основного компонента для производства сыра. Стоимость его будет в несколько раз ниже продукта, получаемого традиционным способом из сычугов молочных телят и ягнят. Приведены данные, свидетельствующие о высокой эффективности производства сыра с использованием химозина молока трансгенных овец. Так, из 3 л молока трансгенной овцы можно получить достаточное количество химозина для производства 1 т сыра из коровьего молока.
|
|
|


