 |
Лекарственные вещества, связанные с моноклоналъными антителами
|
|
|
|
Лекарственные вещества, проявляющие высокую активность при тестировании in vitro (обычно в культуре клеток), зачастую оказываются значительно менее эффективными in vivo. Кажущееся снижение их активности объясняется тем, что они не достигают органа или клетки-мишени в нужной концентрации. Увеличение дозы принимаемого препарата не решает проблему, поскольку при этом часто возникают побочные эффекты. Более того, чтобы избежать таких эффектов, многие терапевтические средства заведомо вводят в дозах, не достигающих оптимальных, что дополнительно снижает их эффективность. Для облегчения доставки лекарственного вещества к месту его действия можно использовать моноклональные антитела. Наиболее перспективными вариантами таких методов являются:
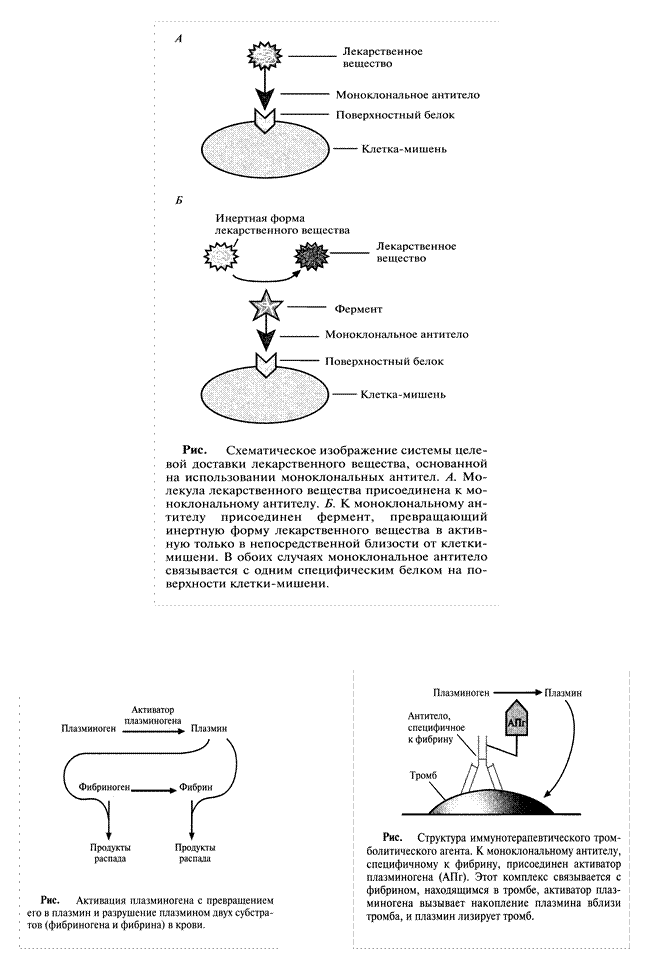
1.Присоединение молекул лекарственных веществ к моноклональным антителам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 4А).
2. Использование лекарственных веществ в неактивной форме, с после-дующим переводом их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют (коньюгируют) к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 4Б).
Для эффективной работы таких систем необходимо, чтобы:
а) моноклональное антитело, связанное с ферментом, переводящим лекарственное вещество в активную форму, было в достаточной степени очищено и имелось в нужном количестве;
б) связывалось с высокоспецифичным для клетки-мишени белком;
в) было стабильным в физиологических условиях, но в то же время быстро выводилось из кровотока;
|
|
|
г) при необходимости могло проникать в опухолевую ткань, обеспечивая действие препарата на все ее клетки.
В этом случае мишенями оказываются строго определенные клетки, что позволяет использовать лекарственное вещество в гораздо меньших дозах, чем при прямом введении. Применение в такой системе моноклональных антител мыши может приводить к развитию иммунного ответа, поэтому очень важно использовать фрагменты антител человека или антител, максимально сходных с ними по структуре.
Наиболее частой причиной смерти в странах Северной Америки и Европы является тромбоэмболия мозговых или сердечных артерий. Тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. В норме молекулы фибрина в образовавшемся тромбе расщепляются с помощью плазмина сериновой проте-иназы, который образуется из плазминогена под действием активатора (рис.5). Однако нередко эта биологическая система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена в качестве терапевтического средства.
Однако плазмин способен разрушать и предшественник фибрина фибриноген (рис.5), и если уровень последнего в результате терапии с использованием активатора плазминогена снизится слишком сильно, могут произойти обширные внутренние кровотечения. Это привело к необходимости создания тромболитических препаратов, разрушающих только фибрин в тромбе. Ученые исходили из того, что если к активатору плазминогена «пришить» антитело, специфичное к фибрину, то будет происходить только локальное повышение концентрации плазмина вблизи тромба (рис.6). Для проверки этой гипотезы тканеспецифичный активатор плазминогена был присоединен к моноклональному антителу, специфичному в отношении фибрина. Испытания на модельных системах показали, что комплекс присоединялся к сгусткам крови и лизировал их, не вызывая значительного разрушения фибриногена. Были созданы и другие типы конъюгатов антитело - активатор плазминогена, тоже приводящие к локальному образованию плазмина, разрушающего кровяные сгустки.
|
|
|
1.7. Профилактика отторжения трансплантированных органов
В 1970-х гг. были пересмотрены взгляды на пассивную иммунизацию: ее стали считать профилактическим средством борьбы с отторжением трансплан-тированных органов. Предлагалось вводить пациентам специфические антитела, которые будут связываться с лимфоцитами определенного типа, уменьшая иммунный ответ, направленный против пересаженного органа.
Первыми веществами, рекомендованными Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) для использования в качестве иммуносупрессоров при пересадке органов у человека, были моноклональные антитела мыши ОКТЗ. За отторжение органов отвечают так называемые Т-клетки - лимфоциты, дифференцирующиеся в тимусе. ОКТЗ связываются с рецептором, находящимся на поверхности любой Т-клетки, который называется CD3. Это предупреждает развитие полного иммунного ответа и отторжение трансплантированного органа. Подобная иммуносупрессия весьма эффективна, хотя и оказывает некоторые побочные действия, например, вызывает лихорадку и приводит к появлению сыпи.
Системы ДНК-диагностики
Информация обо всем многообразии свойств организма заключена в его генетическом материале. Так, патогенность бактерий определяется наличием у них специфического гена или набора генов (гены вирулентности), а наследственное генетическое заболевание возникает в результате повреждения определенного гена. Сегмент ДНК, детерминирующий данный биологический признак, имеет строго определенную нуклеотидную последовательность и может служить надежным диагностическим маркером.
В основе многих быстрых и надежных диагностических методов лежит процесс гибридизация нуклеиновых кислот - спаривание двух комплементарных одноцепочечных сегментов разных молекул ДНК. Процедура в общих чертах состоит в следующем.
|
|
|
1. Разрушение биологического образца (клетки, ткани), выделение молекул ДНК
и их разрушение до одноцепочечных фрагментов.
2. Фиксация одноцепочечной ДНК - мишени на твердой подложке, например
мембранном фильтре или на поверхности лунки.
3. Обработка подложки раствором, содержащим меченые одноцепочечные
молекулы ДНК-зонда, которая при определенных условиях (температуре и рН раствора) спаривается с ДНК-мишенью.
4. Промывка фильтра для удаления избытка несвязавшихся молекул ДНК-зонда.
5. Детекция гибридных молекул ДНК-зонд/мишень.
В диагностических тестах, основанных на гибридизации нуклеиновых кислот, ключевыми являются три компонента: ДНК-зонд, ДНК-мишень и метод детекции гибридизационного сигнала. Система детекции должна быть в высшей степени специфичной и высокочувствительной.
Весьма желательно, чтобы ДНК-диагностику можно было проводить на исходном материале, без дополнительного его культивирования или выделения нуклеиновых кислот, особенно в тех случаях, когда тестируются клинические образцы. Исследователи с успехом проводят гибридизацию с ДНК-мишенями, присутствующими в образцах кала, мочи, крови, смывах из зева и в тканях без предварительной их очистки. Если концентрация последовательности-мишени в исследуемом образце слишком мала, ее можно амплифицировать (увеличить,наработать) с помошью метода полимеразной цепной реакции (ПЦР).
Получены и охарактеризованы более 100 различных ДНК-зондов, позволяющих обнаруживать патогенные штаммы различных бактерий, вирусов и паразитических простейших. Так, имеются зонды для диагностики бактериальных инфекций человека, вызываемых Legionella pneumophila (респираторные заболевания), Salmonellatyphi (пищевые отравления), Campylobacter hyoin-testinalis (гастриты), а также для выявления энтеротоксичного штамма Escherichia coli (гастроэнтериты). Однако это лишь «верхушка айсберга»; в принципе с помощью гибридизации можно выявлять практически любые патогенные микроорганизмы.
|
|
|
Примеры ДНК-диагностики
Диагностика малярии
В качестве примера использования ДНК-зондов для диагностики заболеваний можно привести процедуру обнаружения Plasmodium falciparum. Этот паразит вызывает малярию, заболевание, угрожающее примерно трети всего населения Земли. Он инфицирует эритроциты и разрушает их, что приводит к развитию лихорадки, а в тяжелых случаях — к поражению мозга, почек и других органов. Чтобы выявить источники инфекции, оценить эффективность мер по их ликвидации и обеспечить раннюю диагностику и лечение, необходимы достаточно чувствительные, простые и недорогие методы. В настоящее время малярию диагностируют с помощью микроскопического исследования мазков крови - эффективного, но трудоемкого и занимающего много времени процесса. Иммунологические методы обнаружения Plasmodium, такие как ELISA, достаточно быстрые и их легко автоматизировать, но с их помощью нельзя отличить текущую инфекцию от прошедшей, поскольку при этом определяется только наличие антител к Plasmodium в крови больных.
Для избирательной ДНК-диагностики текущей инфекции, т. е. для выявления ДНК возбудителя, в качестве основы используются высокоповто-ряющиеся последовательности ДНК P. falciparum. В качестве специфического зонда выбирается последовательность, гибридизующаяся с ДНК P. falciparum, но не с ДНК P. vivax, P. cynomolgi или с ДНК человека. С его помощью можно обнаружить всего 10 пг очищенной ДНК Plasmodium falciparum или 1 нг той же ДНК в крови больного.
|
|
|


