 |
Теоретические основы получения вторичных метаболитов
|
|
|
|
ЛЕКЦИЯ №4
Принципы получения вторичных метаболитов существенно отличаются от первичных и основаны на особенностях их образования клетками живых организмов.
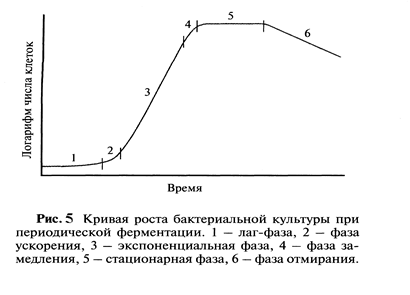
В ходе нормального жизненного цикла любая клеточная культура проходит ряд этапов или стадий, характеризующихся определенными параметрами (концентрация клеток, питательных веществ и продуктов метаболизма, скорость роста (размножения) и отмирания). График зависимости концентрации клеток от времени культивирования (кривая роста) обычно имеет следующий вид и включает:
1) Lag-фазу, или фазу задержанного роста. На этой стадии, внесенные в питательную среду, клетки не делятся, а постепенно адаптируются к новой среде обитания. Эта адаптация заключается в насыщении культуральной среды некоторыми продуктами их метаболизма, определенная концентрация которых необходима для запуска процессов клеточного деления. Совокупность этих метаболитов называют “ кондиционирующим фактором ” а процесс их накопления- кондиционированием среды;
2) фазу ускорения – когда адаптация закончилась и клетки начинают интенсивно делиться;
3) Log-фазу, характеризующаяся интенсивным, ускоренным делением клеток и сбалансированностью роста всей популяции;
4) фазу замедленного роста, связанную с исчерпанием питательных субстратов и накоплением токсических продуктов метаболизма;
5) Const- фазу или стационарную фазу, при которой прирост новых клеток количественно равняется числу погибающих, а плотность клеточной популяции (концентрация) достигает максимального значения;
6) фазу отмирания, характеризующуюся прогрессирующей гибелью клеток, которая вызвана исчерпанием питательных веществ и отравлением их большими количествами продуктов метаболизма.
|
|
|
Синтез первичных метаболитов происходит на всех стадиях, а уровень их синтеза определяется, в основном, количеством клеток и наличием питательных веществ.
Более сложный характер имеет синтез так называемых вторичных метаболитов.
Синтез вторичных метаболитов фазоспецифичен и происходит не всегда, а лишь в определенных условиях, обычно неблагоприятных для клеток. Если взглянуть приведенную выше кривую роста, то можно предположить, что синтез таких соединений возможен начиная с конца Log-фазы и до конца фазы отмирания. Именно в это время происходит исчерпание основных компонентов питательной среды и одновременно происходит накопление в среде избыточных количеств продуктов первичного метаболизма, обычно весьма токсичных в больших концентрациях для клеток. Данную ситуацию для клеток можно охарактеризовать как стрессовую. Это приводит к дезорганизации нормального метаболизма и как следствие к прекращению размножения клеток. Предполагается, что в этих условиях некоторые продукты первичного метаболизма могут выступать в качестве индукторов или дерепрессоров генов, кодирующих синтез ферментов вторичного метаболизма. Согласно другому предположению гены вторичного метаболизма подвержены катаболитической репрессии продуктами разложения глюкозы, исчерпание которой снимает репрессию. Такой этап несбалансированного роста, сопровождающийся синтезом вторичных метаболитов называется идиофазой, а продукты – идиолитами. Среди вторичных метаболитов ведущее место по объему производства занимают антибиотики, стероиды и алкалоиды. Такие соединения как аминокислоты, кислоты цикла Кребса, глицерин, формально являются первичными метаболитами, однако их избыточное образование и накопление возможно, как мы уже говорили, только в условиях нарушения нормального метаболизма клеток. Поэтому фактически, в этом случае, они тоже являются идиолитами.
|
|
|
Процесс промышленного биосинтеза идиолитов проходит две фазы или стадии (двустепенчатое культивирование), резко различающиеся по условиям проведения. Во время первой фазы (трофофазы) основной задачей является накопление максимально возможного количества биомассы, которая выращивается на среде оптимальной для роста данного микроорганизма (ростовая среда). Из экономических и технологических соображений эта фаза должна быть максимально быстрой, а питательная среда дешевой и содержать легко усваиваемые субстраты (глюкоза, фруктоза). На второй фазе создаются условия обеспечивающие запуск и активный синтез вторичного метаболита. На этой фазе ферментацию обычно ведут на так называемой продуктивной среде, которая по своему составу значительно отличается от ростовой, т.к. содержит, в основном, трудноусваиваемые углеводы. Переключение клеток с легко усваиваемых субстратов (глюкоза) на более сложные (лактоза, сахароза) требует синтеза большого количества новых индуцибельных ферментов, что является для клеток “встряской”, аналогичной той, которую может испытать человек при резком торможении или маневре на автомобиле, который двигался с большой скоростью. Наработанная на первом этапе (в трофофазе) клеточная культура может быть перенесена (пересеяна) на продуктивную среду в другом аппарате или культивирование может осуществляться на сложных питательных средах, содержащих как легкоусваиваемые, так и трудноусваиваемые компоненты. Поскольку в структуру молекул многих вторичных метаболитов кроме углерода, водорода и кислорода входит значительное количество азота, серы, фосфора, то в состав продуктивных сред обязательно нужно добавлять в необходимых количествах нитраты, соли аммония и фосфорной кислоты и другие микроэлементы. Существует целый ряд физических (температура, рН, освещение светом определенной длины волны и интенсивности) и химических (добавление веществ-предшественников, поддержание определенной, обычно высокой концентрации кислорода) факторов благоприятствующих синтезу вторичных метаболитов.
|
|
|
Получение антибиотиков
В мире ежегодно производится антибиотиков более чем на 20 млрд. долларов. К числу антибиотиков относятся важнейшие противомикробные и противоопухолевые препараты. Открытие антибиотиков произвело переворот в лечении инфекционных заболеваний. Ушли в прошлое представления о неизлечимости многих бактериальных инфекций (чума, туберкулез, сепсис, сифилис и др.). Антибиотики применяют в ряде отраслей народного хозяйства (растениеводство, животноводство, ветеринария, пищевая промышленность и др.), где они используются не менее широко, чем в медицине. Организация крупномасштабного производства антибиотиков сыграла решающую роль в становлении промышленной биотехнологии.
К антибиотикам относятся низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток. Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами. Антибиотики, продуцируемые растительными объектами, называют фитонцидами.
Вопрос о физиологических функциях антибиотиков, их месте в метаболизме и процессах эволюции окончательно не решен. Антибиотики возникли в борьбе за существование почвенных биоценозов, поэтому многие из них служат средствами нападения и защиты, т.е. представляют собой своеобразное химическое «оружие» клетки. Однако эти функции у антибиотиков не единственны. Известно, что они могут участвовать в процессах детоксикации вредных метаболитов, контролировать некоторые стороны обмена веществ и целые процессы развития, например, дифференцировку клеток, служить запасными питательными веществами. Некоторые исследователи рассматривают антибиотики как случайные вещества, обладающие полезными свойствами, другие считают их реликтовыми молекулами, вытесненными в ходе эволюции продуктами рибосомального синтеза, но и до сих пор сохранившими способность вмешиваться в биохимические процессы.
Способность нитчатого гриба зеленой плесени Penicillium notatum вызывать гибель микроорганизмов впервые была установлена в 1928 г. английским микробиологом А. Флемингом. Однако лечебные свойства этой плесени были описаны еще в 1871 г. русским дерматологом А. Г. Полотебновым. Количество открываемых антибиотиков постоянно растет. В 1940г. было известно всего 6 антибиотиков, а в настоящее время описано более 12000 аналогичных соединений, из которых в клинике применяют около 200 препаратов. 97% известных антибиотиков токсичны, поэтому в практике не используются. В химическом отношении они представляют сборную группу органических веществ. В зависимости от химической природы и ряда других свойств известные антибиотики делят на ряд классов:
|
|
|
1. β-Лактамные (пенициллины, цефалоспорины) составляют более 50 % рынка антибиотиков.
2. Тетрациклины (тетрациклин, морфоциклин, метациклин).
3. Макролиды (эритромицин, олеандомицин).
4. Аминогликозиды (гентамицин, амикацин).
5. Гликопептиды (ванкомицин, ристомицин).
6. Амфениколы (левомицетин).
7. Линкосамиды (линкомицин).
8. Полиеновые [противогрибковые (нистатин, леворин)].
9. Противоопухолевые (блеомицин) и др.
Большой вклад в установление структуры ряда антибиотиков внесли М.М.Шемякин, Ю.А.Овчинников, В.Т.Иванов, АС. Хохлов, Г.Б.Локшин, М.Н.Ко-лосов, Ю.А.Берлин, Е.С.Есипов, АД.Кузовнов.
По типу действия антибиотики делят на бактерицидные (лактамные, аминогликозиды), вызывающие гибель микроорганизмов, и бактериостатические (макролиды, тетрациклины, левомицетин), нарушающие способность микро-организмов делиться. По спектру действия различают антибиотики узкого и широкого действия. К последним относят тетрациклины, макролиды, амино-гликозиды, которые особенно полезны в случае неидентифицированных возбудителей болезни, однако при длительном применении они вызывают у пациентов дисбактериоз.
В последние годы достигнуты большие успехи в расшифровке молекуляр-ного механизма действия антибиотиков. Наиболее яркая особенность антиби-отиков - исключительная специфичность их действия. По выражению П. Эрлиха, антибиотики - это магические пули. Специфика действия их состоит в избиратель-ном подавлении этими эффекторами одного или нескольких процессов лишь у некоторых микроорганизмов. Это обусловлено тем, что антибиотики блокируют определенные метаболитические мишени в клетках. В зависимости от специфики действия антибиотиков на молекулярном уровне различают следующие группы соединений, вызывающие у бактерий:
1) нарушение биосинтеза пептидогликанов клеточной стенки (пенициллины, ванкомицин, цефалоспорины);
2) нарушение отдельных этапов процессов трансляции (амфениколы, аминоглико-зиды, тетрациклины, макролиды, линкосамиды);
|
|
|
3) повреждения цитоплазматической мембраны (грамицидин, полимиксины);
4) нарушение биосинтеза нуклеиновых кислот (рифамицины, актиномицин D, противоопухолевые антибиотики);
5) нарушение энергетического обмена (олиглмицин, хлоргексидин).
Антибиотики широко используют в качестве молекулярных инструментов при исследовании фундаментальных проблем биологии, таких, как расшифровка тончайших механизмов биосинтеза белка, нуклеиновых кислот и структуры клеточных стенок бактерий, создание моделей транспорта ионов через биологические мембраны и др.
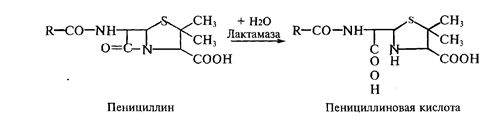
Изыскание новых антибиотиков обусловлено как потребностями медицинской практики, так и накоплением резистентных форм микроорганизмов по отношению ко многим широко используемым антибиотикам. Так устойчивость бактерий к пенициллинам и цефалоспоринам обусловливается наличием в их клетках фермента лактамазы (пенициллиназы). Фермент гидролизует амидную связь β-лактамного цикла в молекуле антибиотика с образованием пенициллиновой или цефалоспорановой кислоты, которые полностью лишены антимикробной активности:
Специальное изучение объема и потенциала защитных свойств микро-организмов показало, что их резистентность к антибиотикам имеет глобальный характер и обеспечивается как разнообразием фенотипов резистентности (наличием большого количества различных ферментов, способных разрушать или дезактивировать молекулы антибиотиков), так и разнообразием и стабильностью систем горизонтального генного транспорта (перенос плазмид несущих гены резистентности из клетки в клетку в пределах популяции). Поэтому сейчас главное направление получения новых антибиотиков состоит не в открытии новых соединений, а в химической трансформации природных молекул для создания полусинтетических антибиотиков, характеризующихся значительно меньшей резистентностью и токсичностью, но более широким спектром действия, большим временем жизни, химической и биологической устойчивостью. Другим перспективным подходом является глубокое изучение механизмов множественной лекарственной устойчивости (МЛУ) и поиск препаратов ингибирующих ее. Примером таких природных ингибиторов β-лактамаз являются клавулановая и оливановая кислоты. Такие комбинированные препараты, содержащие антибиотик и ингибитор бактериальной резистентности к нему, обладают гораздо более высокой эффективностью.
Методы получения антибиотиков путем химического синтеза чрезвычайно сложны и не могут конкурировать с их биосинтезом методами биотехнологии. Существует несколько способов получения как природных, так и полусинте-тических антибиотиков.
Основной способ получения - направленный биосинтез антибиотиков, осуществляется путем культивирования (прямой ферментации) подходящего микроорганизма - продуцента. Точный механизм индуцирования первичными метаболитами генов, кодирующих синтез ферментов вторичного метаболизма, до конца не расшифрован, однако известно, что биосинтез антибиотиков, как и любых других вторичных метаболитов, начинается в фазе замедленного роста клеточной популяции (конец трофофазы) и достигает максимума в идиофазе. Считают, что в конце трофофазы (середина и конец стационарной фазы) в клетках и культуральной среде происходит накопление избыточных количеств продуктов первичного метаболизма, некоторые из которых выступают в роли индукторов вторичного метаболизма, освобождающих гены вторичного метаболизма из-под влияния катаболитной репрессии. Другим, важным стрессовым фактором, индуцирующим гены вторичного метаболизма, является резкое уменьшение содержания или полное исчерпание в питательных средах легкоусваиваемого компонента - глюкозы, что заставляет клетки переключаться на усвоение более сложных субстратов (другие моносахариды, дисахариды, полисахариды). Необходимость синтеза большого количества индуцибельных ферментов в условиях нехватки питания и как следствие промежуточных метаболитов, существенно дезорганизует процессы нормального метаболизма и запускает различные механизмы адаптации, в том числе и синтеза антибиотиков.
Специальные опыты показали, что выход цефалоспорина С уменьшается при переходе от использования в качестве источника углерода сахарозы к быстро усваиваемому углеводу глюкозе. Наиболее оптимальной средой для образования антибиотика культурой Streptomyces antibioticus оказалась смесь 0,1 % глюкозы и 1 % галактозы. При таком соотношении моносахаридов глюкоза быстро утилизируется и микроорганизм переключается на усвоение галактозы, что и инициирует идиофазу.
Биосинтез антибиотиков может дополнительно стимулироваться за счет других стрессовых воздействий (изменение температуры, рН и др.), а так же добавлением в культуральную среду некоторых веществ, которые называют предшественниками. Молекула вещества – предшественника (обычно достаточно простая по строению) может является структурным фрагментом молекулы антибиотика или быть промежуточным метаболитом в его синтезе. Установлено, что синтез этой молекулы является обычно самой медленной, лимитирующей стадией всего многостадийного синтеза молекулы антибиотика.
Например, производство бензилпенициллина в значительной степени стимулируется добавками фенилуксусной кислоты, которая является структурным фрагментом молекулы бензилпенициллина; пропионовая кислота и пропиловый спирт инициируют биосинтез макролидов через метил-малонил-КоА; L-фенилаланин - ускоряет образование грамицидина S.
Молекулы предшественника (например, фенилуксусной кислоты) необходимо добавлять в среду культивирования в период завершения фазы роста культуры микроорганизма – продуцента бензилпенициллина (на 2-3 сутки для 5-суточного процесса).
Еще одним веществом, добавление которого в культуральную среду резко увеличивает выход пенициллинов является α-аминоадипиновая кислота. Это объясняется тем, что многие антибиотики берут свое начало от промежуточных соединений обмена первичных метаболитов, поэтому их биосинтез регулируется путем ретроингибирования. Так, биосинтез пенициллина культурой гриба Penicilliumchrysogenum контролируется по принципу обратной связи L-лизином. Этот эффект объясняется тем, что биосинтез как пенициллина, так и лизина осуществляется через общий предшественник α-аминоадипиновую кислоту (см. схему ниже). Торможение лизином первого фермента биосинтеза – гомоцитрат-синтетазы - приводит к недостатку α-аминоадипиновой кислоты, что снижает общий выход антибиотика.

Добавление в питательную среду α-аминоадипиновой кислоты предотвращает ингибирующий эффект лизина и активирует биосинтез пенициллина в присутствие лизина. Кроме ретроингибирования биосинтез многих антибиотиков тормозится высокими концентрациями своих же антибиотиков. Следует отметить, что в процессе эволюции микроорганизмы выработали различные механизмы защиты от действия собственных антибиотиков.
Хороший эффект дает ингибирование некоторых конечных стадий биосинтеза антибиотика. Так, при культивировании в условиях дефицита аниона хлора микроорганизм S. аиrео-faciens образует тетрациклин, а не хлортетрациклин, а при ингибировании реакции метилирования им синтезируется деметилированное производное хлортетрациклина.
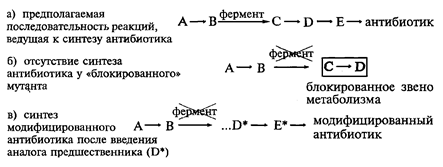
Другой способ получения антибиотиков (мутасинтез) состоит в использовании для их биосинтеза так называемых “блокированных” мутантов, у которых в результате мутации изначально отсутствует (блокировано) определенное звено в цепи реакций, ведущих к синтезу антибиотика. Такие блокированные мутанты не способны образовывать молекулу антибиотика целиком. Получение таких мутантов осуществляется обычно методами генной инженерии и будет более подробно рассмотрено в соответствующем разделе курса. Сущность метода состоит в том, что в питательную среду, где осуществляется культивирование таких блок-мутантов, в идиофазе вводят различные мутасинтоны D* (вещества близкие по структуре соединению D, синтез которого блокирован). Поскольку для ферментов вторичного метаболизма характерна низкая субстратная специфичность, то эти аналоги блокированного предшественника антибиотика могут быть трансформированы ферментной системой клеток блок-мутантов в аналоги самого антибиотика – вещества E*. Этот процесс носит название мутационный биосинтез, или мутасинтез:
Подходящие мутасинтоны могут быть получены методами химического синтеза или биосинтеза.
Большой интерес как исходные вещества (синтоны, билдинг-блоки, темплейты, шаблоны) для синтеза различных модификаций природного антибиотика представляют продукты его неполного синтеза В. Используя методы биотрансформации и химического синтеза в такие молекулыможно вводить разнообразные фрагменты, отличные от того, который имелся в природной молекуле.
Так, мутанты Nocardia mediterranei, у которых нарушена способность к алкилированию, образуют аналог предшественника рифамицина β - рифамицин SV, который служит исходным веществом для получения многих синтетических рифамицинов (препараты для лечения туберкулеза и проказы).

рифамицин В рифамицин SV рифамицин L
Иногда активностью могут обладать и сами продукты неполного синтеза некоторых антибиотиков (получение различных производных эритромицина).
Третий способ – получение гибридных антибиотиков, основан на использовании генетических гибридов продуцентов. В клетках таких микроорганизмов присутствуют ферменты, катализирующие одновременный параллельный синтез нескольких близких по структуре антибиотиков целиком или их отдельных частей. Вследствие низкой субстратной специфичности этих ферментов возможен “перехват” ферментами одного пути синтеза промежуточных метаболитов другого процесса. В результате может образоваться новый антибиотик, структура которого будет близка, но полностью не похожа ни на один из исходных антибиотиков. Примером является синтез различных антибиотиков актинородинового ряда (см. раздел “Генная инженерия”).
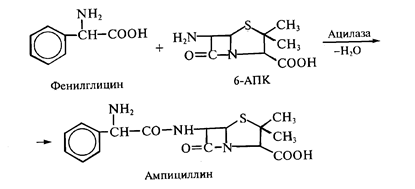
Четвертый способ заключается в биотрансформации природных антибиотиков или синтетических структур, с целью получения более активных соединений. Особенно успешны подобные разработки в области биосинтеза полусинтетических пенициллинов и цефалоспоринов. Получение новых более эффективных аналогов пенициллина основано на изменении природы его ацильной группировки при сохранении в неизменном виде ядра пенициллина - 6-аминопенициллановой кислоты (6-АПК). Структура 6-АПК очень неустойчивой к действию кислот и щелочей, поэтому ее получение путем химического гидролиза пенициллинов приводит к большим потерям продукта и очень невыгодно. Более удобным является гидролиз в мягких условиях природных пенициллинов с помощью специфического фермента - пенициллинацилазы, образующейся с высоким выходом в процессе ферментации ряда штаммов микроорганизмов. Именно этот способ наиболее широко применяется сейчас в промышленности. Ацилазы различают по их субстратной специфичности. Поскольку реакции гидролиза амидов и сложных эфиров являются обратимыми, то некоторые из ацилаз способны катализировать и обратные реакции - процессы ацилирования аминогруппы 6-АПК с образованием модифицированного пенициллина. Таким путем, а так же используя химический синтез, было получено более 40 000 полусинтетических пенициллинов. Во многих случаях 6-АПК не выделяют из культуральной жидкости, например при превращении бензилпенициллина в ампициллин, что значительно удешевляет процесс за счет снижения потерь и уменьшения числа операций:
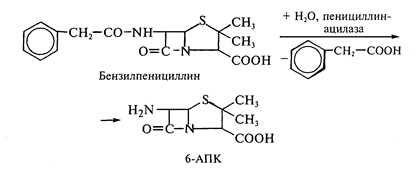
Так, полученный путем прямой ферментации бензилпенициллин гидролизуют ацилазой мутантного штамма Kluyvera citrophila при рН 7,8 - 8,0 и температуре 40-50 °С. Затем в ферментер вносятся клетки другого мутанта - Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0 - 5,5), чтобы ацилаза второго мутантного микроорганизма осуществляла синтез ампицилина:
Получение препаратов антибиотиков сложный и многоступенчатый процесс, который можно свести к следующим основным этапам:
1.изыскание микроорганизмов-антагонистов в природе и выделение их в чистую культуру;
2. изучение спектра действия и определение антибиотической активности выделенных культур;
3. подбор условий культивирования;
4. первичная идентификация антибиотика;
5. выделение и химическая очистка антибиотика, а так же сравнение полученного антибиотика по биологической активности с уже известными препаратами;
6. изучение механизма действия, биологические и клинические испытания;
7. Получение из исходных, природных культур новых более высокопроизводительных штаммов;
8. разработка лабораторной технологии получения антибиотика, создание опытных и пилотных установок;
9. разработка промышленной технологии;
Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами. Некоторые из этих организмов способны продуцировать большое количество антибиотиков. Так, 6 родов филаментозных грибов производят около 1000 различных антибиотиков, в том числе пенициллин и цефалоспорин, а три рода актиномицетов - 3000 антибиоти-ков. Среди актиномицетов наибольший вклад вносит род Streptomyces, один из видов которого - S. griseus синтезирует более 50 антибиотиков. Среди этих микроорганизмов проводится активная селекционная работа по выведению более высокопроизводительных штаммов. Исследования показали, что в процессе образования антибиотиков задействовано значительное число генов. Массовая расшифровка первичной структуры геномов микроорганизмов показала, что эта величина равна 1 - 2 %. Например, у Bacillus subtilis число таких генов достигает 2 %. Это обстоятельство затрудняет анализ путей биосинтеза антибиотиков и идентификацию отдельных мутаций, способных увеличить выход продукта, а значит, работы в этой области до сих пор идут в значительной степени наугад. Успехи генной инженерии в получении новых антибиотиков и высокопроизводительных штаммов продуцентов, а так же имеющиеся проблемы будут рассмотрены нами в разделе “Генная инженерия.” Однако большинство известных в настоящее время высокопродуктивных штаммов продуцентов антибиотиков все же получено традиционными методами мутагенеза и селекции.
По объему выпускаемой продукции промышленное производство антибиотиков является одним из самых крупных биотехнологических производств. Процесс протекает в аэробных условиях и является очень энерго- и материалоемким.
Большинство антибиотиков получают путем периодического глубинного культивирования соответствующего продуцента в аэробных условиях в реакторах большого объема (20-200л). Период культивирования (ферментации) длится 7-10 суток. В последние годы внедряются полунепрерывные и непрерывные процессыферментации. Технология завершающих стадий процесса (очистки и выделения) определяется природой антибиотика, характером производства и целями дальнейшего использования антибиотиков. Для медицинских целей технология выделения и очистки имеет особое значение. Обычно она включает сложные многоступенчатые комбинации различных операций: экстракцию антибиотиков подходящими растворителями, осаждение и перекристаллизацию их из разных сред, фракционирование на ионообменных смолах, лиофильную и распылительную сушку готовых препаратов. Антибиотики выделяют или в виде сравнительно неочищенных препаратов (натриевая соль пенициллина), или в виде высокоочищенных веществ (прокаиновая соль пенициллина), предназначенных для клинического использования. Выход антибиотиков обычно составляет несколько десятков граммов на 1 л.
Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру лишь антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год, из которых 300 тыс. т приходится наглутамат натрия, 100 тыс. т на лизин и 140 тыс. т на метионин. Однако указанный объем — лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: для лизина - 5, метио-нина - 4, треонина - 3,7 и триптофана - 2.
Аминокислоты — структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, ряда гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений (пурины, пиримидины, гем и пр.). В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислота-ми и должны поступать в организм с пищей. Недостаток каждой из этих амино-кислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития.
Пищевая ценность белка определяется сравнением доли незаменимых аминокислот в пище с этим же показателем при адекватном питании. Чем ближе обе величины, тем выше качество белка. Белки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Многие белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы - лизином и триптофаном. Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет балансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2-4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15 - 20 %, выход продукции увеличивается на 20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу.
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
глицин - подсластитель, антиоксидант, бактериостатик;
1.аспарагиновая кислота - усилитель вкуса, сырье для синтеза аспартама;
2.глутаминовая кислота - усилитель вкуса, препарат для лечения психических заболеваний;
3.гистидин - противовоспалительное средство;
4.метионин - пищевая и кормовая добавки;
5.цистеин - фармацевтический препарат;
6.треонин и триптофан - пищевые и кормовые добавки;
7.фенилаланин - сырье для получения аспартама;
8.лизин - пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В промышленных масштабах белковые аминокислоты получают:
1) гидролизом природного белоксодержащего сырья;
2) химическим синтезом;
3) микробиологическим синтезом;
4) биотрансформацией предшественников аминокислот с помощью микроорга-низмов или выделенных из них ферментов (химико-микробиологический метод).
При гидролизебелоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 — 105 °С в течение 20 — 48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10-30%). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролизатов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
Существенный недостаток методов химического синтезааминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-aминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот - дорогая и чрезвычайно трудоемкая процедура.
Наиболее перспективен и экономически выгоден микробиологическийсинтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот микробиологическим способом стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду определенные количества какой-либо одной аминокислоты (С. Киносита, 1955). При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов если и продуцировали аминокислоты во внешнюю среду, то в очень незначительных количествах. Это не удивительно, поскольку аминокислоты являются важнейшими промежуточными метаболитами в синтезе белков, а в избыточных количествах токсичны для продуцирующих клеток. Поэтому их синтез в клетках бактерий подчиняется принципу жесткой экономии внутриклеточных ресурсов и оптимизирован в процессе эволюции. Избыточное накопление аминокислот в клетках возможно только в условиях нарушения нормального метаболизма, т.е. нахождения клеток продуцента в состоянии идиофазы. Поэтому, формально являясь первичными метаболитами, промышленно получаемые аминокислоты фактически являются вторичными метаболитами. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % - дрожжи, 30 % - стрептомицеты, 20 % - бактерии и 10 % - микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов — Corynebacterium glutamicum обладал способностью к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Японии (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе акад. А. А. Александрова.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Для получения мутантных штаммов используют как традиционные методы селекции и мутагенеза, так и методы генной инженерии. Распространенные объекты селекции продуцентов — микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter.
Разработка технологической схемы получения той или иной отдельной аминокислоты должно базироваться на максимально точном знании путей и механизмов регуляции ее биосинтеза. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава среды и условий культивирования.
Производство лизина. По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50 %. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым. Для удовлетворения потребностей животноводства в лизине крупнотоннажное производство налажено в Испании, Франции, Японии и США.
В клетках микроорга
|
|
|


