 |
Закон Генри. Закон Сивертса
|
|
|
|
Общие понятия и определения.
Химический потенциал компонентов раствора
К разбавленным растворам относятся растворы, которые удовлетворяют требованию:
Х1  1 и Хi
1 и Хi  0 или Х1 >> X2 (8.1)
0 или Х1 >> X2 (8.1)
где Х1 – молярная доля растворителя;
Хi – молярная доля растворённого вещества.
В разбавленном растворе молекулы растворённого вещества отделены друг от друга большим числом молекул растворителя. Поэтому в таком растворе отсутствует взаимодействие между молекулами растворённого вещества, а имеет место взаимодействие только между молекулами растворённого вещества и молекулами растворителя. Если к разбавленному раствору добавлять растворитель при постоянной температуре, то процесс разбавления будет протекать точно так же, как при добавлении растворителя к чистому растворителю. В этом случае с увеличением объёма раствора внутренняя энергия и энтальпия взаимодействия в системе растворитель – растворённое вещество не будет изменяться, т.е:
 (8.2)
(8.2)
Как было показано раньше, уравнение (8.2) справедливо для идеального газа. Это означает, что между разбавленным раствором и идеальным газом существует аналогия. Так самопроизвольное распространение растворённого вещества по всему объёму растворителя аналогично расширению идеального газа в вакуум. Тогда при растворении одного моля растворённого вещества его парциальная молярная энтропия составит:
 =
=  , (8.3)
, (8.3)
где S  - член уравнения, учитывающий величины, не зависящие от Сi;
- член уравнения, учитывающий величины, не зависящие от Сi;
V – объём раствора;
Сi - молярная концентрация растворённого вещества.
Вследствие того, что в разбавленном растворе молекулы растворенного вещества отделены друг от друга большим числом молекул растворителя и не взаимодействуют друг с другом, то при добавлении молекул растворённого вещества к разбавленному раствору процесс сопровождается таким же изменением энтальпии, как и при добавлении молекул растворённого вещества к чистому растворителю. В этом случае парциальная молярная энтальпия растворённого вещества будет оставаться постоянной величиной и определится уравнением:
|
|
|
 (8.4)
(8.4)
Тогда химический потенциал растворённого вещества в растворе составит:
μi =  =
= 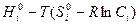 =
=  (8.5)
(8.5)
или
μi = μ  + RTlnCi, (8.6)
+ RTlnCi, (8.6)

где μi – химический потенциал растворённого вещества;
μ  = H
= H  - TS
- TS  - величина, зависящая только от температуры, имеющая
- величина, зависящая только от температуры, имеющая
смысл химического потенциала растворённого вещества при его
концентрации в растворе, равной единице, при условии, что раствор
сохраняет свойства разбавленного или стандартного потенциала
растворённого вещества.
Уравнение Гиббса – Дюгема для одного моля разбавленного раствора, состоящего из n1 молей растворителя и n2 молей растворённого вещества, имеет вид:
Х1d  (8.7)
(8.7)
C учётом этого можно записать:
X1dμ1 + X2dμ2 = 0 (8.8)
Если концентрация какого – либо вещества мала, то его концентрации, выраженные через различные величины, пропорциональны друг другу. Тогда для растворённого вещества справедливо:
С2 = kX2 (8.9)
C учётом этого уравнение химического потенциала для растворённого вещества можно записать в виде:
μ2 = μ 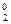 + RTln(kX2) = μ
+ RTln(kX2) = μ 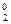 + RTlnk + RTlnX2 = μ
+ RTlnk + RTlnX2 = μ  + RTlnX2 (8.10)
+ RTlnX2 (8.10)
где μ  = μ
= μ 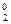 + RTlnk – постоянная, не зависящая от концентрации
+ RTlnk – постоянная, не зависящая от концентрации
растворённого вещества.
Тогда уравнение (8.8) можно записать в виде:
Х1dμ1 + X2d(μ  + RTlnX2) = X1dμ1+ X2RT
+ RTlnX2) = X1dμ1+ X2RT  = X1dμ1+ RTdX2 (8.11)
= X1dμ1+ RTdX2 (8.11)
Так как Х1+Х2 = 1, то dX1 = -dX2, тогда уравнение (8.11) можно представить в виде:
Х1dμ1 – RTdX1 = 0 (8.12)
Откуда получим
dμ1 = RT 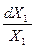 = RTdlnX1 (8.13)
= RTdlnX1 (8.13)
Определённое интегрирование уравнения (8.13) даёт:
|
|
|
 =
=  (8.14)
(8.14)
или
μ1= μ  + RTlnX1 (8.15)
+ RTlnX1 (8.15)
где μ  - химический потенциал чистого растворителя (Х1 = 1).
- химический потенциал чистого растворителя (Х1 = 1).
Уравнение (8.15) представляет собой уравнение химического потенциала растворителя в разбавленном растворе.
Закон Генри. Закон Сивертса
Рассмотрим равновесие разбавленный раствор – пар. Для условий равновесия такой системы справедливо:
μ  = μ
= μ  , (8.16)
, (8.16)
где μ  - химический потенциал растворённого вещества в растворе;
- химический потенциал растворённого вещества в растворе;
μ  - химический потенциал растворённого вещества в газовой фазе.
- химический потенциал растворённого вещества в газовой фазе.
Считая пар растворённого вещества идеальным газом, можно записать:
μ  + RTlnCi = μ
+ RTlnCi = μ  + RTlnPi, (8.17)
+ RTlnPi, (8.17)
где Pi – давление пара растворённого вещества над раствором.
После преобразования уравнения (8.17) получим:
ln  =
=  (8.18)
(8.18)
Величины, входящие в правую часть уравнения не зависят ни от концентрации растворённого вещества ни от давления его пара над раствором, а зависят только от температуры. Поэтому, если температура постоянна, то можно записать:
ln  = Const или
= Const или  = Сonst = Гi (8.19)
= Сonst = Гi (8.19)
или
Сi = Гi ·Pi (8.20)
где Гi – постоянная Генри.
Уравнения (8.19) и (8.20) выражают закон Генри. Закон Генри гласит: концентрация растворённого вещества в жидкости пропорциональна давлению пара растворённого вещества над раствором.
Следует отметить, что закон Генри справедлив для растворения газа в молекулярных жидкостях.
При растворении многоатомных газов в твёрдых или расплавленных металлах и сплавах, растворённые в расплаве газы находятся в атомарном состоянии. Например, процесс растворения водорода в жидком металле можно выразить уравнением:
H2(газ) = 2Н(рас) (8.21)
Для условия равновесия в такой системе можно записать:
Δ  = 2
= 2  = 0 (8.22)
= 0 (8.22)
или
2μ  + 2RTlnCH = μ
+ 2RTlnCH = μ  + RTlnP
+ RTlnP  (8.23)
(8.23)
После преобразования получим:
ln  =
=  (8.24)
(8.24)
Величины, входящие в правую часть уравнения не зависят ни от концентрации растворённого вещества ни от давления его пара над раствором, а зависят только от температуры. Поэтому, если температура постоянна, то можно записать:
ln  = Const или
= Const или  = Сonst = Г
= Сonst = Г  (8.25)
(8.25)
или
СН = (Р  Г
Г  )
)  (8.26)
(8.26)
Таким образом, для растворимости, водорода в расплавленном металле можно записать:
СН = г  (Р
(Р  )
)  (8.27)
(8.27)
|
|
|
где г  = Г
= Г  - постоянная Генри.
- постоянная Генри.
Уравнение (8.26) выражает закон Сивертса. Он гласит: растворимость газа в металлах и сплавах пропорциональна корню квадратному из давления газа над металлом.
В таком виде он справедлив для растворения двухатомных газов в твёрдых и расплавленных металлах и сплавах.
Закон Рауля
Рассмотрим равновесие разбавленный раствор – газ. Для условия равновесия такой системы справедливо:
μ1(рас) = μ1(газ) (8.28)
или
μ 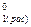 + RTlnX1 = μ
+ RTlnX1 = μ  + RTlnP1 (8.29)
+ RTlnP1 (8.29)
После преобразования получим:
ln 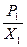 =
=  (8.30)
(8.30)
Величины, входящие в правую часть уравнения не зависят ни от концентрации растворённого вещества ни от давления его пара над раствором, а зависят только от температуры. Поэтому, если температура постоянна, то можно записать:
ln 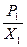 = Const или
= Const или 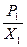 = Сonst (8.31)
= Сonst (8.31)
Выясним физический смысл постоянной величины. Если Х1 = 1, то наша система будет представлять собой чистый растворитель. Тогда давление пара Р1 будет представлять собой равновесное давление пара чистого растворителя Р  или Const = P
или Const = P  . Тогда уравнение (8.31) примет вид:
. Тогда уравнение (8.31) примет вид:
Р1 = Х1Р  , (8.32)
, (8.32)
где Р1 – давление пара растворителя над раствором;
Р  - давление пара растворителя над чистым растворителем;
- давление пара растворителя над чистым растворителем;
Х1 – молярная доля растворителя в растворе.
Поскольку для Х1 всегда справедливо Х1< 1, то из уравнения (8.32) следует, что Р1 < P  . Уравнение (8.31) выражает закон Рауля для растворителя в разбавленном растворе. Закон Рауля гласит: давление пара растворителя над раствором всегда меньше давления пара растворителя над чистым растворителем и пропорционально молярной доле растворителя в растворе.
. Уравнение (8.31) выражает закон Рауля для растворителя в разбавленном растворе. Закон Рауля гласит: давление пара растворителя над раствором всегда меньше давления пара растворителя над чистым растворителем и пропорционально молярной доле растворителя в растворе.
Рассмотрим разбавленный раствор, состоящий из n1 молей растворителя и n2 молей растворённого вещества. Тогда молярные доли растворителя и растворённого вещества в растворе составят Х1 и Х2 соответственно. Поскольку Х1 + Х2 = 1 и Х1 = 1 – Х2, то уравнение (8.32) можно записать в виде:
Р1 = (1 – Х2)Р  (8.33)
(8.33)
Преобразуя, получим
Х2 =  (8.34)
(8.34)
Уравнение (8.34) также представляет собой закон Рауля. В данном случае он формулируется следующим образом: относительное понижение пара растворителя над раствором равно молярной доле растворённого вещества.
|
|
|
|
|
|


