 |
Список использованных источников
|
|
|
|
ВАРИАНТ 50
Задача 2
Приведите формулировки основных стехиометрических законов химии. В чем особенность современного подхода к закону сохранения массы и закону постоянства состава?
Сделайте расчет и заполните для своего задания пропуски в таблице.
Решение:
При нормальных условиях 1 моль содержит 6,02*1023 молекул
22,4 — молярный объём любого газа
| Формула вещества | Масса одного моля | Масса вещества, г. | Количество молей | Количество молекул | Объем вещества при нормальных условиях, литров, указать только для газов |
| Cl2 | 35,5 | 0,5 | 3.01*1022 | 11,2 | |
| NaNO3 | 25,5 | 0.3 | 1,8*1023 |
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. В соответствии с этим, расчеты количественных соотношений между элементами в соединениях или между веществами в химических реакциях стехиометрическими расчетами. В основе их лежат законы сохранения массы, постоянства состава, кратных отношений, а также газовые законы – объемных отношений
В химии используются следующие стехиометрические законы: закон сохранения массы, закон постоянства состава вещества, закон эквивалентов, закон кратных отношений.
Закон сохранения массы
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе.
Закон постоянства состава
Всякое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
Закон эквивалентов
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
|
|
|
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Закон кратных отношений
Закон кратных отношений закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Задача 17
Составьте формулы всех солей соответствующих взятым попарно кислотам и основаниям, приведенным для вашего задания. Для амфотерных гидроксидов необходимо составлять формулы их солей, образованных как при реакциях с кислотами, так и основаниями.
При написании уравнений руководствуйтесь таблицей растворимости и таблицей степени диссоциации.
| Ba(OH)2 Ni(OH)3 HClO H2 CO3 |
Решение:
HClO + Ba(OH)2 = Ba(ClO)2 + H2O
H2 CO3+ Ba(OH)2= BaCO3+H2O
H2 CO3+ Ba(OH)2= BaHCo3+H2O
H2 CO3+ Ba(OH)2= (BaOH)2CO3+H2O
Ba(OH)2 + Ni(OH)3= BaNiO2 + H2O
Ni(OH)3 + HClO = Ni(ClO)3)2+HOH
Ni(OH)3 + HClO = NiCl3+H2O
Ni(OH)3 + H2 CO3 = Ni2(CO3)3 + H2O
HClO + H2 CO3 = HCl + H2O + CO2
Задача 24
Составьте электронные формулы и представьте графически размещение электроном по квантовым ячейкам для указанных в таблице элементов. Воспользуйтесь схемами из учебника. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов- с образованием валентных электронов в соответствии с теорией спин-валентности.
| Элементы |
| Фтор, Хром |
Решение:
Фтор.
Электронная формула (F) фтора - 1s22s22p5
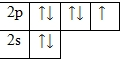
Фтор – элемент, относящийся к группе галогенов. Неметалл. Расположен во втором периоде VII группы A подгруппы. Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес – 18,998 а.е.м. Это единственный стабильный нуклид фтора. Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы. Температура плавления: -219,62 °C.
|
|
|

Рисунок 1 – строение атома хрома
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион.
Хром.
Электронная формула (Cr) хрома 1 s 22 s 22 p 63 s 23 p 63 d 54 s 1
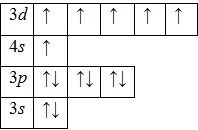
Хром расположен в четвертом периоде VI группы побочной (B) подгруппы Периодической таблицы. Металл. Обозначение – Cr. Порядковый номер – 24.
Хром в виде простого вещества – серовато-белый блестящий металл. Имеет структуру объемно-центрированной кубической решетки.Плотность – 7,2 г/см3. Температуры плавления и кипения равны 1890oС и 2680oС, соответственно. Хром находится в четвертом периоде в VIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 24. В ядре атома хрома содержится 24 протона и 28 нейтронов (массовое число равно 52). В атоме хрома есть четыре энергетических уровня, на которых находятся 24 электрона.

Рисунок 2 – строение атома хрома
Задача 37
Проанализируйте изменения величину зарядов ядер, радиусов атомов, электроотрицательностей и степени окисления элементов в соответствии с вариантом. Каковы закономерности этих изменений при движении по группе сверху вниз или по периоду слева направо? Как изменяется в этом направлении металличность элементов и характер их оксидов и гидроксидов?
| Элементы 4A группы |
Решение:
В состав группы входят 5 элементов: два неметалла – углерод и кремний, находящиеся в во втором и третьем периодах системы Менделеева и 3 металла –германий (промежуточный между неметаллами и металлами, олово и свинец, находящиеся в конце больших периодов-IV, V, VI. Для всех этих элементов характерно то, сто они имеют на внешнем энергетическом уровне 4 электрона. И поэтому могут проявлять степень окисления от +4 до -4. эти элементы образуют газообразные соединения с водородом: СН4, Si Н4, Sn Н4, PbН4. при нагревании на воздухе соединяются с элементами подгруппы кислорода, серы и с галогенами.
|
|
|
Степень окисления +4 получается при переходе 1s –электрона на свободную р- орбиталь. С увеличением радиуса атома уменьшается прочность связи наружных электронов с ядром. Неметаллические свойства уменьшаются, а металлические нарастают. (снижаются температура плавления и кипения и т.д)
По подгруппе сверху вниз закономерно возрастают, металлические свойства и это согласуется со значениями степеней окисления, проявляемыми элементами в соединениях:

1. С простыми веществами дают бинарные соединения, которые по-разному взаимодействуют с водой:
С + О2 = СО2; СО2 + H2O Û Н2СО3;
Si + 2F2 = SiF4;  ;
;
Ge + 2Cl2 = GeCl4;  .
.
(GeO2 × H2O)
2. С кислотами взаимодействуют по-разному, в зависимости от преобладания неметаллической или металлической природы:
а) С + 2Н2SO4 конц. = CO2 + 2SO2 + 2H2O;
б) Sn + 4HNO3 конц. = H2SnO3 + 4NO2 + H2O;
в) Pb + 2HCl = PbCl2 + H2.
3. Реакции со щелочами также идут по-разному:
а)  ;
;
б)  (
( );
);
в)  (
( ).
).
4. Соли этих элементов гидролизуются, причём характер гидролиза закономерно меняется по подгруппе соответствующих элементов:
а) SnCl4 + 3H2O = H2SnO3¯ + 4HCl;
(SnO2 × H2O)
б) SnCl2 + H2O Û SnOHCl + HCl;
в) Pb(NO3)2 + H2O Û PbOHNO3 + HNO3.
5. У оксидов и гидроксидов этих элементов в зависимости от степени окисления соответственно меняются кислотные и основные свойства:
а) С+4 и Si+4 образуют слабые неустойчивые кислоты;
б) Для соединений элементов подгруппы германия со с.о. (+2) по ряду  можно установить следующую закономерность: они амфотерны, основные свойства растут с увеличением порядкового номера. То же самое можно сказать и о гидроксидах.
можно установить следующую закономерность: они амфотерны, основные свойства растут с увеличением порядкового номера. То же самое можно сказать и о гидроксидах.
в) У соединений элементов подгруппы германия со степенью окисления (+4) по ряду:  сохраняется амфотерность, причем кислотные свойства растут с уменьшением порядкового номера элемента. Образуют соли: мета – (германаты, станнаты, плюмбаты) Ме2ЭО3 и орто - Ме4ЭО4.
сохраняется амфотерность, причем кислотные свойства растут с уменьшением порядкового номера элемента. Образуют соли: мета – (германаты, станнаты, плюмбаты) Ме2ЭО3 и орто - Ме4ЭО4.
6. Элементы образуют комплексные соединения, проявляя значения к.ч. = 4 (для Э+2) и к.ч. = 6 (для Э+4):
|
|
|
SiF4 + 2NaF ® Na2[SiF6];
Sn(OH)4 + 2NaOH ® Na2[Sn(OH)6];
PbJ2 + 2KJ ® K2[PbJ4].
7. В окислительно-восстановительных реакциях элементы и их соединения проявляют двойственность:
а) Э0 – прежде всего восстановитель:
С + 2Cl2 = CCl4;
Sn + O2 = SnO2.
б) Э+2 – восстановители:
CO + Cl2 = COCl2;
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2,
в-ль
но могут быть и окислителями:
PbCI2 + Mg = Pb + MgCI 2
в) Э+4 – окислители (особенно активно Pb+4 ® Pb+2):
PbO2 + H2O2 = Pb(OH)2 + O2.
УГЛЕРОД и его соединения
Встречается в почве (карбонаты), в воздухе (углекислый газ), основа живой и растительной жизни.
Химические свойства углерода и его соединений.
1)Реакции с простыми веществами:
С + О2 = СО (СО2)
С + Н2 = СН4
С + 2CI2 = СCI4
2)Реакции со сложными веществами (при повышенной при to):
а) С + Н2О = СО + H2 ,
б) С + СО2 = 2СО,
в) С + FeO = Fe + CO,
г) С + H2SO4(конц.) ® H2СO3 (или СO2 ) + SO2
С + HNO3(конц.) ® H2СO3 (или СO2 ) + NO (или NO2 )
Степень окисления +2
СО – закись углерода, «угарный газ» - бесцветный ядовитый газ, без запаха.
Получение оксида углерода (П):
а) СО2 + С = 2СО (неполное выгорание каменного угля),
б)разложение муравьиной кислоты в присутствие H2SO4(конц.):
НСООН ® СО + H2О
Олово встречается в виде кислородного соединения SnО2 (оловянного камня, из которого получается посредством восстановления углем). В свободном состоянии олово – серебристо-белый мягкий металл.
На воздухе олово при комнатной температуре не окисляется, но нагретое выше температуры плавления постепенно превращается в диоксид олова SnО2 вода не действует на олово. Разбавленная соляная и серная кислота действуют очень медленно. Концентрированные эти кислоты, при нагревании растворяют олово.
Sn + 2 НСl = SnСl 2 + Н2#
Sn + 4Н2SО4 = Sn(SО4)2 + 2 SО2# + 4Н2О
Чем концентрированнее азотная кислота, тем интенсивнее идет реакция
4Sn + 10 НNО3 = 4Sn(NО3)2 + NН4NО3 + 3Н2О
Sn + 4 НNО3 = Н2SnО3$ + 4NО2# +Н2О в концентрированной
Концентрированные щелочи реагируют Sn + 2NаОН = Nа2SnО2 +Н2#
Nа2SnО2 станиит натрия. В растворах соли гидратированы (окружены молекулами воды). На воздухе олово покрывается защитной пленкой. Олово образует комплексные соединения Nа2[Sn(ОН)4]
40% олова идет на производство консервных банок. Железо покрывают оловом. Олово образует устойчивые соединения со степенью окисления +2,+4.
SnО (II) –желтый порошок, получается при разложении Sn(ОН)2 –амфотерный гидроксид Sn(ОН)2+ 2NаОН = Nа[Sn(ОН)4]
Диоксид олова встречается в природе. Образуется при сжигании Sn на воздухе.
Оловянная кислота Н2SnО3 нерастворима (белый порошок) взаимодействует со щелочами Н2SnО3 + 2 NаОН +Н2О = Nа2 [Sn(ОН)4]
Хлорид олова растворим SnСl2, гидрид олова SnН4 –бесцветный, очень ядовитый газ.
Свинец. Руда. Из которой получают свинец называется свинцовый блеск.
|
|
|
PbS + 3О2 = 2PbО + 2SО2 –обжиг.
PbО плавят вместе с коксом и получают свинец, который потом очищают.
Свинец – голубовато- белый тяжелый металл. Он мягок и режется ножом.
На воздухе быстро окисляется и покрывается защитной оксидной пленкой, защищающей от дальнейшего окисления. Вода не взаимодействует со свинцом, но в присутствии воздуха разрушает его. 2Pb + О2 + 2Н2О = 2Pb (ОН)2
Разбавленная соляная и серная кислоты почти не реагируют со свинцом. С концентрированной серной кислотой, при нагревании получается Pb(НSО4)2.
С разбавленной азотной кислотой реагирует быстрее, чем с концентрированной. взаимодействует со щелочами Pb + 4КОН +Н2О = К4[Pb (ОН)6] + Н2# гидроксоплюмбит калия.Все растворимые соединении свинца ядовиты
Степени окисления характерны +2, +4
PbО =- желтый порошок после прокаливания (500оС) приобретает красновато-желтый цвет и называется глетом.
Гидроксид свинца Pb(ОН)2 амфотерен.
Pb(ОН)2 + 4 NаОН = 2 Nа[Pb (ОН)6]
При сплавлении Pb(ОН)2 с сухими щелочами получаются соли плюмбиты:
Pb(ОН)2 + 2 NаОН = Nа2 PbО2 + 2Н2О
Ацетат свинца применяют при крашении Pb(СН3СОО)2
PbS – черного цвета. Бумажка, смоченная раствором соли свинца быстро темнеет, если в воздухе есть сероводород. Это качественная реакция на соли сероводорода. Соединения свинца (IV) –соли плюмбаты СаО + PbО = Са PbО3 большинство нерастворимы.
Аккумуляторы состоят из решетчатых свинцовых пластин, одни заполнены диоксидом свинца, а другие – металлическим губчатым свинцом. Пластины погружены в раствор 35-40% Н2SО4. при работе идет разряд: Pb + SО42- ® PbSО4$ + 2е
Металлический свинец окисляется, а диоксид свинца восстанавливается.
PbО2 + SО42 - + 4Н+ ® Pb SО4$+ Н2О
Электроны, отдаваемые атомами свинца передаются по внешней цепи. Pb – анод,, а PbО2-катод. В растворе Н2SО4 происходит перенос ионов. Ионы SО42- - движутся к аноду, Н+ - к катоду.
Задача 47
Для предложенных в вашем задании соединений постройте графические формулы и укажите виды химической связи в этих молекулах: ионная, ковалентная полярная, ковалентная неполярная, координативная, металлическая, водородная. Составьте электронно- точечные модели молекул, указанных в вашем варианте, обозначив и неподеленные электронные пары.
Покажите, какие (какая) связи «рвутся» при диссоциации. Объясните, что такое водородная связь? Приведите примеры ее влияния на свойства вещества.
| Соединения |
| Гидрофосфат кальция, AsH3 |
Гидрофосфат кальция CaHPO4

Арсин AsH3

Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:

(водородная связь обозначается пунктиром из трех точек)
При возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (НF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты, или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи. Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплот парообразования и плавления. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства.
Задача 52
Дайте определение понятию скорость химической реакции. Опишите количественно (где это можно), как влияют на скорость реакции внешние условия (концентрация, температура, давление). Рассчитайте, во сколько раз изменится скорость прямой реакции при изменении указанных в таблице условий.
| Реакция | Изменение температуры | Температурный коэффициент | Изменение давления |
| А+2В=2Д | Увеличение на 30 С | нет |
Скоростью химической реакции u называют число элементарных актов взаимодействия, в единицу времени, в единице объема для гомогенных реакций или на единице поверхности раздела фаз для гетерогенных реакций. Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t. Концентрацию выражают в моль/л, а время в минутах, секундах или часах.
υ = ± dC/dt,
где C – концентрация, моль/л
Единица измерения скорости реакции моль/л·с
Если в некоторые моменты времени t1 и t2 концентрации одного из исходных веществ равна с1 и с2, то за промежуток времени Δt = t2 – t1, Δc = c2 – c1
| ῡ = — ΔC/Δt [моль/л·с] |
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, присутствия катализаторов, давления (с участием газов), среды (в растворах), интенсивности света (фотохимические реакции).
Зависимость скорости реакции от природы реагирующих веществ. Каждому химическому процессу присуще определенное значение энергии активации Еа. Причем, скорость реакции. тем больше, чем меньше энергия активации.
Скорость зависит от прочности химических связей в исходных веществах. Если эти связи прочные, то Еа велика, например N2 + 3H2 = 2NH3, то скорость взаимодействия мала. Если Еа равна нулю, то реакция протекает практически мгновенно, например:
HCl (раствор) + NaOH (раствор) = NaCl (раствор) + H2O.
Закон действующих масс. Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции аА + bB = cC + dD
υ = k·[A]a·[B]b,
где [A] и [B] – концентрации веществ А и В в моль/л,
k – константа скорости реакции.
Концентрации твердых веществ, в случае гетерогенной реакции в кинетическое уравнение не включают.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс:
υ = k·[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции увеличивается, т.к. увеличивается число соударений между участвующими в реакции веществами. Причем, важно учитывать порядок реакции: если реакция имеет первый порядок по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если реакция имеет второй порядок по какому-либо реагенту, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
Зависимость скорости от температуры. Правило Вант-Гоффа: Скорость большинства химических реакций при повышении температуры на 10° увеличивается от 2 до 4 раз.

υТ2 – скорость реакции при температуре t2, υТ1 – скорость реакции при температуре t1, γ — температурный коэффициент (γ = 2¸4).
Влияние катализаторов. Катализаторы увеличивают скорость реакции (положительный катализ). Скорость реакции растет, так как уменьшается энергия активации реакции в присутствии катализатора. Уменьшение энергии активации обусловлено тем, что в присутствии катализатора реакция протекает в несколько стадий с образованием промежуточных продуктов, и эти стадии характеризуются малыми значениями энергии активации.
Ингибиторы замедляют скорость реакции (отрицательный катализ).
В реакции А+2В=2Д
v2/v1 = 2³°/¹⁰ = 2³ = 8 увеличится скорость реакции, так как t увеличивается
ν -это скорость реакции, γ - температурный коэффициент
Задача 68
Используйте параметр, представленный в одной из клеток вашего задания. Проделайте необходимые расчеты и заполните пропуски диссоциации для всех электролитов 100%. Не забудьте представить схемы расчетов и использованные химические уравнения.
| Электролит | Концентрация электролита, моль/литр | [H+] моль/литр | [OH-] моль/литр | lg[H+] | lg[OH] | pH | pOH |
| NaOH | 0,01 | 10-12 | 0,01 | -12 | -2 |
Решение:
Уравнение диссоциации NaOH <=> Na(+) + OH(-)
Концентрация ионов водорода рассчитывается по формуле:
[Н+] = 10-рН
Концентрация гидроксильных ионов рассчитывается по формуле:
[OН-] = 10-рOН
рН = – lg[H+]
рОН = – lg[ОН-]
Задача 80
В соответствии с номером задания заполните пропуски в таблице.
| Растворенное вещество | Концентрация раствора | Плотность раствора, г/мл | ||
| процентная | молярная | нормальная | ||
| KNO3 | 1,51 | 0,15 | 0.3 | Принять 1,0 |
Решение:
Мольная масса нитрат калия 101.1 г/моль
Для нахождения массовой доли возьмём 1 л раствора, тогда его масса:
m(р-ра) = V*p = 1000 мл*1 г/мл = 1000 г.
Масса нитрат калия: m(KNO3)=n*M = 0,15 моль*101,1 г/моль =15,16 г
Массовая доля: w (KNO3)=m(KNO3)/m= 15,16 г/1000 г = 0,015, или 1,51%
Задача 89
Составьте ионные и молекулярные уравнения гидролиза по первой ступени приведенных в вашем задании солей. Укажите реакцию среды в растворе соли. Напишите выражения для константы гидролиза. Для гидролиза соли по аниону рассчитайте величину константы гидролиза.
Укажите направление смещения равновесия гидролиза при подкислении раствора рассматриваемой соли.
| Соли |
| Хлорид цинка, силикат калия |
Решение:
ZnCl2 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону.
Молекулярное уравнение:
ZnCl2 + HOH ⇄ ZnOHCl + HCl
Полное ионное уравнение:
Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + Cl- + H+ + Cl-
Краткое ионное уравнение:
Zn2+ + HOH ⇄ ZnOH+ + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет иметь кислую среду (pH < 7).
Силикат калия – это класс соединений (неорганических солей), основным представителем которых является метасиликат калия.
I стадия гидролиза силиката калия
Молекулярное уравнение:
K2SiO3 + HOH ⇄ KOH + KHSiO3
Полное ионное уравнение:
2K+ + SiO32- + HOH ⇄ K+ + OH- + K+ + HSiO3-
Краткое ионное уравнение:
SiO32- + HOH ⇄ OH- + HSiO3-
Реакция среды щелочная, т.к. в результате гидролиза образовались ионы OH-.
Задача 97
Составьте электронные уравнения и подберите коэффициенты в реакциях, соответствующих вашему заданию в таблице. Рассчитайте, сколько граммов окислителя требуется для окисления 10 г. соответствующего реакции восстановителя.
| Уравнение реакции |
| KMnO4+ H2C2O4+H2SO4=K2SO4+MnSO4+CO2+H2O |
Решение:
2 KMnVIIO4 + 5 H2C2IIIO4 + 3 H2SO4 → K2SO4 + 2 MnIISO4 + 10 CIVO2 +8 H2O
MnVII + 5 e- → MnII
CIII - 1 e- → CIV
Задача 104
В таблице представлены задания для двух веществ. В одном случае надо по данной формуле комплексного соединения определить комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферу комплекса. Во втором случае по данным характеристикам комплекса надо составить формулу комплексного соединения.
Запишите выражения для константы устойчивости (или нестойкости) комплексного иона. Дайте названия рассмотренным веществам.
| Комплексо-образователь | Лиганд | Координационное число | Внутренняя сфера комплекса | Ионы внешней среды | Ф-ла компл. соединения |
| Cu | H2O | [Cu(H2O)4]2+ | SO42- | SO4[Cu(H2O)4] | |
| Pt4+ | NH3 | [Pt4+(NH3)6] | Cl- | Cl4[Pt(NH3)6] |
Решение
1.Дано Внутренняя сфера комплекса [Cu(H2O)4]2+
Ионы внешней среды SO42-
Находим Комплексообразователь – Cu, Лиганд - H2O, Координационное число -4.
Комплексное соединение - SO4 [Cu(H2O)4]- сульфат тетрааквамеди
2.Дано Ионы внешней среды Cl-, Координационное число -6, Лиганд - NH3, Комплексо-образователь Pt4+.
Находим внутреннюю среду [Pt4+(NH3)6]
Комплексное соединение Cl4[Pt(NH3)6]- Хлорид тетрааминплатины
Задача 120
В соответствии с предложенным в методических советах планом опишите свойства элемента.
| Химический элемент |
| Железо |
Решение:
Порядковый номер Fe равен 26, заряд его ядра +26, 26-протонов; 30 – нейтронов; 26 – электронов..
это d- элемент VIII группы четвёртого периода периодической системы химических элементов
Основные степени окисления: +2, +3
Электронная формула 
Значение атомной массы - 56.
Строение атома

Графическое распределение электронов
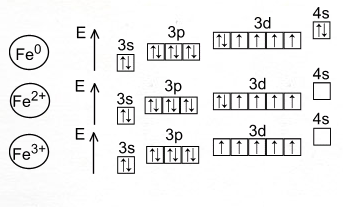
Металл средней активности, восстановитель:
Fe0-2e-→Fe+2, окисляется восстановитель
Fe0-3e-→Fe+3, окисляется восстановитель
Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C = Fe + CO
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O = 4Fe(OH)3
2) Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II,III) - вещество чёрного цвета:
3Fe + 2O2 = Fe3O4
C кислородом во влажном воздухе образуется Fe2O3*nH2O
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O t˚C→ Fe3O4 + 4H2
4) Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 t˚C→ 2FeBr3
Fe + S t˚C→ FeS
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4(разб.) = FeSO4 + H2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
2Fe + 6H2SO4(конц.) t˚C→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) t˚C→ Fe(NO3)3 + 3NO2 + 3H2O
На холоде концентрированные азотная и серная кислоты пассивируют железо.
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 = FeSO4 + Cu
Задача 128
Рекомендуемая Миттлайдером минеральная подкормка для овощей имеет необходимую концентрацию NPK 110-60-110 (в пересчете на N2, P2O5 и K2O). Разовая доза на узкую грядку Миттлайдера (0,45*9,0 м2) содержит 55 г азота N, 30 г оксида фосфора P2O5 и 55 г K2O. Для вашего варианта имеются удобрения имеются удобрения представленные в таблице. Сколько граммов каждого из этих удобрений надо взять для приготовления разовой дозы питательной смеси?
| № имеющегося удобрения | ||
Удобрения, соответствующие № удобрения в таблице
| 8.Кальциевая селитра | CA(NO3)2 |
| 18.Диаммонийфосфат | (NH4)2HPO4 |
| 26.Калий Углекислый | K2CO3 |
Решение:
1.Молярная масса кальциевой селитры 164 г/моль
28г N содержится в 164 сульфат аммония-натрия.
Определим x в 100г.
X= 28/164*100%=4.6%N
NPK=17-0-0
2.Молярная масса Диаммонийфосфат 132 г/моль
142 г. P2O5 содержится в 344 г. Диаммонийфосфат
Определим x в 100гр.
X= 142/344*100%=41.2% P2O5
28 г. N содержится в 344 г. Диаммонийфосфат
Определим x в 100гр.
X= 28/344*100%=8.1% N2
NPK= 8.1-41.2-0
3.Молярная масса Калий Углекислый 138 г/моль
Один моль K2O (94г.) отвечает двум молям K2CO3 (276г.)
94г. – 276г.
Х г. – 100г.
Х = 94/276*100=34.5% K2O
NPK 0-0-34.5
Задача 134
Вычислить ПР(CaCO3), зная, что его растворимость при данной температуре равна 0,013 г/л
Решение:
Выразим растворимость в молях: SCaCO3 = 0,013 / 100,09 = 1,29 моль/л
Концентрация ионов кальция и карбонат ионов равна концентрации растворенной соли.
Так как каждая молекула CaCO3 дает при растворении по одному иону Ca2+ и CO32-, то[Ca2+] = [ CO32-] = 1,29 моль/л, следовательно, ПРCaCO3 = [Ca2+]*[CO32-] = 1,29* 1,29 = 1,66
Список использованных источников
1. Глинка Н. Л. Общая химия: учеб. пособие для вузов. – изд. 17-е. – М.: ЮРАЙТ, 2010.
2. Зайцев О. С, Химия. – М: Академия, 2008.
3. Цитович И. К. Курс аналитической химии. М.: Высш. шк., 2004.
4. Князев Д. А. Смарыгин С. Н. Неорганическая химия: учеб. для вузов. – М.: Высш. шк., 2006.
5. Ахметов А. С. Общая и неорганическая химия: учеб. для вузов. – 4-е изд., испр. – М.: Высш. шк.: Академия, 2010.
|
|
|


