 |
Биохимические принципы витаминотерапии
|
|
|
|
Концентрация витамина в крови или моче.
 |  |
Норма

| Снижено (мало в пище, нарушено всасывание) в 5 раз больше физиологических доз | |||
Концентрация коферментов
 (в крови, клетках) (в крови, клетках)

| ||||
Норма

| Снижено (нарушен биосинтез, транспорт) Мегавитаминотерапия в 100 – 1000 раз больше | |||
 Активность витаминзависимых ферментных систем Активность витаминзависимых ферментных систем
 
| ||||
Не определяется витамин бесполезен (апофермент неактивен)

| Норма |  Активность фермента снижена Активность фермента снижена

| 
| Мегавита-мино-терапия |
| Ограничение белка | Мало белка | Апофермент дефектен |
С расширением профилактического и особенно лечбноо применения появились и учащаются случаи интоксикации витаминами, получившие название гипервитаминозов. Более токсичными оказались жирорастворимые витамины D, А.
Антивитамины.
Это соединения, частично или полностью выключающие витамины из обменных процессов в организме путем их разрушения, инактивирования или препятствия их обмену.
Антиметаболиты.
Структуроподобные соединения (конкурентные ингибиторы) |  Вещества связывающие или разрушающие витамины (неконкурентные ингибиторы)
Вещества связывающие или разрушающие витамины (неконкурентные ингибиторы)
|
Структуроподобные соединения по структуре сходны с самим витамином, поэтому вступают с ними в конкуренцию за место связи их с апоферментом – образуется неполноценный фермент, не способный выполнять физиологические функции (развивается специвический гипо или авитаминоз). Тиамин – окситиамин, рибофлавин – изорибофлавин.
Вещества, связывающие или разрушающие витамин – действуют на готовый витамин или кофермент. Из рыб семейства тресковых, пресноводных молюсков выделен фермент тиаминаза, которая разрушает витамин В1. Авидин(белок яиц) связывает В7 (биотин) необратимо.
|
|
|
Многие антивитамины используются как лекарственные препараты, так как обладают выраженным антибактериальным действием (очень чувствительны бактерии к витаминам, которые являются необходимым компонентом их жизнедеятельности, срок воспроизведения у бактерий очень короткий – отсюда возможность использования их как лекарственных веществ).
Витамин К – производные кумарина.
Аналог В6 (пиридоксина) – изониазид (на микобактерии туберкулеза), но при длительном назначении моет вызвать недостаточность В5, так как аналог коферментам НАД и НАДФ.
Антивитамины парааминобензойной кислоты – сульфаниламиды.
Атебрин, акрихин – антиметаболиты В2, блокируют образование ФАД. Эти препараты используются при лечении малярии, заражении паразитами (простейшие).
Витамин В5(РР).
Витамин РР – амин никотиновой кислоты входит в состав коферментов: НАД, НАДФ Синтезируется из триптофана через кинуренин и оксихинолиновую кислоту. Никотинамид получил название антипеллагрического витамина, т.к. предотвращает развитие пеллагры. Пеллагра характеризуется специфическими проявлениями: симметрической эритемой кожи, стоматитом, глосситом, гастритом, диареей, энцефалопатией с психическими нарушениями. НАД и НАДФ являются коферментами дегидрогеназ.
Участвуют в ряде процессов:
1. Биоокисление – НАД и [НАДФ] выполняют роль промежуточных переносчиков протонов и электронов между субстратом и флавинзависимыми дегидрогеазами.
2. НАДФН используется в синтезе ж. к., холестерина, как источник восстановительных эквивалентов.
3. НАДН обеспечивает превращение метгемоглобина в гемоглобин:
Метгемоглобин

 НАДН
НАДН
НАД+
Гемоглобин
При нарушении процесса в эритроцитах накапл метгемоглобин и -анемия, т.к. метгемоглобин не связывает О2.
4. НАДФН необходим для восстановления глутатиона

|
|
|
Глутатион необходим для восстановления перекисей.
Снижение концентрации восстановленного глутатиона приводит к гемолитическому кризу. Больные погибают от тяжелой гемолитической анемии, вызванной накоплением перекиси. В эритроцитах нет митохондрий и это приводит к накоплению перекиси. В основе анемии лежит недостаточность глюкозо-6-фосфатдегидрогеназы – фермента пентозного пути окисления глюкозы. В основе развития медикаментозных гемолитических анемий также лежит дефект глюкозо-6-фосфатдегидрогеназы. Такая анемия возникает при использовании противомалярийного средства – примахин.
5. НАД входит в состав дегидрогеназ цикла Кребса.
6. НАД участвует в окислении жирных кислот.
Примеры реакций.
1. Окислительное декарбоксилирование пирувата


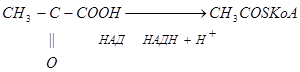
Эта реакция связывает гликолиз с ЦТК, сопровождается образованием АТФ.
2. Окислительное декарбоксилирование 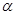 -кетоглутарата
-кетоглутарата



Это реакция ЦТК, на этой стадии идет образование АТФ.
3. Превращение малата в ЩУК в ЦТК


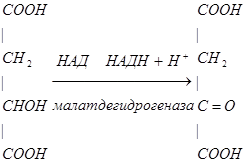
4. Окисление жирных кислот


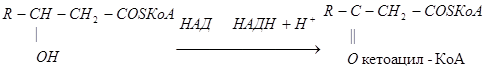
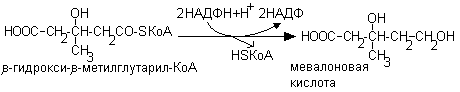
5. НАДФН+Н+ используется в синтезе жирных кислот
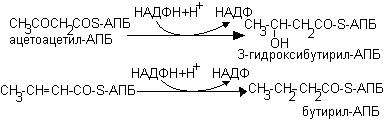
6. Синтез холестерина
7. НАД-зависимые дегидрогеназы участвуют в биологическом окислении. окислении
SH2  НАД/НАДН+Н+
НАД/НАДН+Н+  ФАД/ФАДН2
ФАД/ФАДН2 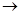 КоQ/КоQН2
КоQ/КоQН2 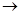 цит b
цит b 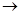 цит с
цит с 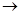 цит а
цит а  цит а3
цит а3  О2
О2
Никотинамид синтезируется из триптофана
Триптофан
 кинурениназа кинурениназа
| ||
 Кинуреновая кислота
В6 Кинуреновая кислота
В6
|     Кинуренин
1 Кинуренин
1  В6 В6
|  Антраниловая кислота Антраниловая кислота
|
 Ксантуреновая кислота Ксантуреновая кислота
| Оксикинуренин | Оксиантраниловая кислота

|
 Никотинамид Никотинамид
| Хинолиновая кислота |
Патология обмена витамина В5.
Никотинамид получил название антипеллагрического витамина, т.к. предотвращает развитие пеллагры.
Пеллагра характеризуется специфическими проявлениями: симметрической эритемой кожи, стоматитом, глосситом, гастритом, диареей, энцефалопатией с психическими нарушениями.
Пеллагра – заболевание 3-х «Д» - дермат, деменция, диарея.
Болезнь Хартнупа связана с нарушением всасывания триптофана и продуктов его обмена в почках. Недостаток триптофана приводит к снижению образования никотиновой кислоты и это вызывает развитие пеллагроподобных симптомов.
Пиридоксальфосфат является коферментом аминотрансфераз и декарбоксилаз. 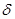 -аминолевулинатсинтаза в качестве кофермента также содержит пиридоксальфосфат. Витамин В6 принимает участие в обмене триптофана.
-аминолевулинатсинтаза в качестве кофермента также содержит пиридоксальфосфат. Витамин В6 принимает участие в обмене триптофана.
|
|
|
1. Реакции трансаминирования аминокислот
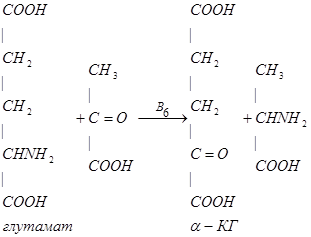
2. Декарбоксилирование аминокислот.
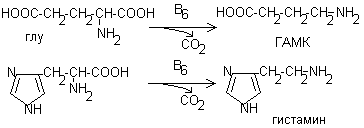
3. Синтез гема из глицина и сукцинил-КоА

 Н2N-СН2-СООН + НООС-СН2-СН2-СОSКоА
Н2N-СН2-СООН + НООС-СН2-СН2-СОSКоА 
НООС-СН2-СН2-СО-СН2NН2 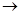
 Гем
Гем
4. Витамин В6 участвует в обмене серосодержащих аминокислот
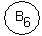


5. Витамин В6 участвует в обмене триптофана.
Триптофан
 кинурениназа кинурениназа
| ||
 Кинуреновая кислота
В6 Кинуреновая кислота
В6
|     Кинуренин
1 Кинуренин
1  В6 В6
|  Антраниловая кислота Антраниловая кислота
|
 Ксантуреновая кислота Ксантуреновая кислота
| Оксикинуренин | Оксиантраниловая кислота

|
 Никотинамид Никотинамид
| Хинолиновая кислота |
В6 входит в состав кинурениназы, которая обеспечивает превращение кинуренина в антраниловую и оксикинуринина в оксиантраниловую кислоту (реакция 2).
В6 входит в состав кинуренинтрансаминазы, которая участвует в превращении кинуренина в кинуреновую кислоту и оксикинуренина в ксантурениновую кислоту (реакция 1).
При недостатке витамина В6 повышается экскреция кинуренина и ксантурениновой кислоты и это является ранним биохимическим проявлением недостаточности В6.
Энзимопатии, возникающие при В6 дефиците.
1. Врожденная гомоцистинурия – обусловлена дефектом цистатионсинтазы.
2. Врожденная цистатионурия – связяна с нарушением активности цистатионазы.
3. Наследственная ксантуренурия – дефект кинурениназы.
4. Пиридоксинзависимый судорожный синдром.
5. Пиридоксинзависимая анемия.
Гомоцистинурия – подвывих хрусталика, деформация скелета, негнущаяся походка, «чаплинская» постановка ног, тромбоз.
Цистатионинурия – психические нарушения, тремор, нарушение походки.
Ксантуренурия - нарушения интеллекта, судороги, аллергические проявления, стоматит, глоссит. Лечат введением больших доз витамина В6.
Пиридоксинзависимый судорожный синдром – снижение активности глутаматдекарбоксилазы. Нарушение образования тормозного медиатора - 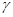 -АМК. Мегадозы В6.
-АМК. Мегадозы В6.
Пиридоксинзависимая анемия – нарушение синтеза гема. Лечат дозами витамина В6.
Обмен витамина Н (биотин).
|
|
|
Биотин (от греч. bios - жизнь), или коэнзим R.
Тип катализируемой реакции – карбоксилирование.
1. Карбоксилирование ацетил-КоА с образованием малонил-КоА
СН3СОSКоА  НООС-СН2-СОSКоА
НООС-СН2-СОSКоА
Карбоксилирование пировиноградной кислоты с образованием ЩУК
СН3СОСООН 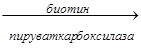 НООС-СН2-СО-СООН
НООС-СН2-СО-СООН
.
Образование ЩУК – начальный этап синтеза глюкозы из лактата и пирувата в процессе глюконеогенеза.
2. Карбоксилирование пропионил-КоА с образованием метилмалонил-КоА:
СН3СН2СОSКоА 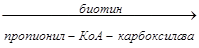 НООС-СН(СН3)-СОSКоА
НООС-СН(СН3)-СОSКоА
4. 
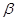 -метилкротонилглицинемия – рвота, метаболический ацидоз.
-метилкротонилглицинемия – рвота, метаболический ацидоз.
В основе – дефект 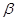 -метилкротонил-КоА-карбоксилазы.
-метилкротонил-КоА-карбоксилазы.
Диагноз – по увеличению концентрации 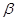 -метилкротонилглицина в моче.
-метилкротонилглицина в моче.
Лечение – биотин.
Пропионил-КоА образуется при расщеплении изолейцина, метионина, треонина, жирных кислот с нечетным числом атомов углерода. Метилмалонил-КоА изомеризуется в янтарную кислоту и это обеспечивает превращение пропионил КоА в ЦТК:
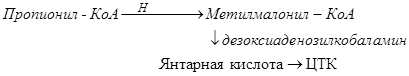
Патология:
Врожденная пропионатацидемия.
В основе заболевания лежит врожденный дефект пропионил-КоА-карбоксилазы, биотинзависимого фермента, катализирующего превращение пропионил-КоА в метилмалонил-КоА. В результате блока накапливается пропионил-КоА и развивается кетоацидоз. Приступы кетоацидоза провоцируются приемом в пищу белка.
Пропионил-КоА у таких больных включается вместо ацетил-КоА в синтез жирных кислот, что приводит к образованию аномальных жирных кислот с нечетным числом атомов углерода.
*Накопление аномальных жирных кислот вызывает тяжелые нейрологические нарушения.
Жирные кислоты с нечетным числом атомов углерода входят в состав миелиновых оболочек нервных стволов и изменяют их проводимость, что вызывет тяжелые нейрологические нарушения.
Пропионатацедемия – обезвоживание, мышечная слабость, коматозное состояние, тяжелый кетоацидоз.
В основе – дефект пропионил-КоА карбоксилазы (в фибробластах 2% от нормы).
Пропионовая кислота образуется при распаде метионина, треонина, изолейцина.
Диагноз – по повышению концентрации пропионовой кислоты в крови и снижению активности фермента в фибробластах.
Лечение – исключение или ограничение белка, иногда введение биотина.
Фолиевая кислота – витамин В9, Вс.
Основными источниками фолатов являются: салат, шпинат, капуста, морковь, помидоры, лук.
Фолаты всасываются в проксимальных отделах тонкого кишечника. Всасывание фолатов осуществляются с помощью специфического механизма активного транспорта, требует затраты энергии и обеспечивает поступление фолиевой кислоты в кровоток против концентрационного градиента. Транспорт фолатов в плазме крови происходит с участием специфических белков, из которых основным является фолатсвязывающий белок из фракции трансферина. Всосавшиеся фолаты поступают в печень, где накапливаются и превращаются в активные формы. Способность печени накапливать и использовать фолаты находится в зависимости от обеспеченности организма белками, аминокислотами и витаминами. Дефицит витамина В12 и метионина снижает содержание фолатов в печени. Недостаток биотина нарушает образование активной формы витамина – тетрагидрофолиевой кислоты.
|
|
|
. При циррозах, жировой инфильтрации печени нарушается накопление и использование фолатов.
Фолиевая кислота образует в организме несколько коферментных форм. Первая стадия образования коферментных форм – это восстановление фолиевой кислоты в тетрагидрофолиевую кислоту при участии дегидрофолатредуктазы. Тетрагидрофолиевая кислота приносит одноуглеродные фрагменты: СН3 – метильная группа, СН2 – метиленовая группа, СН – метиновая, СНО – формильная.
Тетрагидрофолиевая кислота образует следующие коферментные формы:
1. Метилтетрагидрофолиевую кислоту ТГФК-СН3
2. Метилен ТГФК-СН2
3. Метинтетрагидрофолиевую кислоту ТГФК-СН
4. Гидроксиметилентетрагидрофолиевую кислоту ТГФК-СН2ОН
5. Формилтетрагидрофолиевую кислоту ТГФК-СНО
Источником одноуглеродных фрагментов, акцептируемых ТГФК в реакциях катаболизма, являются 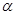 -углеродный
-углеродный
атом гл  ицина,
ицина,  углеродный атом серина, углеродный атом гистидина, а также муравьиная кислота, формальдегид.
углеродный атом серина, углеродный атом гистидина, а также муравьиная кислота, формальдегид.
Наиболее важной функцией коферментных форм фолиевой кислоты является их участие в биосинтезе пуриновых оснований и тимидинмонофосфата.
При синтезе пуриновых оснований производные ТГФК служат источником 2 и 8 углеродных атомов пуринового кольца.
Участие коферментных форм фолиевой кислоты в биосинтезе тимидинфосфата, а также пуриновых оснований, входящих в ДНК и РНК, определяют важную роль фолиевой кислоты в синтезе нуклеиновых кислот и процессе пролиферации.
Нарушения обмена фолиевой кислоты.
Нарушения обмена фолиевой кислоты могут быть вызваны следующими причинами:
1. Недостаточное поступление фолатов с пищей.
2. Нарушение всасывания фолатов в организме.
Недостаток фолатов приводит к возникновению анемии. Непосредственным биохимическим дефектом, вызывающим анемию, является торможение биосинтеза ДНК и пролиферации кроветворных клеток, т.к. нарушается синтез пуриновых оснований и тимидинфосфата. Фолатдефицитная мегалобластическая анемия характеризуется снижением количества эритроцитов, гемоглобина и появлением в периферической крови и костном мозге мегалобластов. Введение фолиевой кислоты вызывают быструю гематологическую ремиссию и восстанавливает нормальное кроветворение.
| Известны врожденные дефекты, затрагивающие различные ферменты, участвующие в образовании и взаимопревращениях коферментных форм фолиевой кислоты. |
Известен дефект фолатредуктазы, который приводит к развитию мегалобластической анемии, но эта анемия вызвана нарушением превращения в формил-ТГФК.
Витамин В12-кобаламин.
Группа витаминов В12. содержит атом кобальта, соединенный с 4 восстановленными пиррольными кольцами.
Синтезируется исключительноо микроорганизмами, от них попадает в животные ткани, печень почки. Частично синтезируется микрофлорой кишечника.
Витамин В12 (кобаламин) присутствует в организме в 3 формах: оксикаболамина (НО-В12), метилкобаламина (СН3-В12) и 5-дезоксиаденозилкобаламина (ДАВ12). В составе витамина В12 содержится кобальт. Оксимелиткобаламин является основной транспортной и депонируемой формой В12. метилкобаламин и дезоксиаденозилкобаламин – коферментные формы витамина.
Для всасывания витамина В12 необходим внутренний фактор Кастла – гликопротеид, продуцируемый обкладочными клетками желудка. При резекции желудка нарушается всасывания витамина В12.
После всасывания, витамин В12 связывается со специфическим транспортным белком транскобаламином. Транскобаламин существует в формах I и II. Транскобаламин Iанспортирует витамин от кишечника к печени и обеспечивает его депонирование. Транскобаламин II является основной транспортной формой в кровотоке.
Витамин В12 принимает участие в 2 ферментативных реакциях.
1. В виде метилкобаламина катализирует превращение гомоцистеина в метионин путем переноса метильного остатка от метил-ТГФК:
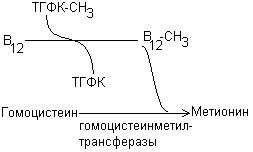
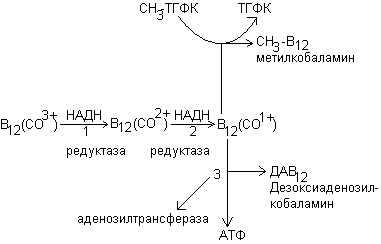
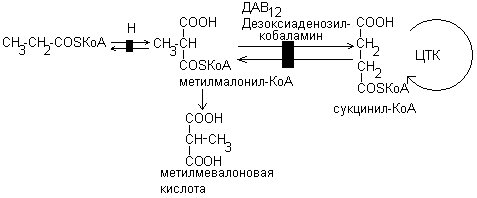
2. Коферментная форма витамина В12-дезоксиаденозилкобаламин необходима для функционирования метилмалонил-КоА-мутазы, которая обеспечивает изомеризацию метилмалонил-КоА в сукцинил-КоА:

| С разветвленной цепью |
 Жирные кислоты Жирные кислоты
| |
| С нечетным числом атомов С |
Холестерин
Изолейцин
Метионин
Треонин

Нарушения обмена витамина В12.
Нарушения, приводящие к мегалобластической анемии, лейкопении, а также неврологические симптомы дегенерации задних и боковых столбов спинного мозга.
Патология:
1. Механизм развития анемии (гипотеза) – При недостаточности В12 нарушается использование СН3-ТГФК для ресинтеза метионина и вся фолиевая кислота попадает в «ловушку» и ТГФК превращается в СН3-ТГФК и дальше нарушается образование других коферментных форм фолиевой кислоты, которые необходимы для синтеза пуриновых и пиримидиновых нуклеотидов. Это ведет к нарушению биосинтеза нуклеиновых кислот, пролиферации и созреванию кроветворных клеток.
2. Анемия Аддисона-Бирмера (пернициозная анемия) – обусловлена атрофией слизистой оболочки желудка. Атрофия слизистой оболочки, как правило, носит врожденный характер.
3. Врожденные метилпропионатацидемии.
Носит выраженный семейный характер, затрагивает братьев и сестер одного поколения при отсутствии выраженных симптомов заболевания у родителей.
Метилмалонатацидемия обусловлена нарушением образования дезоксиаденозилкобаламина. Это нарушение приводит к накоплению метилмалонил-КоА. Метилмалонил-КоА ингибирует пируваткарбоксилазу и это нарушает превращение пирувата в оксалоацетат и в результате тормозится глюконеогенез, развивается гипогликемия, усиливается катаболизм липидов и ацидоз.
Метилмалонил-КоА тормозит синтез жирных кислот и включается в синтез вместо малонил-КоА, что приводит к появлению жирных кислот с разветвленной углеродной цепью.
Пропионил-КоА включается в синтез жирных кислот и приводит к образованию жирных кислот с нечетным числом атомов углерода. Нарушается синтез липидов и фосфолипидов, происходит нарушение миелиновой оболочки нервной ткани (демиелинизация).
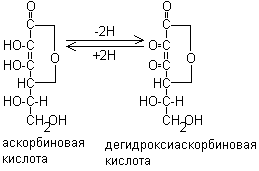
Аскорбиновая кислота (витамин С).
С - донор водорода, участвует в О-В р и превращается при этом в дегидроаскорбиновую кислоту:
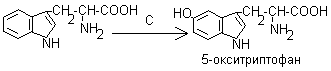
Гидроксилирование триптофана в 5-гидрокситриптофан (синтез серотонина).
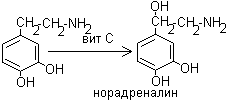
1. Превращение 3,4-дигидрофенилэтиламина в норадреналин
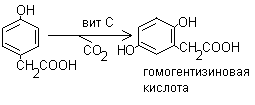
2. Гидроксилирование п-гидроксифенилпирувата в гомогентизиновую кислоту:
3. Гидроксилирование стероидов при биосинтезе громонов коры набпочечников из холестерина.
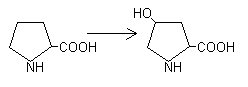
4. Гидроксилирование остатков пролина и лизина при синтезе коллагена:
5. Витамин С принимает участие в работе системы метгемоглобин – гемоглобин.
Аскорбиновая кислота + метгемоглобин 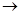 ДАК + гемоглобин
ДАК + гемоглобин
ДАК + глутатион 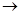 АК + окисленный глутатион
АК + окисленный глутатион
Аскорбиновая кислота восстанавливает метгемоглобин в гемоглобин, сама окисляется в дегидроксиаскорбиновую кислоту. Дегидроксиаскарбиновая кислота восстанавливается под действием глутатиона. Метгемоглобин не накапливается в клетках.
6. Аскорбиновая кислота способствует восстановлению трехвалентного железа в 2-х валентное, которое легче всасывается в кишечнике.
Витамин А.Источником витамина А являются продукты животного происхождения: печень трески, морского окуня, сметана, яйца. В моркови, томатах, свекле содержатся каротиноиды, которые являются провитаминами А.
Название «витамин А» объединяет группу соединений: ретинол-спирт, ретинал-альдегид, ретиноевую кислоту. В тканях организма образуются сложные эфиры ретинола с пальмитиновой и уксусной кислотой: ретинилпальмитат, ретинилацетат.
Известны три провитамина А - 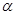 ,
, 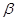 , и
, и 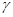 -каротины, которые отличаются по строению и биологической активности. Наиболее активен
-каротины, которые отличаются по строению и биологической активности. Наиболее активен 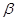 - каротин, который при расщеплении дает 2 молекулы ретиналя.
- каротин, который при расщеплении дает 2 молекулы ретиналя. 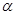 и
и 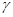 -каротины дают по 1 молекуле витамина А.
-каротины дают по 1 молекуле витамина А.
Для всасывания витамина А необходимы желчные кислоты. В слизистой кишечника ретинол образует эфиры с жирными кислотами и трансформируется в составе хиломикронов. В плазме ретинол связывается ретинолсвязывающим белком и доставляется в ткани. В печени эфиры ретинола депонируются. Часть ретинола в печени окисляется в ретиноевую кислоту, которая выводится с желчью в виде глюкуронидов.
Функции витамина А.
1. Регулирует рост и дифференцировку клеток развивающегося организма. Регулирует дифференцировку и деление быстро делящихся клеток (пролиферирующих) тканей – хряща и костной ткани, эпителия кожи и слизистых.
2. Участие в фотохимическом акте зрения.
3. В форме ретинолфосфата присоединяет глю, фруктозу и транспортирует в клеточную мембрану для синтеза гликопротеидов, т.е. участвует в построении клеточной мембраны (рецепция, контакт, иммунологическое взаимодействие) проницаемость клеточных и субклеточных мембран.
Наиболее изучено участие витамина А в зрительном акте. В этом процессе витамин А участвует в форме цис-ретиналя, который входит в состав светочувствительных пигментов сетчатки глаза. В сетчатке имеется 2 типа клеток – палочки и колбочки. Палочки реагируют на слабое освещение (сумерочное, ночное зрение), а колбочки – на хорошее освещение (дневное зрение) и обеспечивают цветовое зрение. Палочки содержат белок родопсин, а колбочки – йодопсин.
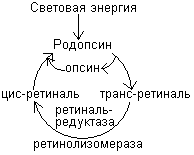
Кванты света поглощаются родопсином и вызывают изомеризацию цис-ретиналя в транс-ретиналь. После чего происходит диссоциация транс-ретиналя и опсина и пигмент обесцвечивается. Изомеризация ретиналя приводит к возникновению электрического импульса, распространяющегося по нервному волокну. В темноте происходит превращение транс-ретиналя в транс-ретинол, а затем в цис-ретинол, который вновь соединяется с белком опсином. Отсутствие регенерации родопсина приводит к слепоте в ночное время или в сумерках.
Нарушения обмена витамина А.
1. Ранним признаком недостаточности витамина А является нарушение темновой адаптации и ночная слепота.
2. Недостаточность витамина А приводит к возникновению фолликулярного гиперкератоза (избыточное ороговение кожи, вызванное задержкой смены эпителия).
3. Ксерофтальмия – сухость конъюктивы глаза.
4. Кератомаляция – размягчение роговицы.
Гипервитаминоз А – возникает довольно быстро.
Причины:
1. Употребление продуктов, богатых витамином А (печень полярных млекопитающих, рыбий жир)
2. Передозировка лечебных препаратов витамина А.
Хроническая интоксикация может быть вызвана длительным применением 20 тыс МЕ. Особенно чувствительны дети.
Общие явления: раздражимость, бессонница, головные боли, повышение t, изменения со стороны волос и кожи, боли в суставах, растройство походки, припухлость мягких тканей, увеличение печени, селезенки.
Врожденные нарушения обмена витамина А.
Врожденное нарушение превращения 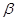 -каротинов в ретиналь.
-каротинов в ретиналь.
Дефект фермента, превращающего в слизистой кишечника 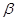 -каротин в витамин А.
-каротин в витамин А.
Витамин D.
Несколько веществ стероидной природы. Наиболее активны эргокальциферол (D2), ходекальциферол (D3) и дигидроэргокальциферол (D4). Потребность ребенка в витамине D – 10 мкг – 400 МЕ в сутки.
Всасывание кальциферолов происходит с помощью желчных кислот. В составе хиломикронов кальциферолы поступают в кровь, а затем в печень. В печени эргокальциферол и холекальциферол гидроксилируются в 25 положении и образуются 25-гидроксихолекальциферол и 25-гидроксиэргокальциферол. После этого поступают в почки, где образуются 1,25-дигидроксикальциферолы.
Функции витамина D.
1. Транспорт ионов кальция и фосфата через эпителий слизистой тонкого кишечника при всасывании.
2. Мобилизация кальция из костной ткани.
3. Реабсорбция кальция и фосфора в почечных канальцах.
В результате действия витамина D повышается содержание ионов кальция и фосфатов в крови.
Витамин D рассматривается как прогормон, т.к. основная функция – обеспечение нормальной концентрации Са в крови (2,5 мМ, 10мг% - очень стабильный, жесткий показатель). Уменьшение содержания Са2+ вызывает судорожное состояние, повышение концентрации Са2+ может вызывать внекостную кальцификацию.
Механизм действия витамина D.
1. Обеспечение всасывания кальция из кишечника (всасывается в виде фосфатов).
2. Реабсорбция кальция в почках.
3. Мобилизация из депо (костная ткань).
Схема обмена витамина D

Функции 1,25-диокси витамина D:
1. Деминерализация костей
2. Усиление синтеза белков, связывающих кальций (кальцийсвязывающий белок). Реализует свое действие через генетический аппарат.
3. Усиливает реабсорбцию кальция в почках.
Функции 24,25-диокси витамин D
Усиливает синтез щелочной фосфотазы и Са2+-зависимой АТФ-азы.
Сижение [Са2+] – выброс паратгормона 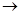 1,25-диокси витамин D.
1,25-диокси витамин D.
Повышение [Са2+] – понижение содержания паратгормона 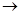 переключение на синтез 24,25-диокси витамин D, выброс тиреокальцитонина
переключение на синтез 24,25-диокси витамин D, выброс тиреокальцитонина  усиление снижения кальция в костях.
усиление снижения кальция в костях.
Нарушение обмена витамина D.
1. Гипервитаминоз по количеству и тяжести на I месте. Гипервитаминоз D возникает при избыточном приеме витамина. Наблюдается деминерализация костей и их переломы. Уровень кальция и фосфатов в крови повышается (они извлекаются из костей, всасываются из кишечника и реабсорбируются в почках). Развивается гиперкальцемия  карциноз внутренних органов: аорты, сердца, печени, легких, почек
карциноз внутренних органов: аорты, сердца, печени, легких, почек  тяжелейшие осложнения, часто смерть.
тяжелейшие осложнения, часто смерть.
2. Нарушения обмена витамина D могут возникнуть при заболеваниях почек и печени, где происходит образование активных форм витамина D.
3. Рахит – вызывает недостаток витамина D в пище. При рахите заторможены всасывание ионов кальция и фосфатов, реабсорбция их в почках. Уровень кальция и фосфора в крови снижается, нарушается минерализация костей. Наблюдается размягчение костей, возникают деформации костей конечностей, черепа (замедление зарастания родничков, нарушение челюстно-лицевого скелета), грудной клетки, дряблые мышцы.
Врожденные нарушения обмена витамина D.
1. Синдром Де-Тони-Дебре-Факкони.
Характерна триада: гиперфосфатемия, гиперглюкозурия, гипераминоацедемия. В основе генетически обусловленные нарушения транспорта в почечных канальцах. Развивается вторичный рахит (вследствие потери фосфата и ацидоза).
2. Семейный гипофосфатемический витамин D – резистентный рахит.
Гипофосфатемия и признаки рахита на 1-2 году жизни, не поддается лечению витамином D, низкий рост 150-160 см, костные деформации, псевдоатлет (приземистое телосложение).
Причина: снижение реабсорбции неорганического фосфата в почечных канальцах, понижение всасывания в тонком кишечнике. В основе генетические нарушения в третичной структуре белков в почечных канальцах.
Лечение: фосфаты и соли кальция.
3. Врожденный псевдодефицитный витамин D – зависимый рахит – по клинике сходен с рахитом, но отличается резистентностью к стандартным профилактическим и лечебным дозам витамина D.
Характеризуется гипокальциемией и гипераминоацидурией, нет фосфата.
В основе дефект фермента в почках, обеспечивающего образования 1,25-диокси витамин D2/D3.
Витамин К.
Витамин К является хиноном с боковой изопреноидной цепью. Есть два ряда нафтохинонов – филлохиноны и менохиноны. Разработаны синтетические препараты витамина К – менадион, викасол и синкавит.
Витамин К содержится в основном в растительной пище: шпинат, тыква, капуста, томаты, крапива. Частично синтезируется микрофлорой кишечника.
Всасывается витамин К в тонком кишечнике в присутсвии желчных кислот. Транспорт витамина К происходит с хиломикронами. В плазме крова витамин К связывается с альбумином.
Функции витамина К.
1. Витамин К участвует в образовании факторов свертывающей системы крови: II – протромбина, VII – проконвертина, IX – фактора Кристмаса и X – фактора Стюарта.
2. Витамин К в виде кофермента участвует в микросомальном  - карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
- карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
Протромбин (содержит 10 остатков глу, в отличие от тромбина).
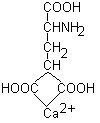
Чтобы протромбин мог активироваться и превратиться в тромбин, он должен связать ионы Са2+. При недостатке витамина К в организме синтезируются дефектные молекулы протромбина, не способные правильно связывать ионы Са2+.
В костях белок – остеокальцин связывает Са2+.
Витамин Е (токоферолы).
Это: 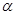 ,
, 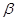 и
и 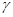 -токоферолы. Наибольшее значение имеет
-токоферолы. Наибольшее значение имеет 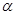 -токоферол Термин «токоферол» происходит от греческого слова «tokos», что в переводе означает» «рождение ребенка Источником токоферола служат растительные масла. Для всасывания витамина Е необходимы желчные кислоты. Всасывание происходит путем простой диффузии, транспортируются в составе хиломикронов через лимфатические пути в органы и ткани. В клетках токоферол включается в состав мембран.
-токоферол Термин «токоферол» происходит от греческого слова «tokos», что в переводе означает» «рождение ребенка Источником токоферола служат растительные масла. Для всасывания витамина Е необходимы желчные кислоты. Всасывание происходит путем простой диффузии, транспортируются в составе хиломикронов через лимфатические пути в органы и ткани. В клетках токоферол включается в состав мембран.
Функции витамина Е.
1. Природный антиоксидант – препятствует развитию цепных реакций пероксидного окисления ненасыщенных липидов в биологических мембранах.
2. Токоферол повышает биологическую активность витамина А, т.к. защищает боковую цепь от пероксидного окисления.
.
|
|
|



