 |
Равновесия в растворах комплексных соединений
|
|
|
|
Диссоциация комплексных соединений в растворе происходит в два этапа. Сначала происходит первичная диссоциация комплексного соединения как сильного электролита на ионы внешней сферы и комплексный ион, например:
[Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl-
Затем происходит обратимый процесс диссоциации комплексного иона:
[Ag(NH3)2]+ = Ag+ + 2NH3,
который характеризуется константой равновесия:

Кн –константа нестойкости комплексного иона. Константа нестойкости характеризует термодинамическую устойчивость комплекса. Чем ниже значение константы нестойкости, тем прочнее и устойчивее комплексный ион. Например, устойчивость комплексов возрастает в ряду:
| [Ag(NO2)2]- | [Ag(NH3)2]+ | [Ag(CN)2]- |
| Кн=1,3ž10-3 | Кн=6,8ž10-8 | Кн=1ž10-21 |
Зная величину константы нестойкости, можно рассчитать концентрацию частиц в растворе комплексных соединений.
Пример: Рассчитать концентрацию катионов кадмия в 0,1 М растворе K2[CdI4], содержащем 1 моль/л KI. Kн=7,94ž10-7моль/л
K2[CdI4] ® 2K++CdI42-
CdI42- = Cd2++ 4 I-

В присутствии избытка иодид-ионов равновесие диссоциации комплексного иона сильно сдвинуто влево, так что количеством ионов I-, образующихся при вторичной диссоциации можно пренебречь. Тогда
[I-] = СKI = 1 моль/л
По этой же причине равновесная концентрация комплексных ионов может быть приравнена к исходной концентрации соли:
[CdI4]2- = 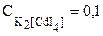 моль/л
моль/л
Отсюда находим концентрацию ионов кадмия в растворе:
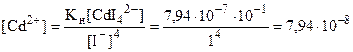 моль/л
моль/л
К равновесию в растворе комплексных соединений применим принцип Ле Шаталье.
При введении в раствор одноименных частиц (молекул или ионов лигандов) равновесие смещается влево, что приводит к увеличению концентрации комплексного иона и к уменьшению концентрации иона металла-комплексообразователя.
|
|
|
Наоборот, удаление ионов из раствора смешает равновесие вправо, что может в конечном итоге привести к разрушению комплекса. Последнее может быть достигнуто путем связывания лигандов или ионов металла-комплексообразователя в слабый электролит, осадок или другой более прочный комплекс. Например:
[Ag(NH3)2]+ + 2H+ = Ag+ + 2NH4+
[Ag(NH3)2]+ + I- = AgI¯ + 2NH3
[Ag(NH3)2]+ + 2CN- = [Ag(CN)2]- + 2NH3
Пример: Образуется ли осадок иодида серебра, если к 1 л 0,1М раствора нитрата диамминсеребра, содержащего 1 моль/л аммиака, добавить 1ž10-4 моль KJ. Кн=5,9ž10-8, ПРAgI= 1,5ž10-16.
Рассчитаем концентрацию ионов серебра, которую дает комплексный ион:
[Ag(NH3)2]NO3 ® [Ag(NH3)2]+ + NO3-
[Ag(NH3)2]+ = Ag+ + 2NH3,

В присутствии избытка аммиака равновесие диссоциации комплексного иона сильно сдвинуто влево, так что количеством аммиака, образующимся при вторичной диссоциации можно пренебречь. Тогда
[NH3]= 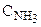 = 1 моль/л
= 1 моль/л
По этой же причине равновесная концентрация комплексных ионов может быть приравнена к исходной концентрации соли:
[Ag(NH3)2+] =  моль/л
моль/л
Отсюда находим концентрацию ионов серебра в растворе:
 моль/л
моль/л
Условие образования осадка иодида серебра:
[Ag+][I-]>ПРAgI=1,5ž10-16
[Ag+][I-]=5,9ž10-9ž10-4=5,9ž10-13>ПРAgI
Следовательно, осадок иодида серебра образуется.
Факторы, влияющие на устойчивость комплексных соединений
Устойчивость комплексной частицы зависит от природы комплексообразователя и лигандов.
Способность ионов металлов к комплексообразованию увеличивается в ряду: s- << p- < d- < f-элементы. Наиболее прочные комплексы образуют d- и f-элементы, среди которых можно выделить такие биогенные металлы, как Fe, Cu, Co, Zn, Mo. s-Элементы (Na, K, Ca, Mg) способны к образованию комплексов только полидентантыми лигандами, в том числе макроциклическими.
Прочность комплексов одного и того же металла с разными лигандами неодинакова и определяется принципом жестких и мягких кислот и оснований (ЖМКО).
|
|
|
Ионы тяжелых металлов Hg2+, Ag+, Pb2+, имеющие большой радиус и высокую поляризуемость (мягкие кислоты Льюиса), хорошо координируются с мягкими основаниями, в которых донорными центрами являются атомы S, P, I. Например, хорошо известно высокое сродство таких элементов, как сера и ртуть, отсюда название RSH – меркаптаны (лат. «тело, ловящее ртуть»).
Ионы металлов р-элементов (Al3+, Ca2+), напротив, предпочитают координацию с жесткими основаниями, в которых донорными центрами являются элементы с малым радиусом и низкой поляризуемостью (N,O, F). Все сказанное может быть проиллюстрировано величинами констант нестойкости комплексных ионов:
| HgI4- | HgBr4- | HgCl4- | HgF+ | AlF63- |
| 1,48ž10-30 | 1ž10-21 | 6,02ž10-16 | 2,75ž10-2 | 2,14ž10-21 |
Наиболее устойчивые комплексы образуют полидентантные лиганды (хелатный эффект), особенно макроциклические. Наиболее часто в составе бионеорганических комплексов встречаются такие макроциклические лиганды, как производные порфина – порфирины. Они составляют основу таких важных соединений, как гемоглибин, цитохромы, хлорофилл (см. также лекцию 7).

Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям:
[HbžFe2+] + O2 = [HbžFe2+žO2]
дезоксигемоглобин оксигемоглобин
В составе простетической группы гемоглобина – гема – ион Fe2+ образует шесть донорноакцепторных связей: четыре - с атомами азота порфиринового кольца, пятую - с азотом имидазольного кольца гистидина и шестую - с молекулой кислорода.
Донорноакцепторную связь с железом гемоглобина образует также оксид углерода(II)(угарный газ), на чем и основано его токсическое действие.
[HbžFe2+] + СO = [HbžFe2+žСO]
Комплекс СО с гемоглибином гораздо прочнее оксигемоглибина (константы устойчивости различаются в 200 раз), поэтому при вдыхании угарного газа большая часть гемоглобина переходит в карбонилгемоглобин, что и вызывает отравление организма. Разрушение токсичного карбонилгемоглобина возможно в соотвествии с принципом Ле Шателье в присуствии большого избытка кислорода
O2 + [HbžFe2+žСO] = [HbžFe2+žO2] + СО
|
|
|


