 |
Лабораторная работа №3 «Получение галогенопроизводных
|
|
|
|
Углеводородов непрямым галогенированием
кислородосодержащихорганических соединений»
Непрямое галогенирование – замещение галогеном функциональной группы ОН будете осуществлять в бутиловом спирте, синтезируя бромистый бутил.
Синтез бромистого бутила:
KBr + Н2SО4 ↔ НВr + КНSО4,
С4Н9ОН + НВr↔ С4Н9Вr + Н2О
Реактивы: н-бутиловый спирт - 37 г (46 мл), бромид калия – 75г, серная кислота концентрированная - 50 мл, гидросульфит натрия, хлорид кальция (прокаленный).
Посуда: круглодонная колба 500 мл, холодильник обратный, изогнутая стеклянная трубка, холодильник Либиха, делительная воронка, колба Вюрца, термометр, аллонж, колба плоскодонная.
В круглодонную колбу объемом 0,5л помещают 70 мл воды, 75г мелко растертого бромида калия, 46 мл н-бутилового спирта и несколько кусочков керамики. Колбу соединяют с обратным холодильником, вставляют в верхнее отверстие воронку и через неё небольшими порциями (5-7 мл) вливают 50 мл концентрированной серной кислоты, каждый раз хорошо помешивая смесь покачиванием колбы.
Содержимое колбы нагревают на воздушной бане при слабом кипении в течение двух часов. После этого заменяют обратный холодильник на нисходящий (холодильник Либиха), соединив его с колбой при помощи изогнутой стеклянной трубки, и, усилив нагревание, быстро отгоняют бромистый бутил. В полученном бромистом бутиле содержатся примеси воды, бутилового спирта, бутилен и следы брома.
Сырой продукт промывают в делительной воронке раствором гидросульфита натрия для удаления следов брома. Отделив водный слой, переливают бромистый бутил в сухую делительную воронку и очищают его от примесей промыванием равным объемом концентрированной серной кислоты. Кислоту отделяют, промывают бромистый бутил последовательно водой, раствором гидрокарбоната натрия и снова водой. Сливают продукт в небольшую сухую колбу и удаляют воду, добавляя в колбу несколько кусочков прокаленного хлорида кальция.
|
|
|
Присутствие воды может привести к разложению вещества при перегонке или к появлению новых фракций, что связано с потерей основного вещества. Через 20-30 мин. жидкость фильтруют или сливают декантацией и подвергают перегонке. Собирают фракцию с температурой кипения 98-103°С. Выход 50-55г. Температура кипения препарата 101,5°С, удельный вес 1,299г/мл.
Вопросы:
1. Чем принципиально отличаются способы прямого и непрямого галогенирования?
2. Приведите примеры реакции непрямого галогенирования.
3. Какие вещества наиболее часто используются в качестве исходных в процессах непрямого галогенирования?
4. Написать реакции галогенирования спирта, альдегида, кетона, карбоновой кислоты.
5. Какие хлорирующие реагенты являются наиболее эффективными при непрерывном галогенировании?
6. У какого атома углерода - первичного, вторичного или третичного - легче всего замещается гидроксильная группа и почему
7. Сравните реакционную способность гидроксила жирного и ароматического спиртов в реакциях их гидрохлорирования.
8. Прямое галоидирование осуществляют либо на свету, либо применяя катализаторы. Какие отличия в механизмах процессов при этом имеет место?
9. Приведите примеры радикально-цепного галоидирования. Назовите отдельные стадии процесса.
10. Приведите пример ионного механизма прямого галоидирования.
11. Приведите примеры реакции галоидирования альдегидов, кетонов, кислот.
12. Объясните, почему в реакциях каталитического галоидирования галоген является электрофильным реагентом?
Тема: Эфиры с открытой цепью и циклические эфиры
Теоретическая часть
Эфирами называют кислородсодержащие органические соединения, в которых две атомные группировки (органические или органическая и неорганическая) связаны кислородным атомом.
|
|
|
Эфиры могут быть простыми (I) и сложными (II):

В зависимости от характера радикала, связанного с атомом кислорода, эфиры могут быть предельными и непредельными:

Эфирыс открытой цепью (простые эфиры) можно рассматривать либо как ангидриды спиртов, либо как диалкилпроизводные воды. Это значительно менее реакционноспособные соединения, чем спирты, ближайшими производными которых они являются.
Простые эфиры (оксиды алкилов)— это органические соединения, в которых два углеводородных радикала связаны между собой атомом кислорода (кислородным мостиком).
Общая формула простых эфиров R–О–R
Строение. Простые эфиры можно рассматривать как продукты замещения двух водородных атомов в молекуле воды на углеводородные радикалы:

или замещение гидроксильного водорода в молекуле спирта на один радикал:.
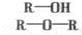
Простые эфиры изомерны спиртам. Например, молекулярной формуле С2Н6О соответствуют простой эфир — диметиловый СН3–О–СН3 и этиловый спирт С2Н5ОН.
Электронное строение диметилового эфира можно представить формулой:

Номенклатура. Названия простых эфиров обычно связывают с названиями радикалов, соединенных с атомом кислорода;

По систематической номенклатуре вначале называют алкоксигруппу (R—О—), а затем углеводород, с которым она связана:

Если два радикала, связанные с кислородом, одинаковые, то приставку ди- опускают. Например, диметиловый эфир называют метиловым, диэтиловый — этиловым.
Изомерия. Структурная изомерия простых эфиров зависит от изомерии углеводородных радикалов, связанных с кислородом:

|

Получение. Простые эфиры в природе не встречаются. Их получают синтетическим путем:
1. Дегидратацией спиртов под влиянием минеральных кислот.

Механизм этой реакции заключается в следующем. Протон присоединяется к электронной паре атома кислорода. Образуется оксониевое соединение:

От неустойчивого оксониевого соединения отщепляется молекула воды и образуется карбкатион:

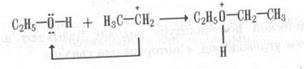
|
Этот карбкатион электрофильно атакует вторую молекулу спирта, которая предоставляет электронную пару для образования связи О —С:
|
|
|
Реакция заканчивается отщеплением протона:

|
| 2. Взаимодействием галогеналкилов с алкоголятами: |

|
Физические свойства. Диметиловый и метилэтиловый эфиры — газы, начиная с диэтилового — бесцветные, легкоиспаряющиеся горючие жидкости.
Высшие простые эфиры — твердые вещества. Простые эфиры плохо растворяются в воде. Служат хорошими растворителями для органических веществ. Из-за отсутствия водородных связей между молекулами эфира их температуры кипения гораздо ниже, чем у соответствующих спиртов.
Химические свойства. Простые предельные эфиры — довольно инертные соединения. В отличие от сложных эфиров они не гидролизуются (не омыляются). Однако концентрированная серная кислота разлагает эти эфиры:

Металлический натрий при нагревании также расщепляет простые эфиры:

При взаимодействии эфира с концентрированным HI образуются спирт и йодистый алкил:

Непредельные простые эфиры (в отличие от предельных) легко гидролизуются в кислой среде:

Диэтиловый эфир, или этиловый эфир С2Н5–О–С2Н5 — очень подвижная, крайне огнеопасная жидкость с сильным "эфирным" запахом. Т. кип. 34,5°С. Пары эфира в 2,5 раза тяжелее воздуха, поэтому они способны "стелиться" по поверхности и могут воспламеняться от малейшей искры даже на расстоянии. С воздухом эфир образует взрывоопасную смесь. Окисляясь (особенно на свету), он образует гидропероксид, который разлагается со взрывом.
Чтобы избавиться от гидропероксида, достаточно взболтать эфир с раствором едкой щелочи или железного купороса. Для проведения некоторых синтезов часто требуется не только чистый, но и безводный эфир (абсолютный). Для получения такого эфира необходимо вначале проверить его на отсутствие гидропероксидов, а затем взболтать с водой для устранения следов спирта. Затем воду отделяют на делительной воронке, а ее следы удаляют с помощью металлического натрия.
Этиловый эфир применяют в качестве растворителя, в производстве бездымного пороха, искусственного шелка. Широко используют в медицине.
|
|
|
Винилбутиловый эфир СН2=СН—О–С4Н9 — жидкость с т.кип. 94,1°С, плохо растворима в воде. Получают взаимодействием ацетилена с бутиловым спиртом. Используют для получения некоторых сополимеров, а также для синтеза поливинилбутиловою эфира:

Этот полиэфир известен как бальзам Шостаковского, который применяют при лечении ран и язв.
Образование простых и сложных эфиров. Взаимодействуя со спиртами или кислотами (органическими или неорганическими), гликоли образуют простые и сложные эфиры:

Реакция Вильямсона синтез– получение простых эфиров (обычно несимметричных) производят алкилированием алкоголятов или фенолятов алкилгалогенидами:



Для синтеза алифатических эфиров смесь алкоголята с алкилгалогенидом RHal кипятят без растворителя или в растворителе, индифферентном к реагентам (например, в эфире, толуоле, ксилоле). Используют также спиртовые растворы КОН или алкоголятов.
Для синтеза алкилариловых эфиров кипятят смесь небольшого избытка AlkHal и фенолята в спиртовом растворе. В качестве растворителя используют также воду, ацетон, этилацетат, диоксан, толуол, ксилол, хлорбензол. Углеводы О-метилируют в жидком NH3 действием Na, затем СН3I.
Растворитель часто оказывает решающее влияние на выход продуктов реакции. Например, высокий выход эфиров из орто- и паро-гидроксибифенилов достигается при проведении реакции в ацетоне; в спирте же выходы крайне низкие. Обычно выходы арилалкиловых эфиров с первичными и вторичными алкильными радикалами составляют 80-90%. Как диалкиловые, так и алкилариловые эфиры часто удобно синтезировать в условиях межфазного катализа. Для повышения скорости реакции при использовании RBr и RCI в реакционную смесь добавляют NaI в количестве 0,1-0,2 эквивалента.
В качестве побочных продуктов в реакции образуются олефины:

Их количество возрастает в зависимости от структуры AlkHal в ряду: первичные < вторичные < третичные. Поэтому при получении эфира, содержащего разветвленный радикал, следует выбирать такую комбинацию реагентов, чтобы разветвленный радикал входил в состав молекулы алкоголята. Для уменьшения выхода олефинов целесообразно также снижение температуры реакции и использование менее реакционноспособных алкоголятов (напр., магниевых) и алкилгалогенидов (хлоридов и бромидов вместо иодидов).
Получение алкилариловых эфиров часто сопровождается алкилированием бензольного кольца (С-алкилирование). Эта реакция особенно характерна для многоосновных фенолов, содержащих ОН-группы в мета-положениях. Направление этой реакции существенным образом зависит от растворителя: в спирте, ацетоне, преобладает О-алкилирование (т.е. образование простых эфиров), в водных растворах, а также в менее полярных растворителях, таких, как бензол, толуол,-С-алкилирование. Для уменьшения доли продукта С-алкилирования реакцию проводят в слабощелочной среде.
|
|
|
Синтез осуществляется обычно по механизму бимолекулярного нуклеофильного замещения. В случае третичных RHal преобладает мономолекулярное нуклеофильное замещение и элиминирование.
В модификациях синтеза в качестве алкилирующих агентов применяют диалкилсульфаты, что особенно удобно для алкилирования реакционноспособных спиртов (напр., бензилового, аллилового, коричного), углеводов и фенолов. Из др. алкилирующих агентов используют эфиры муравьиной кислоты, ортоэфиры и эфиры арил- и алкилсульфокислот, соли триалкилоксония. Для алкилирования гидроксикислот применяют алкилиодиды в присутствии Ag2O или ВаО. Реакция открыта А. Вильямсоном в 1851.
Интересным свойством сложных эфиров малоновой кислоты является подвижность водородных атомов метиленовой группы, заключенной между двумя карбонилами:
кетонная форма  енольная форма
енольная форма
малонового эфира
Действуя на этот эфир металлическим натрием, можно заместить подвижный атом водорода (в метиленовой группе) на натрий. Образуется натриймалоновый эфир:

Натриймалоновый эфир используют в органическом синтезе для получения различных одноосновных и двухосновных карбоновых кислот.
Сложные эфиры органических кислот можно рассматривать как производные этих кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал:
В образовании этих эфиров могут принимать участие низшие и высшие, предельные и непредельные карбоновые кислоты и спирты.
Названия сложных эфиров составляют из названий кислот и спиртов, остатки которых входят в состав молекулы эфира. По систематической номенклатуре сложные эфиры называют, прибавляя в качестве приставки название спиртового радикала к названию кислоты, в которой окончание -овая заменяют на –оат:
 муравьинометиловый эфир, или метилформиат, или метилметаноат
муравьинометиловый эфир, или метилформиат, или метилметаноат
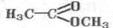 уксуснометиловый эфир, или метил-ацетат, или метилэтаноат
уксуснометиловый эфир, или метил-ацетат, или метилэтаноат
 маслянопропиловый эфир маслянопропиловый эфир
|
Структурная изомерия определяется изомерией углеводородных радикалов кислот и спиртов, участвующих в образовании сложных эфиров:

|
изомасляноизопропиловый эфир
Обычно сложные эфиры органических кислот получают реакцией этерификации — взаимодействием кислот со спиртами в присутствии катализатора — минеральной кислоты (например, конц. H2S04):

Доказано, что выделение молекулы воды при реакции этерификации происходит за счет гидроксила карбоксильной группы и атома водорода гидроксильной группы спирта.
Механизм реакции этерификации. Протон минеральной кислоты (катализатор) связывается с кислородом карбонильной группы. Образуется карбкатион (I), который подвергается нуклеофильной атаке со стороны молекулы спирта. Возникшее неустойчивое оксониевое соединение (II), теряя воду, превращается и карбкатион (III). Этот продукт при отщеплении протона дает сложный эфир:

|

|
Реакция этерификации обратима. Чтобы сместить равновесие вправо, необходимо связывать (удалять) образующуюся воду.
Химические свойства. 1. Реакция гидролиза (омыление). Эта реакция обратна реакции этерификации. Протекает она в кислой или щелочной среде:

2. Восстановление. Реакция приводит к образованию смеси двух спиртов (восстановители — этилат натрия или LiAlН4)

|
3. Образование амидов:

|
В образовании сложных эфиров неорганических кислот чаще принимают участие серная, азотная и фосфорная кислоты.
Из эфиров серной кислоты наибольшее значение имеют метил-, этилсульфаты (алкилсерные кислоты). Это кислые эфиры:

При действии дымящей серной кислоты на избыток спирта образуются средние эфиры:

Их эфиров азотной кислоты практическое значение имеют тринит-рат глицерина (нитроглицерин) и амилнитрат:

Многие эфиры фосфорной кислоты обладают высокой физиологической активностью. Например, некоторые производные диметилфосфата

используют в качестве сильнейших инспектицидов. Одним из них является хлорофос:

К эфирам фосфорной кислоты относятся нуклеиновые кислоты и фосфолипиды, играющие важную роль в жизнедеятельности организмов.
Еще более инертными являются диариловыке эфиры, расщепление эфирной связи в которых протекает с большим трудом. Наоборот, простые эфиры многоатомных спиртов обладают более высокой химической активностью. Их производные - целлозольвы и карбитолы вырабатываются в промышленном масштабе и применяются как растворители, сочетающие свойства спирта и эфира, например, в лакокрасочной промышленности. Кроме того, некоторые производные простых эфиров являются сильнодействующими отравляющими веществами ("иприт").
В противоположность эфирамс открытой цепью, циклические простые эфиры ( органические окиси ), и в первую очередь окисьэтилена, обладают высокой химической активностью, чем и объясняется широкое её использование в промышленных синтезах для получения уксусного альдегида, диоксана, эфиров моно-, ди- и полиэтиленгликоля, этаноламинов, акрилонитрила, синтетических моющих средств и т.д.
Этилформиат (этилметаноат) Н—СООС2Н5 — жидкость, растворимая в воде и спирте. Т.кип.54,3 °С. Используют в качестве растворителя нитрата и ацетата целлюлозы, в производстве витамина Bi, отдушки для мыла и как компонент пищевых эссенций.
Этилацетат (этилэтаноат) СНз–СООС2Н5— жидкость, кипящая при 77,1°С. Применяют как растворитель для эфиров целлюлозы, хлоркаучука, жиров, восков. Используется как отдушка для мыл.
Диметилсульфат 02S(0СНз)2 — жидкость с т.кип. 188,5°С. Применяют в качестве метилирующего агента (введение в молекулу метильной группы) в органическом синтезе. Сильно ядовит.
Амилнитрат C5H11ONO2 — жидкость с т.кип. 157°С, плохо растворимая в воде, но хорошо в спирте. Служит добавкой к дизельному топливу для улучшения его качества. Раньше использовался в медицине.
Тринитрат глицерина (нитроглицерин) — жидкость, растворимая в ацетоне, бензоле, плохо в воде. Мощное бризантное взрывчатое средство. Требует чрезвычайной осторожности (очень чувствителен к механическим воздействиям и нагреванию). Входит в состав динамитов (смеси нитроглицерина с порошкообразными наполнителями) и баллиститных порогов. Применяют в медицине (сосудорасширяющее средство).
Ацетоуксусный эфир существует в двух формах — кетонной и енолъной:

Сосуществование двух изомерных форм, находящихся в равновесии и способных самопроизвольно переходить друг в друга, называется динамической изомерией или таутомерией (от греч. tauto — тот же самый и meros — часть). Переходящие при этом друг в друга формы называются таутомерами.
Кето-енольная таутомерия относится к прототропной таутомерии, так как она сопровождается переносом протона:

При обычной температуре ацетоуксусный эфир содержит 93 % кетонной и 7 % енольной формы. Содержание енольной формы может быть различным в зависимости от характера растворителя. Чем более полярен растворитель, тем меньше в нем енольной формы (например, в воде ее содержание составляет 0,4 %, а в гексане — 46,4 %).
Ацетоуксусный эфир подобен "двуликому Янусу": он способен проявлять свойства двух разных веществ. Для него характерны реакции как кетонной, так и енольной форм.

|

|
При проведении реакций, характерных для енольной формы, ее содержание постепенно увеличивается за счет перехода из кетонной формы.
Енольная форма ацетоуксусного эфира дает качественную реакцию с хлоридом железа (III). В этом случае происходит образование окрашенной в красный цвет комплексной соли.
Ацетоуксусный эфир широко используют в органическом синтезе для получения многих органических веществ. Кроме этого эфир сыгpал в свое время большую роль в развитии теоретической органической химии. На его примере было показано, что некоторые органические вещества не так просты, как это может показаться на первый взгляд. В зависимости от того, в какой форме они находятся, вещества могут проявлять различные химические свойства.
В образовании сложных эфиров, входящих в состав жиров, могут принимать участие разные высшие жирные кислоты, но из спиртов только один — глицерин. Поэтому эти эфиры называют глицеридами (ацилглицеринами):

В состав жиров в основном входят триглицериды, но могут присутст-ковать и ди- и моноглицериды:

|

Наиболее распространенные остатки высших кислот, содержащиеся в жирах, содержат от 12 до 18 углеродных атомов. В состав некоторых жиров входят в небольшом количестве также остатки кислот с С2–С10
Глицериды, содержащие кислотные остатки (ацилы) одинаковых кислот, называют простыми, а если в состав глицеридов входят разные ацилы, то — смешанными:

|
Вопросы:
1. Напишите реакцию образования диэтилового эфира дегидратацией этилового спирта в присутствии серной кислоты.
2. Напишите реакцию Вильямсона образования простых зфиров.
3. Расскажите о способах получения окиси этиленав промышленности.
4. Подучите уксусный альдегид,уксусную кислоту и этиловый спирт из окиси этилена.
5. На основе окиси этилена получите моноэфиры ди- и полиэтиленгликоли.
6. Приведите примеры реакций получения сложных моноэфиров этиленгликоля, ди- и полиэтиленгликоля.
7. Охарактеризуйте химическую активность линейных простых эфиров в реакциях со щелочными металлами, галогеноводородами, концентрированной серной кислотой.
|
|
|


