 |
Общие сведения о фотометрии
|
|
|
|
Введение
Поставленная задача: Определение содержания сульфата меди в техническом препарате методом фотометрии и йодометрии.
Фотометрический метод анализа (Фотометрия), совокупность методов мол. абсорбционного спектрального анализа, основанных на избирательном поглощении электромагнитного излучения в видимой, ИК и УФ областях молекулами определяемого компонента или его соединения с подходящим реагентом. Концентрацию определяемого компонента устанавливают по закону Бугера -Ламберта - Бера. Фотометрический метод включает визуальную фотометрию, спектрофотометрию и фотоколориметрию. Последняя отличается от спектрофотометрии тем, что поглощение света измеряют гл. обр. в видимой области спектра, реже - в ближних УФ и ИК областях (т. е. в интервале длин волн от ~ 315 до ~ 980 нм), а также тем, что для выделения нужного участка спектра (шириной 10-100 нм) используют не моно-хроматоры, а узкополосные светофильтры. Колориметрический метод анализа был предложен русским ученым
В. М. Севергиным еще в 1795 г., В колориметрическом и фотоколориметрическом методах анализа используются химические реакции, при которых определяемое вещество переходит в окрашенное соединение, вызывающее изменение окраски анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора (фотоколориметрический анализ) или сравнивая интенсивность полученной окраски с окраской раствора известной концентрации (колориметрический анализ) определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества.
Эта зависимость, называемая законом Бугера - Ламберта - Бера, выражается уравнением:
|
|
|
I = I0* 10-eCl
где I - интенсивность светового потока, прошедшего через раствор; I0 - интенсивность падающего на раствор светового потока;
e - коэффициент поглощения светового потока - постоянная величина, характерная для каждого окрашенного вещества и зависящая от его природы;
С - концентрация окрашенного вещества в растворе;
l- толщина слоя светопоглощающего раствора, см.
Физический смысл этого закона можно выразить следующим образом.
Растворы одного и того же окрашенного вещества при одинаковой кронцентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
Окрашенный раствор поглощает различные длины волн света не в равной мере, 'Поэтому для увеличения точности и чувствительности используют поглощение не всего белого света, а только тех лучей, которые наиболее сильно поглощаются раствором. Для получения более точных результатов видимой области спектра выделяют лучи той волны, которая максимально поглощается данным раствором, т. е. используют монохроматический свет. Для выделения из белого света лучей определенной длины используют светофильтры. Светофильтром называют жидкие или твердые тела, обладающие различной прозрачностью для различных частей спектра, они поглощают все лучи, кроме узкого пучка лучей определенной области спектра.
Для проведения анализа важно правильно подобрать светофильтр; спектральная область минимального поглощения (или максимального пропускания) света правильно подобранного светофильтра совпадает с областью максимального поглощения окрашенным исследуемым раствором.
Йодометрия, называю метод объемного анализа. Основным веществом, применяемым в качестве окислителя в йодометрии, является йод ( =0,5345В). Йод окисляет все восстановители (
=0,5345В). Йод окисляет все восстановители (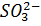 ,
, 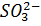 ,
,  ,HCHO и др), окислительно-восстановительный потенциал систем которых меньше
,HCHO и др), окислительно-восстановительный потенциал систем которых меньше  .
.
|
|
|
Кристаллический йод мало растворим в воде. Поэтому обычно в качестве стандартного раствора применяют его раствор KI.
При растворении йода в растворе иодида калия образуются [  ] ионы:
] ионы:
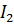 +
+  =[
=[  ]
]
Нормальный окислительно-восстановительный потенциал системы трииодид-иодид равен  =0,5355В, т.е окислительно-восстановительный потенциал системы
=0,5355В, т.е окислительно-восстановительный потенциал системы 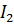 /2
/2  и [
и [  ]/3
]/3  можно практически считать равными.
можно практически считать равными.
Принципиальную схему реакции, протекающей при йодометрических определениях, можно представить следующим образом:
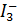 +2e=3I
+2e=3I
Следовательно, окислительно-восстановительный потенциал этой
системы не зависит от концентрации ионов водорода, если реакции протекают в кислых растворах.
Однако многие вещества, содержащие в своем составе атомы кислорода
и вступающие в реакции с [ 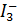 ], или
], или  , в присутствии ионов
, в присутствии ионов
водорода реагируют с образованием нейтральных молекул воды. Например:
Поэтому окислительно-восстановительные потенциалы таких систем
сильно зависят от [Н+] в растворе.
Применительно к реакции восстановления мышьяковой кислоты до
мышьяковистой иодистоводородной кислотой (или иодидами в кислой
среде) влияние [Н+] на потенциал рассматриваемой системы можно
выразить уравнением:
В кислых растворах вследствие того, что окислительно-восстановительный
потенциал системы сильно возрастает по сравнению с Е мышьяковая кислота окисляет до иода, образующего с избытком  трииодид-ионы. По мере уменьшения [Н+] уже вслабокислых и нейтральных и, в особенности, в щелочных растворах
трииодид-ионы. По мере уменьшения [Н+] уже вслабокислых и нейтральных и, в особенности, в щелочных растворах
и поэтому 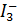 окисляет
окисляет
Следовательно, приведенные выше уравнения представляют собой
систему динамического равновесия, сильно зависящего от рН раствора.
Основным веществом, применяемым в качестве восстановителя,
в иодометрии является тиосульфат натрия, который реагирует с иодом
по уравнению:
Тиосульфат применяют для титрования избытка иода, добавляемого
в процессе титрования некоторых восстановителей, или иода, образующегося
при взаимодействии иодидов с окислителями, например:
Общие сведения о фотометрии
Определение меди основано на образовании окрашенного в синий цвет
|
|
|
комплексного катиона [Сu(NНз)4] +. Существующие комплексы с меньшим содержанием NH3 (1, 2 и 3 группы NH3), при длине волны от 590 до 615 нм поглощают свет в незначительной степени, но тем не менее для устранения этого влияния количество аммиака должно быть одинаковым в стандартных и анализируемых растворах. Чувствительность этого метода значительно ниже, чем в случае определения меди с диэтилдитиокарбаматом натрия. Однако простота метода и широкий диапазон концентраций, в котором соблюдается основной закон светопоглощения позволяет применять его для анализа в интервале концентраций от 0,5 до 50.0 г/дм, используя дифференциальный метод анализа. Молярный коэффициент светопоглощения комплекса при =610нм:.. Определению мешают ионы Ni, Со, Сг и др., дающие окрашенные комплексные катионы и нерастворимые гидроксиды. Наряду с исследуемым раствором готовят серию стандартных растворов меди для построения градуировочного графика. После получения окрашенного комплексного катиона [(CuNH)]2 измеряют оптические плотности исследуемого и стандартных растворов при. Кюветы стеклянные, см. В качестве раствора сравнения при абсолютном методе применяют дистиллированную воду.
|
|
|


