 |
Перечень экзаменационных вопросов и заданий по практическим навыкам
|
|
|
|
1.Вопрос:
Золь иодида серебра AgI получен в избытке раствора йодида калия. Определите заряд частиц полученного золя, напишите формулу его мицеллы и укажите, какой из электролитов: хлорид калия, нитрат бария или сульфат алюминия – будет обладать наибольшей коагулирующей способностью к полученному золю.
Ответ:
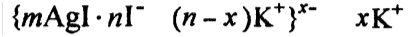
Т.к. по правилу Шульце –Гарди чем выше заряд иона, тем выше его коагулирующее действие, то наибольшей коагулирующей способностью будет обладать Al2(SO4)3
2.Вопрос:
Комплексная соль [Ag(NH3)2]Cl является соединением катионного типа. Определите степень окисления комплексообразователя и координационное число. Составьте уравнение первичной диссоциации соли. Напишите выражение Кн.
Ответ:
[Ag+1(NH3)02]Cl-1
степень окисления комплексообразователя = +1
Координационное число = 2
Первичная диссоциация
[Ag(NH3)2]Cl->[Ag(NH3)2]++Cl-
Кн= Кн1+ Кн2=[NH3]2*[Ag+]/[Ag(NH3)2+]
3.Вопрос:
Комплексная соль K4[Fe(CN)6] является соединением анионного типа. Определите степень окисления комплексообразователя и координационное число. Составьте уравнение первичной диссоциации соли. Напишите выражение Кн
Ответ:
K4+[Fe+2(CN)-6]
степень окисления комплексообразователя = +2
Координационное число = 6
Первичная диссоциация
K4[Fe(CN)6] ->4K++[Fe(CN)6]-4
Кн = [Fe2+]*[CN-]6/ [ [Fe(CN)6]4- ]
4. Вопрос:
Напишите структурную формулу ЭДТА. Определите дентатность соединения как лиганда. Укажите области его использования в медицине и в санитарной практике.
Ответ:
Полидентантный лиганд

5. Вопрос:
Определите энтальпию химической реакции:
С2H5OH(ж) + O2(г)®CH3COOH(ж) + H2O(ж)
по известным энтальпиям образования веществ:
DHo(CH3COOH) = - 485 кДж/моль;
DHo(H2O) = - 286 кДж/моль
DHo(С2H5OH) = - 278 кДж/моль
Ответ:
ΔHр=(DHo (CH3COOH)+ DHo (H2O))- DHo (С2H5OH)= (- 485+(- 286))-(-278)= -771+278=-493
|
|
|
6. Вопрос:
Объясните лечебное действие повязок с гипертоническим раствором при лечении гнойных ран, приведите примеры. На чём основано действие слабительных средств?
Ответ:


7. Вопрос:
Над раствором какого вещества: глюкозы, NaCl или Na3PO4 давление пара растворителя будет меньше, если температура и мольные доли веществ равны? Дайте обоснованный ответ, используя понятие изотонического коэффициента.
Ответ:


Чем больше кинетически активных частиц, тем выше осмотическое давление и ниже давление пара растворителя над раствором.
C6H12O6 – неэлектролит, 1 частица
NaCl ↔ Na+ + Cl- - 2 частицы
Na3PO4 ↔ 3Na+ + PO43- 4 частицы
Т.к. кинетически активных частиц больше в растворе фосфата натрия, давление пара растворителя над этим раствором будет меньше, чем в остальных растворах.
8.Вопрос:
Кислотно-основное титрование и реакции, лежащие в основе метода. Титранты алкалиметрии (с приготовленным и установленным титром). Формулы для расчета молярной концентрации эквивалента и титра:Cƒ(HCl) иT(HCl).
Ответ:
В основе кислотно-основного титрование — реакции нейтрализации
С установленным титром H2C2O4•10H2O
С приготовленным NaOH, HCl


9.Вопрос:
Определите изотонические коэффициенты для растворов: NaCl, Na2SO4 и Al2(SO4)3.Составьте ряд по увеличению π осм. этих растворов, если Cƒ экв. их равны 1 моль/л, а степень диссоциации составляет 0,5.
Ответ:
i= 1 + αдис (p - 1)
p - число ионов, на которые распадается молекула электролита
i(NaCl) = 1+0.5=1.5
i(Na2SO4)=1+0.5(3-1)=2
i(Al2(SO4)3)=1+0.5(5-1)=3
p=icRT
p(NaCl) = 1.5*1*8.31*273=3403 Па
p(Na2SO4)=4537 Па
p(Al2(SO4)3)= 6806 Па
p(NaCl)< p(Na2SO4) < p(Al2(SO4)3)
10.Вопрос:
Поясните, в чем суть процесса желатинирования (застудневания) и определите, какой из электролитов (NH4)2SO4 или NaCl, усилит процесс желатинирования и по какой причине.
Ответ:
Застудневание, студнеобразование, гелеобразование, желатинирование, желатинизация, превращение легко подвижной или вязкотекучей жидкости в твердообразное (т. е. лишённое текучести) тело, обладающее эластичностью, пластичностью, хрупкостью. Застудневание характерно для растворов высокомолекулярных соединений и коллоидно-дисперсных систем.
|
|
|
В лиотропном ряду (ряду анионов) жесткие основания (SO42-) подавляют набухание, а мягкие (Cl-) усиливают. Начальной стадией желатинирования является набухание, поэтому электролит NaCl усилит этот процесс
11.Вопрос:
Набухание и растворение ВМС. На примере лабораторной работы поясните термодинамику процесса набухания.
Ответ:


(см. лаб.работу – Набухание желатина)
12.Вопрос:
Что такое онкотическое давление? Как оно связанно с возникновением отёков?
Ответ:
13.Вопрос:
Титрование, титрант, титр (раствор с приготовленным и установленным титром). Виды титриметрического анализа.
Ответ:
Титр – один из видов концентрации, который определяется отношением массы вещества, в граммах, содержащегося в 1 мл раствора
Титрование – процесс медленного добавления раствора титранта(стандартный раствор, рабочий раствор) к анализируемой пробе под контролем индикатора.
Титра́нт — реагент с точно известным титром (концентрацией), добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп).
Раствор с приготовленным титром – вещества, которые выдерживают предъявляемые требования(Na2CO3•10H2O; H2C2O4•10H2O; Na2B4O7•10H2O)
Раствор с установленным титром –вещества, которые не выдерживают предъявляемы требования, неустойчивы при хранении требуют стандартизации(NaOH, HCl, KMnO4, AgNO3)
Титриметрический анализ может быть основан на различных типах химических реакций:
· кислотно-основное титрование — реакции нейтрализации;
· окислительно-восстановительное титрование (перманганатометрия, иодометрия, хроматометрия, цериметрия, броматометрия, ванадатометрия) —окислительно-восстановительные реакции;
· осадительное титрование (аргентометрия, гексоцианоферратометрия, меркурометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе;
· комплексиметрическое титрование — реакции, основанные на образовании прочных комплексных соединений, например, с комплексоном (обычноЭДТА), при этом изменяются концентрации ионов металлов в титруемом растворе.
|
|
|
14.Вопрос:
Кислотно-основное титрование. Титранты ацидиметрии и алкалиметрии. Точка эквивалентности; точка конца титрования. Выбор индикатора по кривой титрования.
Ответ:
Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией
Точка эквивалентности (конечная точка титрования) в титриметрическом анализе момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
В начале титрования добавление небольшого количества титранта не оказывает влияние на рН раствора. По мере приближения к точке эквивалентности увеличение рН идет более быстро. Добавление последней капли рабочего раствора приводит к резкому изменению рН титруемого раствора и изменению цвета индикатора.
Резкое изменение рН раствора вблизи точки эквивалентности называется скачком титрования. Середина скачка титрования соответствует точке эквивалентности.
В данном случае рН в точке эквивалентности будет нейтральной, т.к. образующаяся в результате реакции нейтрализации соль не подвергается гидролизу.
Следовательно, при титровании сильных кислот сильными основаниями (и наоборот) можно применять индикаторы, интервал перемены окраски которых от 4 до 10 (метиловый красный, метиловый оранжевый, фенолфталеин и др.). Наиболее подходящим будет тот, у которого рТ=7.
Однако необходимо учесть, что присутствие растворимого оксида углерода (IV) в растворе смещает рН точки эквивалентности в кислую среду, поэтому обычно применяют метиловый оранжевый (рТ=4). Довольно значительное отклонение рТ данного индикатора от рН в точке эквивалентности в данном случае не имеет значения, т.к. для изменения окраски индикатора необходимо прилить к раствору очень малый (менее 1 капли) избыток рабочего раствора.
|
|
|
15.Вопрос:
Перечислите коллигативные свойства растворов. Сопоставьте процессы диффузии и осмоса. Поясните явление эндоосмоса и его последствие – лизис (гемолиз).
Ответ:


Явление преимущественно одностороннего проникновения растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией называется осмосом.

Гемо́лиз — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. Гемолиз наступает при попадании эритроцита в среду, где его внутриклеточное содержимое будет гипертоничным по отношению к контактирующему раствору.
16.Вопрос:
Какие свойства растворов называются коллигативными? Поясните явление экзоосмоса и его последствия – плазмолиза. Использование этого явления в медицине.
Ответ:
Коллигативные св-ва см. предыдущий вопрос.

17.18.Вопрос:
Над каким из растворов при одинаковых молярных концентрациях давление пара растворителя будет наибольшим:
а) NaCl; б) фруктоза (C6H12O6); в) Al2(SO4)3.
Ответ поясните.
Ответ:
Чем больше кинетически активных частиц, тем выше осмотическое давление и ниже давление пара растворителя над раствором (с учетом изотонического коэффициента).
NaCl ↔ Na+ + Cl- - 2 частицы
C6H12O6 – неэлектролит, 1 частица
Al2(SO4)3 ↔ 2Al3+ + 3SO42- - 5 частиц
Давление пара растворителя будет наибольшим над раствором фруктозы.
19.Вопрос:
На титрование 5 мл ацетатного буфера затрачено 3 мл раствора NaOH(Cf) =0,1 моль/л. Рассчитайте буферную емкость системы, если рНо = 3, а после титрования рН = 7,5.
Ответ:

B = 0,1моль.л *0,003л / │3-7,5│*0,005л = 0,013
20.Вопрос:
Комплексонометрия (трилонометрия): принцип метода, титрант, индикатор, реакции лежащие в основе метода. Применение метода трилонометрии в санитарной практике и медико-биологических исследованиях.
Ответ:

21.Вопрос:
Окислительно-восстановительное титрование (перманганатометрия): титрант, индикатор и реакции, лежащие в основе метода. Применение перманганатометрии в медико-биологических исследованиях.
Ответ:
Оксидиметрия -титриметрический метод анализа, в котором количество анализируемого вещества определяется на основе ОВ реакции между анализируемым веществом и титрантом.
Перманганатометрия - метод объемного анализа, в котором в качестве титранта - окислителя используется раствор перманганата калия.
Ион МnO4 проявляет окислительные свойства в кислой, нейтральной, щелочной средах, восстанавливаясь соответственно до катиона Мn2+ (бесцветные ионы), до молекулы МnO2 (бурый осадок), или до аниона МnO42- (зеленый раствор, буреющий на воздухе).
|
|
|
Течение реакции сопровождается обесцвечиванием прибавляемого раствора KMnO4, вплоть до точки эквивалентности. Лишняя капля перманганата калия окрасит титруемый раствор в длительно неисчезающий розовый цвет.
Перманганатометрия в медицинской практике применяется для определения содержания некоторых витаминов в водных растворах, активность некоторых ферментов, например, каталазы; для определения мочевой кислоты, сахара в крови, ионов кальция в сыворотке крови. Для определения содержания ионов кальция в пробе приливают определенный объём кислоты, взятой в избытке. Часть щавелевой кислоты взаимодействует с ионами кальция:
С2O42- + Са2+ = СаС2O4
Остаточное количество щавелевой кислоты, не связанное кальцием, отитровывают раствором перманганата калия известной концентрации, что можно выразить уравнением:
5Н2С204 + 2KMn04 + 3H2S04 = 2MnS04 + K2S04 + 10СО2 + 3H20.
22.Вопрос:
Потенциометрическое титрование: титрант метода, графическое определение точки эквивалентности. Преимущества данного вида титрования перед перманганатометрией. Применение потенциометрии в медико-биологических исследованиях.
Ответ:
В объемном титриметрическом анализе для определения точки эквивалентности часто пользуются методом потенциометрического титрования. При по-тенциометрическом титровании необходимо иметь в исследуемом растворе два электрода. Потенциал одного из них меняется в зависимости от концентрации титруемого раствора; этот электрод называется электродом определения. Другой электрод, потенциал которого не меняется в процессе титрования служит для определения потенциала первого электрода, и называется электродом сравнения. Таким образом, сущность потенциометрического титрования заключается в измерении потенциала электрода определения.
Для наглядности изображения хода титрования и более точного нахождения точки эквивалентности строят кривую титрования. Для этого на ось ординат наносят значения ЭДС гальванической цепи, а на оси абсцисс - объем титранта в миллилитрах.
Преимущество потенциометрического титрования по сравнению с индикаторным состоит в том, что этот метод можно применять для анализа окрашенных и мутных растворов, многокомпонентных систем.
Потенциометрия используется для определения рН крови и других биологических жидкостей в норме и патологии для изучения кинетики и механизма некоторых реакций биологического окисления, для контроля за физиологическими процессами.
23.Вопрос:
Осадительное титрование (аргентометрия). Принцип выбора индикатора. Реакции, лежащие в основе данного метода
Ответ:
МЕТОД ОСАЖДЕНИЯ, в котором в качестве титранта используется раствор AgNO3, образующий осадки с определенными ионами, называется аргентометрией (Ag+ с ионами Cl-, Br-, I-, CNS-, CrO42- образует осадки малорастворимых солей серебра).
В этом методе в качестве титранта для определения анионов применяют раствор нитрата серебра.
ОПРЕДЕЛЕНИЕ СОСТОЯНИЯ ЭКВИВАЛЕНТНОСТИ – устанавливают с помощью индикаторов. Выбор производят согласно правила последовательности осаждения определяемых ионов.
Наиболее широко применяют хромат калия K2CrO4, образующий с ионами серебра осадок кирпично-красного цвета Ag2CrO4(метод Мора), используют для определения концентрации хлорид- и бромид-ионов. Индикатор должен образовывать с ионами титранта окрашенный осадок только после полного осаждения определяемых ионов.
Растворимость осадков, образующихся при титровании в методах осаждения, должна быть наименьшей и не превышать I*10-5 моль/л. Чем меньше растворимость осаждаемого соединения, тем точнее титрование.
Титрование проводят при комнатной температуре и 6.5<pH<10.
Пробу анализируемого раствора в присутствии индикатора K2CrO4 титруют стандартным раствором AgNO3. Вначале образуется белый осадок AgCl, выпадение осадка продолжается до тех пор, пока к анализируемому раствору не будет прибавлено эквивалентное содержание Clֿ количество титранта AgNO3. При достижении точки эквивалентности, лишняя капля раствора AgNO3 вызовет образование кирпично-красного осадка Ag2CrO4.
Таким образом, точку эквивалентности в аргентометрии определяют по образованию кирпично-красного осадка Ag2CrO4. По результатам титрования рассчитывают содержание хлорид-ионов в анализируемом растворе.
24.Вопрос:
Какую среду (рН) необходимо создать для окраски белков гистологических препаратов основным красителем (R-ОН)? Напишите схемы реакций. Для ответа используйте данные лабораторной работы.
Ответ:
Следует создать щелочную среду для лучшей окраски. Доказывается это окраской белка метиленовым синем, из 3 пробирок(контрольная, с кислой средой, с щелочной средой) интенсивнее окрашивается шерсть в пробирке с щелочной средой.
-OOC–R–NH3+ + HCl –> HOOC–R–NH3+ + HCl
H–R –> H+ + R-
-OOC–R–NH3+ +NaOH –> -OOC–R–NH2 + H2O + Na+
R-OH –> R+ + OH-
25.Вопрос:
Напишите строение мицеллы AgI при избытке AgNO3. Охарактеризуйте составляющие компоненты и поясните, какие факторы лежат в основе устойчивости коллоидных растворов.
Ответ:

Факторы:
Броуновское движение
размера и концентрации частиц вещества
температуры
вязкость
26.Вопрос:
Дайте определение гетерогенным процессам. При каких условиях образуются осадки? Бериллиевый и стронциевый рахиты
Ответ:
Гетерогенные процессы - процессы протекают на границе раздела двух фаз.

27.Вопрос:
Гидрофильные и гидрофобные адсорбенты (приведите примеры). На примере лабораторной работы, объясните адсорбцию фуксина из водного и спиртового растворов.
Ответ:
Гидрофобные адсорбенты – активированный уголь, сажа, графит.
Гидрофильные адсорбенты – алюмогель (Al2O3*xH2O), силикагель (SiO2*xH2O)
Фуксин – неполярный краситель. Он лучше адсорбируется активированным углем из полярного растврорителя воды по правилу Ребиндера-Шилова (Неполярные адсорбенты лучше всего адсорбируют неполряные адсорбаты из полярных растворителей).
28.Вопрос:
Как изменяется поверхностное натяжение мочи при появлении желчных кислот? Ответ поясните на примере лабораторной работы.
Ответ:
Присутствие желчных кислот понижает поверхностное натяжение мочи, а при отсутствии их поверхностное натяжение не изменяется. Доказывается это добавлением «серного цвета» при наличии желчных кислот он опускается на дно, а при отсутствии желчных кислот он остается на поверхности.
29.Вопрос:
Рассчитайте жесткость воды (ммоль/л), если на титрование исследуемой пробы воды объемом 5 мл пошло 1,5 мл раствора Трилона Б (молярная концентрация Cf=0,05 моль/л). Укажите вид жесткости воды.
Ответ:
ж = C(1/2Na2H2T)-Vcp(Na2H2T)
V(H20)
где Ж - общая жесткость воды в ммоль/л, характеризующая число миллимолей эквивалентов ионов Са2+ и Mg2+ в 1 л воды;
C(l/2Na2H2T) - молярная концентрация эквивалента трилона Б в титранте в моль/л.
Vcp(Na2H2T) - объём титранта, израсходованный на титрирование анализируемой пробы воды в мл.
V(H20) - объём воды, взятый для анализа, в мл.
Различают воду:
мягкую, общей жёсткости — 2 ммоль/л,
средней жёсткости 3-10 ммоль/л,
жёсткую более 10 ммоль/л.
Ж = 0,05 моль/л – 0,0015л / 0, 005л = 9,7 ммоль/л
Исследуемая вода средней жесткости.
30.Вопрос:
Рассчитайте рН растворов, если:
а) [Н+] = 10-3; б) [Н+] = 10-9.
Укажите характер среды.
Ответ:
При [Н+ ] = 10-3
pH=-lg[H+]=-lg10-3= 3 Реакция среды - кислая.
При [Н+ ] = 10-9
pH=-lg[H+]=-lg10-9= 9 Реакция среды - щелочная.
31.Вопрос:
Дайте определение поверхностно-активным веществам (ПАВ). Используя графическую зависимость, покажите, как влияет концентрация ПАВ в растворе на величину поверхностного натяжения.
Ответ:


32.Вопрос:
Охарактеризуйте понятия ацидоз и алкалоз. Назовите рН крови в норме и изменения этого показателя при ацидозе и алкалозе.
Ответ:
Ацидоз — смещение кислотно-щелочного баланса организма в сторону увеличения кислотности, из-за накопления в организме кислых продуктов (уменьшению рН).
Алкало́з — нарушение кислотно-щелочного равновесия организма, в сторону увеличения основности, характеризующееся абсолютным или относительным избытком оснований(увеличение pH)
pH в норме ≈ 7,4
Компенсированный ацидоз 7,35-7,4
Некомпенсированный ацидоз 6,8 -7,35
Компенсированный алкалоз 7,4-7,45
33.Вопрос:
Дайте определение буферным растворам. Перечислите буферные системы крови и укажите их состав. Какая из них вносит максимальный вклад в буферную емкость плазмы крови?
Ответ:
Буферные растворы – растворы, обладающие свойством сохранять определенное значение pH при разбавлении или добавлении небольших количеств кислот и щелочей
Гидрокарбонатный буфер является основной буферной системой плазмы крови, обеспечивающей около 55 % от всей буферной емкости крови.
| Гидрокарбонатная | HCO3- |
| H2CO3 | |
| Фосфатная | H2PO4- |
| HPO42- | |
| Белковая | Prot- |
| HProt | |
| Гемоглобиновая | Hb- |
| HHb | |
| Оксигемоглобиновая | HbO2- |
| HHbO2 |
34.Вопрос:
Что произойдет с эритроцитами если их поместить в:
а) гипертонический раствор; б) гипотонический раствор;
в) изотонический раствор?
Дайте пояснение.
Ответ:
Гипертон гипотон

В результате осмоса в гипертоническом растворе вода из эритроцитов выходит в плазму(из области с низкой концентрации вещества в область высокой), из-за чего эритроциты сморщиваются, в гипотоническом раствора вода из плазмы поступает в эритроцита, в результате чего эритроциты набухают и лопаются
35.Вопрос:
Приведите правило валентности-значности (Шульце-Гарди). На основе выполненной лабораторной работы определите, какой анион обладает максимальным коагулирующим действием, если коагуляция золя гидроксида железа Fe(OH)3была вызвана следующими электролитами: KCl, K2SO4, K3[Fe(CN)6].
Ответ:

Максимальное коагулирующее действие на золь гидроксида железа Fe(OH)3 с положительно заряженной гранулой (ПОИ – Fe3+) в соответствии с правилом Шульце-Гарди оказывают ионы [Fe(CN)6]3-, т.к. среди используемых электролитов их заряд наибольший.
37.. На нейтрализацию 20,00 мл раствора серной кислоты израсходовано 12,00 мл раствора щелочи с молярной концентрацией эквивалента 0,2000 моль/л. Вычислить молярную концентрацию эквивалента и титр серной кислоты в этом растворе.
Эталон решения:
2 NaOH + H2SO4 = Na2SO4 + 2 H2O
NaOH + ½ H2SO4 = ½ Na2SO4 + H2O
По закону эквивалентов:
с fэкв.(H2SO4)·Vр-ра (H2SO4)·= сf экв.(NaOH)·Vр-ра (NaOH) (1)
Из уравнения видно, что фактор эквивалентности H2SO4 равен ½, а фактор эквивалентности NaOH равен 1. Подставляя значения в формулу получим:
с(½ H2SO4) = 0,2000 моль/л · 12,00 мл / 20,00 мл = 0,1200 моль/л
Т(Н2SO4) = с(1/2 H2SO4) · M(1/2 H2SO4) / 1000, г/мл
Отсюда Т(Н2SO4) = 0,1200 моль/л·49 г/моль/1000 = 0,005880г/мл
Ответ: 0,005880г/мл
38. Рассчитайте массу натрия тетрабората Na2B4O7·10H2O, необходимую для приготовления раствора объемом 250 мл с молярной концентрацией эквивалента 0,1 моль/л, используемого для кислотно-основного титрования соляной кислотой по реакции:
Na2B407+2HCl+5H20 = 4H3B03+2NaCl.
Эталон решения.
Из уравнения видно, что эквивалентом натрия тетрабората является условная частица, равная половине его молекулы (одному иону водорода эквивалентна половина молекулы). Количество эквивалента натрия тетрабората, необходимое для приготовления заданного раствора:
n(l/2Na2B4O7-10H2O)=V· C(l/2Na2B4O7).
Подставляем данные из условия задачи:
п(1/2Ма2В4О7·10Н2О)=0,25л ·0,1моль/л=0,025моль
m(Na2B4O7·10H2O)=M(l/2Na2B4O7·10H2O)• n(l/2Na2B4O7·10H2O)
m(Na2B4O7·10H2O) = 0,5 •381,4г/моль•0,025моль=4,7675г.
Ответ: 4,7675г
39. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой DH0 = -6,08 кДж/моль, DS0 = -5,85 Дж/(моль×К). Оценить вклад энтальпийного и энтропийного фактора.
Эталон решения
Стандартную энергию Гиббса реакции рассчитаем по формуле:
DG0 = DH0 - T×DS0.
Подставив значения, получим:
DG0 = -6,08 кДж/моль - 298 К×(-5,85×10-3) кДж/(моль×К) =
= -4,34 кДж/моль.
В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный - благоприятствует. Самопроизвольное протекание реакции возможно при условии, если  , т.е., при низких температурах
, т.е., при низких температурах
40. Рассчитать тепловой эффект реакции окисления глюкозы:
С6Н12О6(г) + 6О2(г) = 6Н2О(ж) + 6СО2(г); DН0 =?
DН0обр.[C6H12O6(т)] = –1260 кДж/моль;
DН0обр.[CO2(г) ] = –393,5 кДж/моль;
DН0обр.[H2O(ж)] = –285,8 кДж/моль.
Эталон решения
DН0реакции = (6DН0обр[H2O(ж)] + 6DH0обр[CO2(г)]) – DH0обр[C6H12O6(т)] =
((6(–285,8) + 6(–393,5)) – (–1260) = –2815,8 кДж.
Ответ: –2815,8 кДж
41. Во сколько раз увеличится скорость химической реакции при повышении температуры от  = 100C до
= 100C до  = 800С, если температурный коэффициент скорости g равен 2?
= 800С, если температурный коэффициент скорости g равен 2?
Эталон решения
По правилу Вант-Гоффа: 
Ответ: Скорость реакции увеличится в 128 раз.
42. Что произойдет с эритроцитами при 310 К в 2-% растворе глюкозы (ρ=1,006 г/мл)?
Эталон решения
Эритроциты в гипотонических растворах за счет эндосмоса разрушаются, происходит гемолиз, а в гипертонических растворах сморщиваются (плазмолиз). Осмотическое давление определяется по закону Вант-Гоффа
pосм= с(Х)×R×T, где с(Х) = 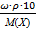
pосм=  =
= 
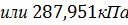
Ответ: pосм. крови= 740-780 кПа, поэтому данный раствор гипотоничен по отношению к крови, произойдет гемолиз.
43. Рассчитать изотонический коэффициент Вант-Гоффа для АlСl3, если «кажущаяся» степень диссоциации  = 80%.
= 80%.
Эталон решения
В растворе сильного электролита изотонический коэффициент рассчитывается по формуле:
i = 1 +  ∙(n – 1).
∙(n – 1).
Степень диссоциации  выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
выражается в долях единицы и равна 0,8. Для расчета n, т.е. числа ионов, на которые диссоциирует электролит, необходимо написать уравнение диссоциации:
AlCl3 Al3+ + 3Cl-
Таким образом:
n = 4,
i = 1 + 0,8×(4 – 1) = 3,4.
44. Определить рН ацетатной буферной системы, состоящей из 0,1 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия при одинаковых соотношениях компонентов.если
Ка (CH3 COOH) = - lg 1,8 ∙ 10-5
Эталон решения
По уравнению Гендерсона-Гассельбаха.
рН = рКк-ты – lg ск-ты/ссоли
рК= - lg 1,8 ∙ 10-5 =5 – lg 1,8 = 4,75
рН =4,75 - lg 0,1/0,1=4,75
Ответ: рН = 4,75
45. Рассчитать буферную емкость крови, если добавление к 50 мл крови 20 мл раствора HCl c C(HCl) = 0,05 моль/л вызвало снижение pH крови от 7,4 до 7,0.
Эталон решения.
Буферную емкость крови по кислоте рассчитаем по формуле
 Ответ: 50 ммоль/л
Ответ: 50 ммоль/л
46. Чтобы изменить рН на единицу, к 10 мл ацетатного буферного раствора потребовалось добавить 0,52 мл 1М раствора NaOH. Найти буферную емкость по щелочи (моль/л×ед.рН) данного буферного раствора.
Эталон решения
Буферную емкость по щелочи можно определить по формуле:
Восн. =  = =
= = 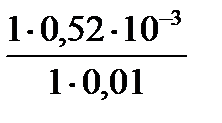 = 0,052 моль/л.ед. рН
= 0,052 моль/л.ед. рН
Ответ: 0,052 моль/л×ед. рН
47. В насыщенном растворе Ag2CrO4 концентрация CrO42- равна 10-4 моль/л. Найти  .
.
Эталон решения
Диссоциация Ag2CrO4 в растворе происходит по уравнению:
Ag2CrO4 2Ag+ + CrO42-.
Из стехиометрического соотношения между ионами следует, что в насыщенном растворе [Ag+] = 2×[СrО42-] = 2×10-4 моль/л.
Запишем математическое выражение для  и подставим значения концентраций ионов Ag+ и СrО42-:
и подставим значения концентраций ионов Ag+ и СrО42-:
 .
.
Ответ: 4· 10-12
48. Для комплексного соединения [Сr(NН3)5Br]Br2 определить заряд комплексообразователя, указать координационное число (к.ч.), дать название по международной номенклатуре, написать уравнения первичной и вторичной диссоциации и составить выражение для константы нестойкости комплексного иона.
Эталон решения
1) заряд комплексного иона равен +2, следовательно, алгебраическая сумма зарядов внутренней сферы: x + 0 - 1 = 2,
x = +3;
2) все лиганды монодентатные, следовательно, к.ч. = 6;
3) название: бромид бромопентамминхрома (III);
4) уравнения диссоциации:
[Сr(NН3)5Br]Br2 [Сr(NН3)5Br]2+ + 2Br- (первичная);
[Сr(NН3)5Br]2+ ⇄ Сr3+ + 5NН3 + Br- (вторичная).
5) выражение для константы нестойкости:
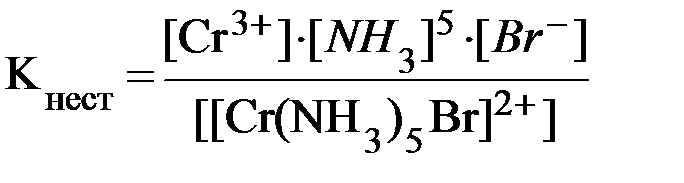 .
.
49. Допишите уравнения, расставьте коэффициенты, используя метод электронного или ионно-электронного баланса:
Н2О2 + KMnO4 + H2SO4 → MnSO4 + O2 + …
Na2HAsO3 + KBrO3 + HCl → Na2HАsO4 + Br2 + …
Fe2O3+ NaNO3+ NaOH → Na2FeO4+ NaNO2+ …
Рассчитайте фактор эквивалентности и молярную массу эквивалента окислителя и восстановителя.
50. Укажите направление реакции при стандартных условиях:
2Сr³+ + 3Br2 + 7H2O = Cr2O72- + 6Br-+ 14H+
Ecли: φº Br2/2Br- = +1,076 B
φº Cr2O7 2-/2Cr³+ = +1,36 B
Ответ поясните.
Эталон ответа
Для определения направления ОВР реакции можно пользоваться величиной её Э.Д.С.
Э.Д.С. О.В.Р. численно равна разности потенциалов ОВ пар, участвующих в реакции; О.В.Р. протекает самопроизвольно, если её Э.Д.С. >0;
Э.Д.С.= 1,076 - 1,36 = -0,284 (В).
Приведённая реакция будет идти в обратном направлении при стандартных условиях, от сильного окислителя к слабому сопряженному восстановителю, т.е. в обратном направлении.
51. В процессе тканевого дыхания происходит перенос протонов водорода и электронов от окисляемого субстрата на кислород с участием переносчиков, функцию которых выполняют ферменты. Исходя из значений окислительно-восстановительных потенциалов, составьте электронно-транспортную цепь последовательного переноса протонов и электронов от субстрата на акцептор.
| окислитель | восстановитель | Е0, в |
| Н2 | 2H+ | — 0,42 |
| ЦитохромыA (Fe2+) | ЦитохромыA(Fe3+) | + 0,29 |
| НАДФ • Н + Н+ | НАДФ+ | — 0,32 |
| Флавопротеин (восстановл.) | Флавопротеин (окисл.) | — 0,12 |
| Цитохром C1 (Fe2+) | Цитохром C1 (Fe3+) | + 0,23 |
| H2O | ½ О2 | + 0,82 |
| Кофермент Q • Н2 | Кофермент Q | + 0,04 |
|
|
|


