 |
Названия некоторых лигандов
|
|
|
|
Периодическая система элементов Д. И. Менделеева
| Период | Ряд | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| I | 1 H водород 1,00797 | (Н) | 2 Не гелий 4,0026 | ||||||
| II | 3 Li литий 6,939 | 4 Ве бериллий 9,012 | 5 В бор 10,811 | 6 С углерод 12,01115 | 7 N азот 14,007 | 8 О кислород 15,9994 | 9 F фтор 18,998 | 10 Ne неон 20,179 | |
| III | 11 Na натрий 22,990 | 12 Mg магний 24,312 | 13 Al алюминий 26,982 | 14 Si кремний 28,086 | 15 Р фосфор 30,974 | 16 S сера 32,064 | 17 Cl хлор 35,453 | 18 Ar аргон 39,948 | |
| IV | 19 К калий 39,102 | 20 Са кальций 40,08 | Sc 21 скандий 44,956 | Ti22 титан 47,90 | V23 ванадий 50,942 | Cr24 хром 51,996 | Mn25 марганец 54,938 | Fe26 Co27 Ni 28 железо кобальт никель 55,847 58,993 58,71 | |
| Cu29 медь 63,546 | Zn30 цинк 65,37 | 31 Ga галлий 69,72 | 32 Ge германий 72,59 | 33 As мышьяк 74,922 | 34 Se селен 78,96 | 35 Br бром 79,904 | 36 Kr криптон 83,80 | ||
| V | 37 Rb рубидий 85,47 | Sr стронций 87,62 | Y39 иттрий 88,905 | Zr40 цирконий 91,22 | Nb41 ниобий 92,906 | Mo42 молибден 95,94 | Tc43 технеций [99] | Ru 44 Rh45 Pd46 рутений родий палладий 101,07 102,905 106,4 | |
| Ag47 серебро 107,868 | Cd48 кадмий 112,40 | 49 In индий 114,82 | 50 Sn олово 118,69 | 51 Sb сурьма 121,75 | 52 Те теллур 127,60 | 53 I йод 126,904 | 54 Хе ксенон 131,30 | ||
| VI | 55 Cs цезий 132,905 | 56 Ва барий 137,34 | La * 57 лантан 138,91 | Hf72 гафний 178,49 | Ta73 тантал 180,948 | W74 вольфрам 183,85 | Re75 рений 186,2 | Os76 Ir77 Pt 78 осмий иридий платина 190,2 192,2 195,09 | |
| Au79 золото 196,967 | Hg80 ртуть 200,59 | 81 Tl таллий 204,383 | 82 Pb свинец 207,19 | 83 Bi висмут 208,98 | 84 Ро полоний [210] | 85 At астат [210] | 86 Rn радон [222] | ||
| VII | 87 Fr франций [223] | 88 Ra радий [226] | Ac ** 89 актиний [227] | Ku104 курчатовий [264] | |||||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |
| Летучие водородные соединения | RH4 | RH3 | RH2 | RH |
* Лантаноиды
|
|
|
| 58 Се церий | 59 Pr празеодим | 60 Nd неодим | 61 Pm прометий | 62 Sm самарий | 63 Eu европий | 64 Gd гадолиний |
| 65 Tb тербий | 66 Dy диспрозий | 67 Ho гольмий | 68 Er эрбий | 69 Tm тулий | 70 Yb иттербий | 71 Lu лютеций |
** Актиноиды
| 90 Th торий | 91 Pa протактиний | 92 U уран | 93 Np нептуний | 94 Pu плутоний | 95 Am америций | 96 Cm кюрий |
| 97 Bk берклий | 98 Cf калифорний | 99 Es эйнштейний | 100 Fm фермий | 101 Md менделевий | 102 No нобелий | 103 Lr лоуренсий |
Таблица растворимости неорганических соединений
| H+ | NH4+ | K+ | Na+ | Ag+ | Ba2+ | Ca2+ | Sr2+ | Mg2+ | Zn2+ | Cu2+ | Hg2+ | Pb2+ | Fe2+ | Sn2+ | Mn2+ | Bi3+ | Fe3+ | Al3+ | |
| OH- | Р | Р | Р | - | P | М | М | Н | Н | Н | - | Н | Н | Н | Н | Н | Н | Н | |
| Cl- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Н | Р | Р | Р | - | Р | Р |
| Br- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Н | Р | Р | Р | - | Р | Р |
| I- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Н | Р | Р | Р | - | Р | Р |
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | Р |
| S2- | Р | Р | Р | Р | Н | Р | М | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | - | - |
| SO32- | Р | Р | Р | Р | М | Н | Н | Н | Н | Н | Н | Н | Н | Н | - | Н | Н | - | - |
| SO42- | Р | Р | Р | Р | М | Н | М | Н | Р | Р | Р | Р | Н | Р | Р | Р | - | Р | Р |
| CO32- | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | - | Н | Н | - | - |
| PO43- | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | М | Н |
| SiO32- | Н | - | Р | Р | - | Н | Н | Н | Н | Н | Н | - | Н | Н | - | Н | - | Н | Н |
| СH3COO- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | - | Р | М |
Электрохимический ряд активности металлов
Cs Li K Rb Sr Ba Ca Na Mg Be Al Zn Cr W Fe Co Ni Sn Pb H Sb Bi Cu Ag Hg Pt Au
Активность металлов уменьшается 
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ






 ПРОСТЫЕ СЛОЖНЫЕ
ПРОСТЫЕ СЛОЖНЫЕ
 |  | ||||||
 |  | ||||||
Металлы Неметаллы










 Оксиды Гидроксиды Бескислородные Соли
Оксиды Гидроксиды Бескислородные Соли
Na, Ag, FeS, Br2, O2, He, кислоты


 и др. и др.
и др. и др.
H2S, HCl, HCN и др.









 Несолеобразующие Солеобразующие Простые Сложные
Несолеобразующие Солеобразующие Простые Сложные

 (безразличные, индефферентные)
(безразличные, индефферентные)
Средние Основные Двойные Комплексные
CO, SiO, NO, N2O
Na2S, MgOHCl KAl(SO4)2 Na3[AlF6]
|
|
|
Основные Амфотерные Кислотные
Кислые Смешанные
Na2O, CaO, ZnO, BeO CO2, SO2, FeO CuO, Al2O3, MnO2 N2O5, Mn2O7 NaHCO3 Ca - Cl
и др. и др. и др. OCl
(CaOCl2)
 Основные Амфотерные Кислотные
Основные Амфотерные Кислотные
NaOH, Zn(OH)2, H2SO4, HNO3
Fe(OH)2,, Al(OH)3 и др.
и др. и др.
Кислоты
Бинарные соединения (состоящие из двух элементов) других классов:
- пероксиды (Na2O2, BaO2 и др.)
- соли пероксида водорода (H2O2),
- аммиак и др.,
- карбиды (CaC2, Al2C3),
- нитриды (Li3N),
- фосфиды (Сa3P2),
- надпероксиды (KO2)
Таблица некоторых оксидов, соответствующих им гидроксидов и солей
Кислотные оксиды
| Формула оксида | Формула кислоты | Название кислоты | Формула соли | Название соли |
| В2О3 | H3BO3 | Ортоборная | Na3BO3 | Ортоборат натрия |
| HBO2 | Метаборная | KBO2 | Метаборат калия | |
| Na2B4O7 | Тетраборат натрия | |||
| CO2 | H2CO3 | Угольная | CaCO3 | Карбонат кальция |
| SO2 | H2SO3 | Сернистая | Li2SO3 | Сульфит лития |
| SO3 | H2SO4 | Серная | BaSO4 | Сульфат бария |
| N2O3 | HNO2 | Азотистая | NaNO2 | Нитрит натрия |
| N2O5 | HNO3 | Азотная | NaNO3 | Нитрат натрия |
| P2O3 | H3PO3 | Фосфористая | K3PO3 | Фосфит калия |
| P2O5 | HPO3 | Метафосфорная | LiPO3 | Метафосфат лития |
| H4P2O7 | Пирофосфорная | Na4P2O7 | Пирофосфат натрия | |
| H3PO4 | Ортофосфорная | Mg3(PO4)2 | Ортофосфат магния | |
| As2O5 | H3AsO4 | Мышьяковая | Ca3(АsO4)2 | Ортоарсенат кальция |
| Cl2O | HClO | Хлорноватистая | NaClO | Гипохлорит натрия |
| Cl2O3 | HClO2 | Хлористая | K ClO2 | Хлорит калия |
| Cl2O5 | HClO3 | Хлорноватая | K ClO3 | Хлорат калия (бертолетова соль) |
| Cl2O7 | HClO4 | Хлорная | Sr(ClO4)2 | Перхлорат стронция |
| Mn2O7 | HMnО4↓ | Марганцевая | K Mn O4 | Перманганат калия |
| MnO3 | - | - | K2Mn O4 | Манганат калия |
| CrO3 | H2CrO4 | Хромовая | Na2CrO4 | Хромат натрия |
| H2Cr2O7 | Дихромовая | K2Cr2O7 | Дихромат калия | |
| FeO3 | H2FeO4 | - | K2FeO4 | Феррат калия |
| SiO2 | H2SiO3 | Кремниевая | CaSiO3 | Силикат кальция |
| - | HF | Фтороводородная (плавиковая) | AlF3 | Фторид алюминия |
| - | HCl | Хлороводородная (соляная) | CuCl2 | Хлорид меди (+2) |
| - | HBr | Бромоводородная | NaBr | Бромид натрия |
| - | HI | Йодоводородная | KI | Йодид калия |
| - | H2S | Сероводородная | Cr2S3 | Сульфид хрома (+3) |
| - | HCN | Циановодородная (синильная) | KCN | Цианид калия (цианистый калий) |
* -не все оксиды выделены и известны.
Названия некоторых лигандов
| формула | название | формула | название |
| CH3COO- | -ацетато | CN- | -циано |
| CO32- | -карбонато | H- | -гидридо |
| SO42- | -сульфато | SO32- | -сульфито |
| C2O42- | -оксалато | H2O | -аква |
| SCN- | -тиоцианато (роданидо) | NH3 NO2 | -аммин нитрито (нитро) |
| NO2- (-ONO) | -нитро (нитрито) | CO | -карбонил |
| OH- | -гидроксо | Вr | -бромо |
| S2- | -тио | Cl- | -хлоро |
| SO3S2- | -тиосульфато | F- | -фторо |
Расчетные формулы
|
|
|





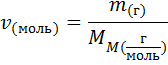



Закон эквивалентов:


Таблица изменения окраски индикаторов в различных средах
| Среда Индикатор | Кислая | Нейтральная | Щелочная |
| Универсальный | Красный | Желтый | Синий |
| Лакмус | Красный | Фиолетовый | Синий |
| Синий лакмус | Красный | Синий (не изменяет окраску) | Синий (не изменяет окраску) |
| Красный лакмус | Красный (не изменяет окраску) | Красный (не изменяет окраску) | Синий |
| Метиловый красный | Красный | Красный | Желтый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Тимолфталеин | Бесцветный | Бесцветный | Синий |
Шкала значений водородного показателя и концентрации катионов водорода
рН 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[H+]10-1 10-2 10-3 10-4 10-5 10-6 10-7 10- 8 10-9 10-10 10-11 10-12 10-13 10-14



 сильно-кислая слабо-щелочная
сильно-кислая слабо-щелочная
слабо-кислая сильно-щелочная

 увеличение кислотности увеличение щелочности
увеличение кислотности увеличение щелочности
нейтральная
Таблица сильных и слабых электролитов
| Класс соединений | Сильные | Слабые |
| Кислоты | H2SO4 cерная HCl хлористоводородная HNO3 азотная HBr бромоводородная HI йодоводородная HClO4 хлорная | H2S сероводородная H2SO3 сернистая H3PO4 фосфорная HNO2 азотистая H2CO3 угольная HCN циановодородная (синильная) CH3COOH уксусная HF фтороводородная |
| Основания | Щелочи - растворимые основания, исключая NH4OH, но включая Сa(OH)2 | Нерастворимые основания |
| Соли | Растворимые | Нерастворимые |
Правила уравнивания ОВР ионно-электронным методом
| В левой части уравнения | Среда | Добавляем в левую часть | Добавляем в правую часть |
| Избыток кислорода | кислая | Н+ | Н2О |
| щелочная или нейтральная | Н2О | 2ОН– | |
| Недостаток кислорода | кислая или нейтральная | Н2О | Н+ |
| щелочная | 2ОН– | Н2О |
Превращения перманганат-аниона

Превращения перманганата калия в кислой среде.
|
|
|
| Окислитель | Среда | Восстановитель | Продукт окисления | Продукт восстановления | Побочный продукт |
| KMnO4 | HCl | Cl2 | MnCl2 | H2O | |
| H2SO4 | H2O2 | O2 | MnSO4 | ||
| KI | I2 | ||||
| Na2SO3 | Na2SO4 | ||||
| FeSO4 | Fe2(SO4)3 | ||||
| H2C2O4 | CO2 |
Превращения ионов хрома
Окисление (-3ē)

Восстановление (-3ē)
Степень окисления: +3 +6
Кислая среда: Cr3+ Сr2O72-
катион хрома +3 (зеленый) дихромат-анион (оранжевый)
Щелочная среда: CrO2- CrO42-
Метахромит-анион (б/цв.) хромат-анион (желтый)
Превращения дихромата калия в кислой среде.
| Окислитель | Среда | Восстановитель | Продукт окисления | Продукт восстановления | Побочный продукт |
| K2Cr2O7 | HCl | Cl2 | CrCl3 | H2O | |
| H2SO4 | H2S | S 2 | Cr2(SO4)3 | ||
| KI | I2 | ||||
| Na2SO3 | Na2SO4 | ||||
| FeSO4 | Fe2(SO4)3 |
Взаимодействие концентрированной серной кислоты
с металлами
o C малоактивными и некоторыми металлами средней активности: Ag, Cu, Hg, Fe, Mn, Sn, Pb
→ SO2 (cульфат и вода).
o Со щелочными и щелочнозем. металлами: Na, K, Ca, Mg →H2S (cульфат и вода).
Конц. H2SO4
o С цинком Zn
→ SO2; S; H2S одновременно (сульфат и вода).
o На холоду не действует с конц. выше 93 % на чистые Fe, Al, Cr (на поверхности образуется пленка нерастворимых оксидов).
Взаимодействие концентрированной серной кислоты
с неметаллами
 S → SO2
S → SO2
 C → CO2
C → CO2

 SO2 ← H2SO4 +H2O
SO2 ← H2SO4 +H2O
HI → I2
HBr → Br2
Взаимодействие концентрированной азотной кислоты
с металлами
o C малоактивными металлами: Ag, Cu, Pb
→ NO2 (нитрат и вода).
o С активными металлами: Ca, Mg
→ N2O (нитрат и вода).
Конц. HNO3
o Fe, Al, Cr не окисляет за счет пленки оксидов (пассивирует на холоду)
o Не действует на Au, Pt
Взаимодействие концентрированной азотной кислоты
с неметаллами
o C углеродом: С
→ NO2 (CO2 и вода).
o С фосфором: Р
→ NO2 (H3PO4 и вода).
Конц. HNO3
o С серой: S
→ NO2 (H2SO4 и вода).
o С йодоводородом: HI
→ NO2 (HIO3 и вода).
Взаимодействие разбавленной азотной кислоты
с металлами
o C малоактивными металлами: Ag, Cu, Pb
→ NO (нитрат и вода).
Разб. HNO3
o С активными металлами: Ca, Mg
→ NH3 (нитрат и вода).
o С металлами средней активности Zn, Ni, Fe
→ NH4NO3 (нитрат и вода).
Взаимодействие разбавленной азотной кислоты
с неметаллами
o C углеродом: С
→ NO (CO2 и вода).
o С фосфором: Р
→ NO (H3PO4 и вода).
Разб. HNO3
o С серой: S
→ NO (H2SO4 и вода).
o С йодоводородом: HI
→ NO (HIO3 и вода)
|
|
|


