 |
Лекция 3. Потенциометрические анализаторы
|
|
|
|
Кондуктометрические концентратомеры
Классификация, область применения. Принцип действия, уравнение НСХ. Температурная погрешность. Уравнение Кольрауша. Двухэлектродный кондуктометр. Принципиальная схема. Бесконтактные кондуктомеры.
Кондуктометрические анализаторы применяются для измерения концентрации солей (солемеры) в процессах водоподготовки ТЭЦ, кислот, содержания воды в нефти при нефтедобыче и нефтепереработке, а также для измерения удельной электропроводности электролитов. По устройству датчиков кондуктометры можно разделить на контактные и бесконтактные. Контактные кондуктометры могут быть двух и четырех электродными.
Принцип действия кондуктометрических анализаторов основан на зависимости удельной электропроводности растворов от концентрации анионов и катионов (рис.1). Удельная электропроводность некоторых растворов приведена на рис. 2.
Математическая модель измерения:
 , (1)
, (1)
где α- степень диссоциации электролита, величина постоянная; n – валентность; U+, U- подвижность (скорость перемещения, зависит от температуры раствора) ионов; С – концентрация.
Удельная электропроводность – величина, обратная значению удельного сопротивления:
,  (2)
(2)
где  (сопротивление столбика раствора длиной l и площадью сечения S);
(сопротивление столбика раствора длиной l и площадью сечения S);
Принято обозначать отношение  как постоянной ячейки. С учетом этого удельная электропроводность в итоге равна:
как постоянной ячейки. С учетом этого удельная электропроводность в итоге равна:
 (3)
(3)
Исходя из уравнения (3) измерительной схемой кондуктометра может быть мост сопротивлений, так как Kя = const.
Устройство:
анализатор состоит из электродной ячейки (рис.3, 4) погружного или проточного типа и измерительно-преобразующего блока с дисплейным модулем. Электроды в ячейке – это металлические пластины круглой или прямоугольной формы, расположенные на строго определенном расстоянии друг от друга.
|
|
|
Постоянная ячейки (Kя)– это отношение расстояния между электродами к площади поверхности электрода: Кя = l/S.

Рис.1. Зависимость удельной электропроводности от концентрации

Рис. 2. Удельная электропроводность некоторых растворов
Уравнение Кольрауша позволяет определить удельную электропроводность растворов при любой температуре, если она известна при температуре +20 °С:
 , (4)
, (4)
где Κ 20 – удельная электропроводность раствора при нормальной температуре (+20 °С); α – температурный коэффициент электрической проводимости; t, t0 – рабочая и нормальная температура раствора.
Как видно из уравнения, электропроводность жидкости возрастает с увеличением температуры. 
Рис. 3. Принципиальная схема двухэлектродной ячейки контактного кондуктометра:
а) пластинчатые электроды; б) электродная ячейка с термокомпенсатором(термометром сопротивления).
Двухэлектродные кондуктометры просты по устройству, но имеют низкую точность из-за поляризации электродов. Более точными являются четырехэлектродные контактные или бесконтактные кондуктометры (рис. 4, 5, 6).

Рис. 4. Контактный кондуктометр с четырехэлектродной ячейкой:
1, 4 – токовые электроды питания; 2, 3 – измерительные потенциометрические электроды (металлические пластинки); Rt – термометр сопротивления; R1, R2, R3, Rt –схема уравновешенного моста, предназначенная для автоматической компенсации температурной погрешности; ЭУ – электронный усилитель; РД – реверсивный двигатель.

Рис.5. Схема подключения четырехэлектродного датчика
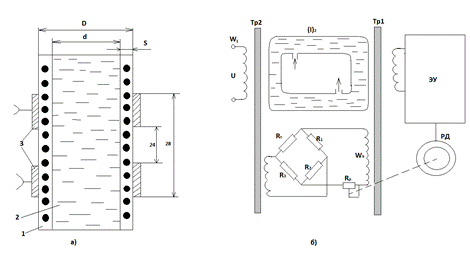
Рис. 6. Принципиальные схемы бесконтактных кондуктометров
а)– с емкостной измерительной ячейкой ЕИЯ с контурной резонансной измерительной схемой; б)– с жидкостным витком и термокомпенсатором; 1– труба; 2 –анализируемый раствор; 3– кольцевые электроды; w 1 – первичная обмотка Тр2; w2 = 1; wk– компенсационная обмотка измерительного трансформатора Тр1.
|
|
|
Устройство: бесконтактные кондуктометры имеют в составе датчика жидкостный виток, являющийся вторичной обмоткой трансформатора питания Тр2 и первичной обмоткой измерительного трансформатора Тр1. (рис.6, б). Термометр сопротивления Rt включен в одно из плеч компенсационного моста R1, R2,R3.
Лекция 3. Потенциометрические анализаторы
Принцип действия, уравнение Нернста. Понятие рН. Уравнение водородной функции. Понятие изопотенциальной точки. Типы электродов. Принципиальная схема рН–метра. Поверка рН–метра.
Потенциометрические анализаторы являются концентратомерами жидких сред и называются иономерами или (частный случай) рН-метрами. Принцип действия их основан на зависимости потенциала измерительного электрода от концентрации потенциалопределяющих ионов в растворе. Скачок потенциала на границе между электродом и раствором определяется динамическим равновесием, при котором переход электронов от восстановителя к электроду и от электрода к окислителю происходит с одинаковой скоростью:
Ме0 ↔Ме+ + ne-, (5)
Зависимость потенциала измерительного электрода от концентрации потенциалопределяющих ионов математически описывается уравнением Вальтера Нернста:
 В (6)
В (6)
где Ех – поверхностный равновесный потенциал измерительного электрода; Е0 – стандартный (нормальный) окислительно-восстановительный потенциал данного металла в растворе, активность которого равна единице; R =8, 31 (универсальная газовая постоянная); T– температура раствора, К; n– валентность металла; F – число Фарадея; См+ – активная концентрация ионов металла в растворе, моль/дм3.
Ряд напряжений металлов (табл. 3): Zn, Pb, Sn, Fe, Cu, Ag, Au опытным путём установил Алессандро Вольта. Сила гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга члены ряда. Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик В. Нернст (1864 – 1941).

Рис. 7. Схема установки для измерения потенциалов:
1 – водородный электрод; 2 – сифон; 3 – металлический электрод, у которого измеряется потенциал; 4 – сифон.
|
|
|
Таблица 3
Стандартные потенциалы восстановления Ме относительно водородного электрода (ряд напряжений)
| Восстановленная форма | Число отданных электронов | Окисленная форма | Стандартный электродный потенциал E 0, В |
| Li | 1e | Li+ | -3,05 |
| K | 1e | K+ | -2,925 |
| Rb | 1e | Rb+ | -2,925 |
| Cs | 1e | Cs+ | -2,923 |
| Ba | 2e | Ba2+ | -2,91 |
| Sr | 2e | Sr2+ | -2,89 |
| Ca | 2e | Ca2+ | -2,87 |
| Na | 1e | Na+ | -2,71 |
| Mg | 2e | Mg2+ | -2,36 |
| Al | 3e | Al3+ | -1,66 |
| Mn | 2e | Mn2+ | -1,18 |
| Zn | 2e | Zn2+ | -0,76 |
| Cr | 3e | Cr3+ | -0,74 |
| Fe | 2e | Fe2+ | -0,44 |
| Cd | 2e | Cd2+ | -0,40 |
| Co | 2e | Co2+ | -0,28 |
| Ni | 2e | Ni2+ | -0,25 |
| Sn | 2e | Sn2+ | -0,14 |
| Pb | 2e | Pb2+ | -0,13 |
| Fe | 3e | Fe3+ | -0,04 |
| H2 | 2e | 2H+ | 0,00 |
| Cu | 2e | Cu2+ | 0,34 |
| Cu | 1e | Cu+ | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag+ | 0,80 |
| Hg | 2e | Hg2+ | 0,85 |
| Pt | 2e | Pt2+ | 1,20 |
| Au | 3e | Au3+ | 1,68 |
Следствия из уравнения Нернста: уравнение нелинейно; потенциал измерительного электрода зависит как от активной концентрации ионов в растворе, так и от температуры раствора.
Для измерения Ех необходимо замкнуть электрическую цепь, для чего в раствор вводится дополнительный контактный электрод, называемый вспомогательным или электродом сравнения. Потенциал электрода сравнения должен быть постоянным и не зависеть от концентрации металла ионов в растворе.
Потенциометрические анализаторы широко применяются для измерения рН растворов и пульп, экологическом контроле, а также концентрации ионов металлов в гидрометаллургии, для измерения окислительно-восстановительного потенциала (ОВП) при обогащении полезных ископаемых, в научных исследованиях, медицине, пищевой промышленности и др. Наибольшее распространение аотенциометрические анализаторы получили при автоматическом контроле рН.
Понятие рН введено для линеаризации уравнения Нернста датским химиком Зеренсеном. Символ рН (р – potencio, степень; Н – символ водорода) численно равен отрицательному десятичному логарифму концентрации Н-ионов в растворе, выраженной в молях на кубический дециметр:
 (7)
(7)
Введя такую подстановку, можно от логарифмического уравнения Нернста перейти к линейному, алгебраическому, выполнив замену натурального логарифма десятичным и подставив перед скобкой и в скобке знак минус:
|
|
|

Для нормальных условий (температура раствора t= 20 °C) и с учетом определения рН уравнение имеет вид:
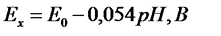 (9)
(9)
Для иона водорода принято Е0 = 0,00 В, и тогда окончательно:

В итоге всех преобразований для анализатора рН получена линейная зависимость потенциала измерительного электрода от величины рН раствора.
Для электродной ячейки и любой температуры раствора в диапазоне от плюс 25 до плюс 100 °С эта зависимость, называемая уравнением водородной функции, имеет вид:
Ея = Еи – ( Sя+ at) ·(рН - рНи),мВ (10)
Ея = Еи – ( 54,197 + 0,1984 t) · (рН - рНи), мВ (11)
где t – температура раствора, °С; рНи, Еи – номинальные значения координаты изопотенциальной точки электродной системы, состоящей из измерительного и вспомогательного электродов, соответственно рН, мВ, a – температурный коэффициент раствора, Sя – крутизна водородной характеристики (Sя = ΔЕ/ΔрН мВ/рН).
Разность потенциалов линейно зависит от активности ионов в растворе и от температуры контролируемого раствора.
Изменение температуры раствора влияет на крутизну водородной характеристики электродной системы.
Изопотенциальной называется точка на графике водородной функции (рис. 8) с координатами рНи, Еи, потенциал которой не зависит от температуры раствора. Координаты рНи, Еи указываются в паспорте электродов.
На электродах должны быть указаны (маркировка):
условное обозначение электрода;
товарный знак предприятия-изготовителя;
заводской порядковый номер по системе нумерации предприятия-изготовителя;
координата изопотенциальной точки рНи;
температура анализируемой среды;
- знак утверждения типа по ПР 50.2.009–94;
- дата выпуска (порядковый номер месяца и год);
В состав анализатора входит электродная ячейка, состоящая из стеклянного измерительного электрода, хлорсеребряного электрода сравнения, термометра сопротивления с мостовым термокомпенсатором и высокоомного измерителя напряжения с аналоговым или цифровым выходом.
Электродная ячейка состоит из стеклянного измерительного электрода и вспомогательного хлор-серебряного электрода сравнения (рис. 9, 10). Она может быть погружного или проточного типа.
Рис. 8. График водородной функции (НСХ электродной ячейки)
И – изопотенциальная точка; рНи, Еи – координаты изопотенциальной точки.

Рис.9. Измерительный стеклянный электрод:
1 – выводной кабель; 2 – колпачок; 3 – втулка; 4 – кольцо; 5 – хлорсеребряный контактный полуэлемент; 6 – корпус (стеклянная трубка из кремниевого стекла); 7 – индикаторный шарик (из литиевого стекла); 8 – кабельный наконечник.
|
|
|

а) б)
Рис. 10. Устройство вспомогательного хлорсеребряного электрода сравнения:
а – электрод марки ЭПв-5/1; б – электрод марки ЭПв-5/2.
1 – выводной провод; 2 – защитный колпачок; 3 – хлорсеребряный полуэлемент; 4 – корпус электрода (стеклянная трубка); 5 - внутренняя трубка с нитью; 6 - кремнеземная нить; 7 – резиновая пробка; 8 – внутренняя трубка с хлорсеребряным полуэлементом; 9 – электролитический ключ

Рис.11. Принципиальная схема рН-метра с автоматической компенсацией температурной погрешности и аналоговым выходным сигналом:
ИЭ- измерительный стеклянный электрод; ЭС – хлорсеребряный электрод сравнения; ЭЯ – электродная ячейка с анализируемым раствором; ЭУ – усилитель с высоким входным сопротивлением (высокоомный); мА – токовый индикатор.
Если в процессе эксплуатации возникает необходимость прервать работу электродов, то их следует извлечь из арматуры, промыть в дистиллированной воде и поместить в раствор соляной кислоты концентрацией 0,1 моль/дм3 или буферный раствор с рН, близким к значению изопотенциальной точки электрода. Поверка электродов должна проводиться не реже одного раза в год согласно методикам Р 50.2.035–2004. К проведению поверки допускаются лица, имеющие опыт работы в аналитической химии, ежегодно проходящие проверку знаний по технике безопасности, владеющие техникой потенциометрических измерений и аттестованные в качестве поверителя. По способу защиты человека от поражения электрическим током электроды соответствует классу III по ГОСТ 12.2.007.0–75.
Анализатор рН типа МАРК-902 (НПП «Взор» г. Нижний Новгород) представляет собой двухканальный измерительный прибор, предназначенный для непрерывного измерения: активности ионов водорода в диапазоне от 1 до 12 рН; температуры водных растворов в диапазоне от +5 до +50 °С; ЭДС в диапазоне от минус 1000 до плюс 1000 мВ. Измеренные значения рН и температуры анализируемой среды выводятся на экран графического ЖК индикатора с ценой младшего разряда при измерении рН – 0,01 рН, при измерении ЭДС – 1 мВ, при измерении температуры – 0,1 °С.
По каждому каналу измерения рН в рН-метре имеется токовый выход с выходными унифицированными сигналами постоянного тока от 0 до 5 мА либо от 4 до 20 мА.

Рис.12. Внешний вид промышленного рН– метра НПП «Взор»
В основу работы рН-метра положен потенциометрический метод измерения рН контролируемого раствора. Электродная система при погружении в контролируемый раствор развивает ЭДС, линейно зависящую от значения рН. Сигнал (ЭДС) с электродной системы и сигнал с датчика температуры подаются на преобразователь, состоящий из блока усилителя и блока преобразовательного. В блоке усилителя сигналы усиливаются и преобразуются в цифровую форму и через кабель поступают на вход блока преобразовательного. Измеренное значение ЭДС электродной системы в рН-метре пересчитывается в значение рН с учетом температуры анализируемого раствора, т. е. выполняется автоматическая термокомпенсация, которая компенсирует только изменение ЭДС электродной системы.
pH-метр обеспечивает работу с электродными системами, ЭДС которых соответствует следующему уравнению:
 ,
,
где  – потенциал электродной ячейки;
– потенциал электродной ячейки; 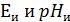 –координаты изопотенциальной точки (указаны в паспорте электродов);
–координаты изопотенциальной точки (указаны в паспорте электродов);  - крутизна водородной функции, мВ/pH (Значение St определяется выражением: St = − 0,1984 (273,15 +t) Кs, где t – температура анализируемой среды, °С; Кs − коэффициент, принимающий значение от 0,8 до 1,01, позволяющий учитывать отклонение крутизны электродной системы от теоретического значения, для которого Кs = 1);
- крутизна водородной функции, мВ/pH (Значение St определяется выражением: St = − 0,1984 (273,15 +t) Кs, где t – температура анализируемой среды, °С; Кs − коэффициент, принимающий значение от 0,8 до 1,01, позволяющий учитывать отклонение крутизны электродной системы от теоретического значения, для которого Кs = 1);  – искомое значение.
– искомое значение.
Состав рН-метра:
- Преобразовательный блок (микропроцессорный, осуществляющий отображение результатов измерения на экране индикатора, формирование сигнала на токовом выходе, управление реле уставок и обмен с ПК, питание блока преобразовательного производится от сети переменного тока 220 В, 50 Гц).
- Блок датчиков (включает в себя блок усилителя, электродную систему, датчик температуры).
- Блок усилителя (выполнен в герметичном алюминиевом корпусе. К разъемам «ВХОД 1» и «ВХОД 2» подключается электродная система − измерительный (рН-электрод) и электрод сравнения соответственно. К разъему «ВХОД 3» подключается датчик температуры, в качестве которого используется терморезистор, помещенный в металлический корпус. К разъему «ВЫХОД» подключается экранированный кабель, соединяющий блок датчиков с блоком преобразовательным).
- Измерительный электрод (выполнен из толстостенной стеклянной калиброванной трубки, к концу которой припаяна чувствительная мембранаиз литиевого стекла). Стеклянный электрод заполнен раствором кислоты постоянной концентрации, который замыкает электрическую цепь между мембраной и контактным электродом, соединенным с выводным проводником.
Типы применяемых электродов в зависимости от исполнения pH-метра приведены в табл. 4.
Таблица 4
| Исполнение рН-метра | Тип применяемых электродов | № в Госреестре | Изготовитель |
| МАРК-902 МАРК-902/1 | Электрод стеклянный ЭС-10601/7(К80.7) Электрод сравнения ЭСр-10106-3,0(К80.4) | 41622-09 | ООО НПО «Измерительная техника ИТ», г. Москва, Россия |
| МАРК-902А МАРК-902А/1 МАРК-902МП | Электрод стеклянный комбинированный ЭСК-10617/7 | 41623-09 | |
| МАРК-902МП/1 | Комбинированный pH-электрод с гелевым заполнением, тип 201020/51-18-04-22-120/837 | 16767-08 | JUMO GmbH & CO, Fulda, Germany |
Пределы допускаемой основной абсолютной погрешности рН-метра
при измерении рН при температуре анализируемой среды (25,0 ± 0,2) °С и температуре окружающего воздуха (20 ± 5) °С: ± 0,05 pH.
Пределы допускаемой дополнительной абсолютной погрешности
рН, вызванной изменением давления анализируемой среды в диапазоне от 0 до 0,025 МПа равен ± 0,1рН.
Диапазон измерения преобразователя от 0 до 15 рН. Пределы допускаемой основной приведенной погрешности преобразования измеренного значения рН в выходной ток при температуре окружающего воздуха (20 ± 5) °С на обоих диапазонах токового выхода равен ± 0,5 % от диапазона токового выхода.
Таблица 5
Значения потенциала электродных систем ЭПс-2-4 и ЭПв-5 с координатами изопотенциальной точки рНи = 4,2; Еи = - 2,5 мВ
| рН | Потенциал электродной системы (Е, мВ) при температуре раствора (t, °С) | ||||||
| 0,00 | 370,2 | 384,5 | 405,9 | 412,8 | 427,4 | ||
| 0,50 | 343,1 | 356,4 | 376,4 | 382,7 | 396,3 | ||
| 1,00 | 316,0 | 328,3 | 346,8 | 352,7 | 365,2 | ||
| 1,50 | 288,9 | 300,2 | 317,2 | 322,6 | 334,2 | ||
| 1,68 | 279,2 | 290,1 | 306,5 | 311,8 | 323,0 | ||
| 2,00 | 261,8 | 272,1 | 287,6 | 292,6 | 303,1 | ||
| 2,50 | 234,7 | 244,1 | 258,0 | 262,5 | 272,0 | ||
| 3,00 | 207,6 | 216,0 | 228,5 | 232,5 | 241,0 | ||
| 3,50 | 180,5 | 187,9 | 198,9 | 202,4 | 209,9 | ||
| 4,00 | 153,4 | 159,8 | 169,3 | 172,3 | 178,8 | ||
| 4,50 | 126,3 | 131,7 | 139,7 | 142,3 | 147,8 | ||
| 5,00 | 99,2 | 103,6 | 110,1 | 112,2 | 116,7 | ||
| 5,50 | 72,1 | 75,5 | 80,6 | 82,2 | 85,6 | ||
| 6,00 | 45,0 | 47,4 | 51,0 | 52,1 | 54,6 | ||
| 6,50 | 17,9 | 19,3 | 21,4 | 22,1 | 23,5 | ||
| 7,00 | -9,2 | -8,8 | -8,2 | -8,0 | -7,6 | ||
| 7,20 | -20,0 | -20,0 | -20,0 | -20,0 | -20,0 | ||
| 7,50 | -36,3 | -36,9 | -37,7 | -38,0 | -38,6 | ||
| 8,00 | -63,4 | -64,9 | -67,3 | -68,1 | -69,7 | ||
| 8,50 | -90,5 | -93,0 | -96,9 | -98,1 | -100,8 | ||
| 9,00 | -117,6 | -121,1 | -126,5 | -128,2 | -131,8 | ||
| 9,50 | -144,7 | -149,2 | -156,1 | -158,3 | -162,9 | ||
| 10,00 | -171,8 | -177,3 | -185,6 | -188,3 | -194,0 | ||
| 10,50 | -198,9 | -205,4 | -215,2 | -218,4 | -225,0 | ||
| 11,00 | -225,9 | -233,5 | -244,8 | -248,4 | -256,1 | ||
| 11,50 | -253,0 | -261,6 | -274,4 | -278,5 | -287,2 | ||
| 12,00 | -280,1 | -289,7 | -304,0 | -308,5 | -318,2 | ||
Таблица 6
|
|
|


