 |
Термохимические уравнения и расчеты
|
|
|
|
Лекция № 1
Энергетика ХИМИЧЕСКИХ РЕАКЦИЙ
План лекции:
1. Введение
2. Основы термодинамики
3. Термохимические уравнения и расчеты
4. Направление протекания химических реакций
Цели изучения: усвоить содержание основных понятий и сущность законов термодинамики, научиться на их основе выполнять различные термодинамические и термохимические расчеты.
Введение
Врач в своей работе постоянно имеет дело с физическими и химическими процессами, протекающими в организме как здорового, так и больного человека. Организм человека - это открытая термодинамическая система, обменивающаяся с окружающей средой веществом и энергией.
Знание термодинамических закономерностей процессов обмена веществ и энергии в организме человека необходимо:
1) при оценке эффективности биологических процессов, протекающих в организме;
2) для расчета калорийности потребляемой пищи;
3) для диагностики ряда заболеваний (онкологических, деструктивных, эмбриональных и др.), для которых термодинамические параметры изменяются в зависимости от течения процесса (нормальный или патологический).
Область науки, занимающаяся изучением трансформации энергии в живых организмах, называется биоэнергетикой.
По мере того, как выясняется молекулярный механизм многих биологических и биохимических процессов, ученые стараются применить термодинамические представления в исследованиях живых систем.
Основы термодинамики
Термодинамика - это наука, которая изучает взаимные превращения теплоты и работы. Химическая термодинамика применяет термодинамические методы для решения химических задач, т.е. для теоретического описания различных видов химических и фазовых равновесий и свойств веществ в растворах.
|
|
|
Основная физическая величина, используемая в термодинамике, - это энергия (U). Весь математический аппарат термодинамики построен на законе сохранения энергии:
Энергия никуда не исчезает и ниоткуда не возникает, а переходит из одного вида в другой.
Основными видами энергии являются: кинетическая, потенциальная и внутренняя энергия.
Непосредственно измерить энергию в настоящее время не представляется возможным. В термодинамике определяют изменение энергии в виде теплоты (Q) и работы (A).
Объектом изучения термодинамики является термодинамическая система.
Термодинамическая система - это часть макроскопического пространства, ограниченная реальной или воображаемой поверхностью от окружающей среды.
При помощи этой поверхности система однозначно выделяется из окружающей среды и может быть изучена термодинамическими методами только в том случае, если имеется возможность проследить за всеми процессами обмена между системой и окружающей средой.
По типу взаимодействия системы с окружающей средой различают:
открытые системы - возможен теплообмен и обмен массой;
закрытые системы - возможен теплообмен, но нет обмена массой;
изолированные системы - невозможен теплообмен и обмен массой.
Строго говоря, изолированных систем в природе не существует. Примером открытой системы может служить любой живой организм.
Свойства термодинамической системы, а также явления, связанные с взаимными превращениями теплоты и работы, описывают при помощи термодинамических параметров.
Измеряемые термодинамические параметры - это давление (p), объем (V), температура (T), количество вещества (n) и другие.
Неизмеряемые (вычисляемые) термодинамические параметры - это энергия (U), энтальпия (H), энтропия (S) и другие.
Термодинамический процесс связан с изменением хотя бы одного термодинамического параметра. Постоянство определенного параметра в ходе процесса отмечают приставкой изо-:
|
|
|
изохорный процесс - при постоянном объеме;
изобарный процесс - при постоянном давлении;
изотермический процесс - при постоянной температуре.
Процесс называют обратимым, если переход системы из состояния 1 в состояние 2 и обратно возможен по одному и тому же пути и после возвращения в исходное состояние в окружающей среде не остается никаких макроскопических изменений.
В необратимых процессах после возвращения в исходное состояние часть работы переходит в теплоту. К необратимым процессам относятся самопроизвольные, т.е., протекающие без постоянного воздействия на систему извне.
Состояние системы называют равновесным, если все параметры остаются постоянными во времени (строго при t ¥) и в системе отсутствуют потоки вещества и энергии. Если параметры системы постоянны во времени, но имеются потоки вещества и энергии, состояние называют стационарным.
Классическая термодинамика изучает только свойства равновесных систем. Стационарные системы описываются методами термодинамики неравновесных процессов. В этой связи, в классической термодинамике используется ряд допущений. Прежде всего, это постулат о термодинамическом равновесии системы, согласно которому:
Любая система с течением времени придет к равновесному состоянию.
Второй постулат классической термодинамики - это постулат о существовании температуры:
Если системы А, B и C находятся между собой в состоянии термодинамического (теплового) равновесия, то TA = TB = TC.
Иными словами, в термодинамике температура определяется как обобщенная сила, отвечающая теплообмену.
Эти постулаты представляются достаточно очевидными утверждениями, но они необходимы для построения строгого математического аппарата термодинамики.
Состояние системы принято описывать при помощи переменных, значения которых принимают вполне определенные значения для любого состояния системы, но при этом не зависят от способа достижения данного состояния. Такие переменные называют функциями состояния.
Функциями состояния являются: объем (V), давление (p), внутренняя энергия (U), энтальпия (H), энтропия (S), свободная энергия Гиббса или изобарно-изотермический потенциал (G) и другие.
|
|
|
Работа (A) и теплота (Q) функциями состояния не являются, так как зависят от пути, по которому система переходит из одного состояния в другое.
Внутренняя энергия (U) системы - это суммарная энергия частиц системы без учета движения системы как целого. Суммарная энергия частиц складывается из кинетической энергии поступательного, колебательного и вращательного движения частиц, а также из потенциальной энергии сил притяжения и отталкивания, действующих между частицами.
Изменение внутренней энергии определяется из соотношения:
DU = U2 (конечное состояние) - U1 (начальное состояние)
Как уже отмечалось, для макроскопических систем энергия не является непосредственно измеряемой величиной. Термодинамика позволяет вычислить изменение энергии из опытных данных. Для этого необходимо учесть теплообмен между системой и окружающей средой (количество теплоты) и измерить работу, совершаемую системой над окружающей средой. Соотношение между этими величинами установлено в I законе термодинамики:
Изменение внутренней энергии системы DU равно сумме количества теплоты Q, переданного системе, и работы А, совершенной окружающей средой над системой:
| DU = Q + A, | (1) |
Другая формулировка:
Изменение внутренней энергии системы DU равно разности количества теплоты Q, переданного системе, и работы А, совершаемой системой против внешних сил:
| DU = Q - A. | (2) |
На основании закона сохранения энергии и I закона термодинамикиможно заключить, что при различных способах перехода макроскопической системы из одного состояния в другое, алгебраическая сумма Q + A остается неизменной. Этот вывод подтверждается многочисленными опытными данными.
Таким образом, величины DU, Q и A имеют одинаковую размерность - размерность энергии. В настоящее время в системе СИ единицей энергии является Джоуль [Дж]. В некоторых случаях используется внесистемная единица - калория (кал). Эти величины связаны друг с другом соотношением: 1 Дж = 0,239 кал.
|
|
|
Соотношение между внутренней энергией и работой во многом зависит от условий протекания процесса. Так, в изохорном процессе: DV = 0, A = pDV = 0.
Следовательно:
| Q v = DU. | (3) |
Таким образом, в изохорном процессе количество теплоты, полученное системой, целиком идет на увеличение внутренней энергии.
В изобарном процессе работа определяется как A = pDV и можно записать:
| Qp = DU + pDV = U2 - U1 + p(V2 - V1) = = (U2 + pV2) - (U1 + pV1) = H2 - H1 = DH. | (4) |
Величина
| U + pV º H | (5) |
называется энтальпией системы.
Энтальпия (H) - термодинамическая функция состояния системы, применяемая для изобарных процессов, учитывающая внутреннюю энергию и энергию, затрачиваемую на преодоление внешнего давления. Иными словами, энтальпия характеризует теплосодержание системы.
Непосредственно энтальпию измерить нельзя, можно измерить только изменение энтальпии в результате протекания процесса DН:
DH = H2 (конечное состояние) - H1 (начальное состояние).
В экзотермическом процессе теплота освобождается в окружающую среду (Q > 0), при этом изменение энтальпии DН считается отрицательным.
В эндотермическом процессе теплота поглощается (Q < 0), а значение DН - положительно.
Термохимические уравнения и расчеты
Химическая термодинамика в своих расчетах широко применяет математический аппарат классической термодинамики. Этот подход оказался весьма эффективным. Так, появилась возможность рассчитывать тепловые эффекты реакций, не проводя экспериментов. Применение термодинамического аппарата позволило заранее прогнозировать направление протекания химических реакций и рассчитывать выход продуктов только на основе термодинамических данных отдельных реагентов. Кроме того, удалось показать, что способность веществ вступать в химические реакции зависит не только от их природы, но и от условий проведения процесса - температуры и давления. Это позволило достаточно точно рассчитать значения внешних параметров и провести реакции, которые ранее считались неосуществимыми.
Теплотой реакции (Q) называется количество теплоты, поглощаемой из окружающей среды или выделяемой в окружающую среду при превращении исходных реагентов в продукты реакции при определенных температуре и давлении.
Реакции, которые протекают с выделением теплоты, называются экзотермическими. Для таких реакций Q > 0, DН < 0.
Реакции, которые протекают с поглощением теплоты, называются эндотермическими. В данном случаеQ < 0, DН > 0.
Так как значения тепловых эффектов в той или иной степени зависят от внешних условий (температуры, давления и др.), то для того, чтобы иметь возможность сравнивать тепловые эффекты различных реакций термохимические измерения проводят при одинаковых условиях, а именно:
|
|
|
1) в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификациях;
2) концентрации реагентов составляют 1 моль вещества на 1 кг растворителя;
3) температура равна 250С (298,15 К);
4) давление соответствует 1 атм (760 мм рт. ст.; 101325 Па).
Такие условия называют стандартными.
За стандартное состояние (обозначают верхним индексом 0) принято устойчивое состояние вещества (устойчивая модификация - для веществ в конденсированном состоянии; состояние идеального газа - для газов), в котором оно существует при давлении 101,3 кПа и данной температуре (обычно 298 К).
Величину теплового эффекта реакции, измеренную при стандартных условиях и взятую с обратным знаком, называют стандартной энтальпией реакции и обозначают DН0.
Стандартной энтальпией образования вещества (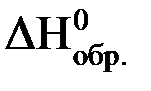 ) называют изменение энтальпии реакции образования 1 моль данного вещества из соответствующих простых веществ, взятых в стандартном состоянии при стандартных условиях. Например:
) называют изменение энтальпии реакции образования 1 моль данного вещества из соответствующих простых веществ, взятых в стандартном состоянии при стандартных условиях. Например:
C(тв.) + О2(газ) = СО2(газ); 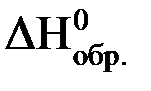 CO2 = -393,5 кДж/моль.
CO2 = -393,5 кДж/моль.
Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением. Термохимические уравнения составляют таким образом, чтобы в качестве продукта всегда образовывался 1 моль вещества, поэтому в таких уравнениях стехиометрические коэффициенты могут быть дробными. Например:
обычное химическое уравнение:
2H2 + O2 = 2H2O;
термохимическое уравнение:
H2(газ) + 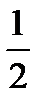 O2(газ) = H2O(газ);
O2(газ) = H2O(газ); 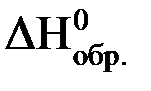 H2O = -242 кДж/моль.
H2O = -242 кДж/моль.
Величины стандартных энтальпий образования наиболее устойчивых простых веществ считают равными нулю. Например:
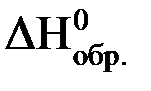 O2 = 0;
O2 = 0;
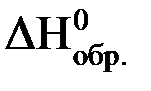 O3 ¹ 0.
O3 ¹ 0.
Величины стандартных энтальпий образования веществ - это справочный материал. Следует отметить, что различному агрегатному состоянию одного и того же вещества могут соответствовать различные значения стандартных энтальпий образования.
Например:
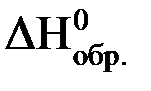 H2O(жидк.) = -286 кДж/моль;
H2O(жидк.) = -286 кДж/моль;
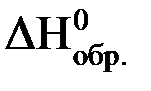 H2O(газ) = -242 кДж/моль.
H2O(газ) = -242 кДж/моль.
Стандартной энтальпией сгорания вещества(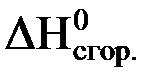 ) называется стандартная энтальпия реакции окисления 1 моль данного вещества до конечных продуктов окисления при стандартных условиях. Например:
) называется стандартная энтальпия реакции окисления 1 моль данного вещества до конечных продуктов окисления при стандартных условиях. Например:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.);
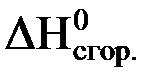 С6H12O6 = -2810 кДж/моль.
С6H12O6 = -2810 кДж/моль.
Для высших оксидов элементов значения стандартных энтальпий сгорания принимают равными нулю.
Например:
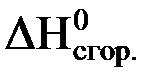 СO2.
СO2.
В 1840 г. русским ученым Г.И. Гессом на основании экспериментальных данных был открыт закон о постоянстве сумм теплот для различных путей превращения исходных веществ в продукты реакции. В современной термохимии закон Гесса рассматривается как следствие I закона термодинамики, но при этом имеет отдельное название, так как был открыт раньше установления эквивалентности теплоты и работы.
В настоящее время закон Гесса формулируется так:
Изменение энтальпии реакции образования заданных продуктов из данных реагентов не зависит от числа и вида реакций, в результате которых образуются эти продукты.
Для расчета энтальпий некоторых процессов вместо закона Гесса удобнее применять следствия из него.
I следствие:
Энтальпия реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Для реакции:
aA + bB = cC + dD
математическое выражение I следствия из закона Гесса в общем виде выглядит следующим образом:
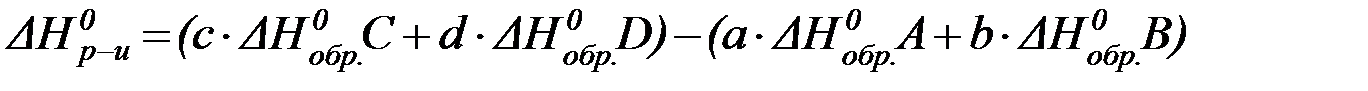
| (6) |
II следствие:
Энтальпия реакции равна сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов.
В данном случае математическое выражение запишется так:
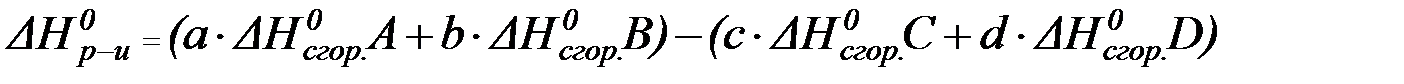
| (7) |
Отметим, что из закона Гесса также следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
Используя закон Гесса, можно рассчитать калорийность пищи, потребляемой ежедневно человеком, и дать необходимые рекомендации по составлению диеты в случае нарушения обмена веществ.
Глюкоза, попадая в организм, претерпевает серию сложных превращений. В результате окисления глюкозы, как и большинства питательных веществ, образуются углекислый газ и вода:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.); 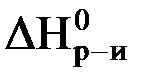 = -2810 кДж.
= -2810 кДж.
Следовательно, если человек съест 180 г глюкозы (1 моль), то в организме человека в результате окисления 1 моль глюкозы теоретически должно выделиться 2810 кДж (672 ккал) энергии.
Установлено, что при окислении основных питательных веществ выделяются следующие количества теплоты: 1 г жиров - 39,5 кДж, 1 г углеводов - 17,1 кДж, 1 г белков - 22,3 кДж.
Энергетическую потребность человека можно определить, поместив его в калориметр (прибор, исключающий теплообмен с окружающей средой) и измерив количество израсходованной им энергии.
Отдача теплоты человеком в состоянии покоя: 6300-7500 кДж в сутки. Любое движение организма, любая работа, даже пищеварение, усиливают выделение тепла. Было установлено, что при легкой физической работе человеку необходимо 8400-12000 кДж в сутки, а при тяжелой - 16700-20900 кДж в сутки.
Человеку для поддержания термодинамического равновесия требуется количество энергии, равное отдаче тепла. Зная состав отдельных питательных веществ и их энтальпии сгорания, можно рассчитать количество необходимых для питания человека продуктов. При избыточном или нерациональном потреблении питательных веществ часть продуктов не усваивается и откладывается организмом в депо в виде жировой подкожной клетчатки, вызывая ожирение.
Процессы растворения также могут сопровождаться тепловыми эффектами. Такие процессы, как правило, экзотермичны.
Энтальпией растворения называется изменение энтальпии при растворении 1 моль вещества.
Изменение энтальпии при образовании раствора свидетельствует об изменении природы компонентов раствора.
Заметное изменение энтальпии наблюдается в реакциях нейтрализации водных растворов сильных кислот сильными основаниями. При этом в расчете на 1 моль эквивалента кислоты или основания при стандартных условиях выделяется одинаковое количество теплоты (+57,1 кДж). Такое постоянство непосредственно вытекает из закона Гесса. Действительно, независимо от того, какие были взяты кислоты и основания, нейтрализация всегда сводится к реакции образования воды:
| H+(р-р) + ОH-(р-р) = H2O(жидк.); | 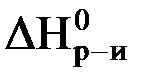 = -57,1 кДж. = -57,1 кДж.
|
Изменение энтальпии при взаимодействии 1 моль ионов H+ c 1 моль ионов OH- при стандартных условиях называется стандартной энтальпией нейтрализации и составляет -57,1 кДж/моль.
|
|
|
12 |


