 |
Упражнения для самопроверки
|
|
|
|
1.Напишите графические формулы следующих оксидов: Cr2O3, SiO2, V2O5, CrO3:, Mn2O7, MnO3 и OsO4.
2.Охарактеризуйте химические свойства: а) основного оксида; б) кислотного оксида; в) амфотерного оксида; г) смешанного ангидрида.
3.Какие из приведенных оксидов СО2, CaO, Fe2O3, SiO2, А12О3 способны к солеобразованию с кислотными? Напишите уравнения их взаимодействия с оксидом серы (VI)..
4.Какие из приведенных оксидов N2O3, NO2, MgO, SO2, P2O5, Bi2O3, CO2 способны к солеобразованию с основными оксидами? Напишите уравнения их взаимодействия с оксидом кальция.
3. Напишите уравнения реакций, характеризующих амфотерные свойства Sb2O3, SnO, Cr2O3 и ВеО.
гИДРОКСИДЫ
Гидроксиды - соединения, состоящие из катиона и одной или нескольких гидроксо-групп.
Гидроксиды принято изображать общей формулой R(OH)n.
Где: R+n центральный атом в положительной степени окисления.
В молекулах гидроксидов атом водорода связан с центральным атомом через кислород: графическая формула Н-О-Са-О-Н, эмпирическая формула Са(ОН)2; графическая формула H-O-N=O, эмпирическая формула HNO2.
Классификация гидроксидов
Гидроксиды образуют все элементы Периодической системы элементов, кроме благородных газов (VIII группа).
В зависимости от природы центрального атома гидроксиды подразделяются на следующие типы:
1. Основные (основания).
2. Кислотные (кислоты).
3. Амфотерные гидроксиды (гидроксиды металлов, способные проявлять свойства кислот).
Гидроксиды металлов в низших степенях окисления проявляют, как правило, основные свойства их общая формула Ме(ОН)n, где n- валентность (степень окисления +n) металла. Если металл может иметь несколько валентностей (степеней окисления), то при повышении степени окисления проявляются амфотерные свойства. Гидроксиды металлов в высших степенях окисления могут проявлять кислотные свойства, например марганец в степени окисления +7 образует марганцовую кислоту – HMnO4.
|
|
|
Гидроксиды неметаллов проявляют кислотные свойства.
Основания
Основания - это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп. В общем виде основания изображаются формулой Ме(ОН)n, где Ме+n – атом металла в степени окисления +n, ОН¯ - гидроксогруппа. Поскольку гидроксогруппа одновалентна (ее заряд «-1») их число в формуле основного гидроксида указывает на степень окисления металла.
Основные свойства гидроксидов реализуются группами ОН¯. В зависимости от числа гидроксильных ионов их подразделяют на однокислотные: NаOH, KOH; двухкислотные: Cа(OH)2, Mg(OH)2 и т.д.
Хорошо растворимые в воде основания называются щелочами. К ним относятся гидроксиды металлов главной подгруппы I группы Периодической системы элементов и гидроксиды металлов главной подгруппы II группы от Ca(OH)2, до Ra(OH)2.
Международная номенклатура оснований.
В соответствии с международной номенклатурой, название основания образуется из слова гидроксид и названия элемента в родительном падеже, после которого римскими цифрами в скобках указывается валентность металла (если она не единственная).
Cа(OH)2 – гидроксид кальция,
CuOH- гидроксид меди(I),
Sn(OH)4- гидроксид олова(IV).
Получение оснований
1. Активный металл + вода = щелочь + водород 2Li + H2O = 2LiOH + H2
2. Оксид активного металла + вода = щелочь SrO + H2O = Sr(OH)2
3. Соль + щелочь = основание + соль CuCl2 + 2KOH = Cu(OH)2 + 2KCl
Химические свойства оснований
1. Основание (щелочь) + кислотный оксид = соль + вода
Ca(OH)2 + CO2 = CaCO3 + H2O
2. Основание + кислота = соль + вода
Mg(OH)2 + HCl = MgCl2 + 2H2O
3. Щелочь + соль = новая соль + основание
2KOH + CuSO4 = K2SO4 + Cu(OH)2
Растворы щелочей изменяют цвет индикаторов: фенолфталеин-с бесцветного на малиновый, лакмус- с фиолетового на синий.
|
|
|
Типовые задачи
Пример 1. Назовите гидроксиды по международной номенклатуре: LiOH, Ba(OH)2, Fe(OH)2.
LiOH – гидроксид лития.
Валентность лития может быть только 1 (степень окисления +1) поэтому не указывается.
Ba(OH)2 – гидроксид бария.
Валентность бария может быть только 2 (степень окисления +2) поэтому не указывается.
Fe(OH)2 – гидроксид железа (II).
Валентность железа может быть 2 и 3 (степень окисления +2 и +3) поэтому валентность необходимо указывать. Чтобы указать валентность необходимо рассчитать степень окисления железа в Fe(OH)2.
Заряд молекулы складывается из степеней окисления всех атомов и равен нулю:
0 = 1*х + 2*(-2) + 2*(+1),, 0 = х – 2, х = +2, степень окисления железа равна +2 (валентность равна 2). Валентность железа в данном соединении можно определить по числу одновалентных гидроксогрупп, их две, следовательно, валентность железа в рассматриваемом соединении 2.
Пример 2. Привести графические и эмпирические формулы следующих гидроксидов: гидроксид калия, гидроксид алюминия, гидроксид меди (II).
Гидроксид калия
Графическая формула K - OH
Эмпирическая формула KOH
Гидроксид меди (II).
Графическая формула HO - Cu - OH
Эмпирическая формула Cu(OH)2
Гидроксид алюминия. Алюминий является металлом третьей группы главной подгруппы ПСЭ, поэтому проявляет только валентность равную 3. Степень окисления в соединениях +3 (металлы могут иметь только положительные степени окисления).
Графическая формула
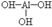
Эмпирическая формула Al(OH)3
|
|
|


