 |
Распространение нервного импульса вдоль возбудимого волокна
|
|
|
|
Приложение
Дидактически блок
БИОЭЛЕКТРИЧЕСКИЕ ПОТЕНЦИАЛЫ
Одна из важнейших функций биологической мембраны - генерация и передача биопотенциалов. Это явление лежит в основе возбудимости клеток, регуляции внутриклеточных процессов, работы нервной системы, регуляции мышечного сокращения, рецепции. В медицине на исследование электрических полей, созданных биопотенциалами органов и тканей, основаны диагностические методы: электрокардиография, электроэнцефалография, электромиография и другие. Практикуется и лечебное воздействие на ткани электрическими импульсами при электростимуляции.
В клетках и тканях могут возникать разности электрических потенциалов:
1) окислительно-восстановительные потенциалы - перенос электронов от одних молекул к другим;
2) мембранные - перенос ионов через мембрану вследствие градиента концентрации.
Основные биопотенциалы, регистрируемые в организме, - мембранные потенциалы.
Мембранный потенциал - разность потенциалов между внутренней (цитоплазматической) и наружной поверхностями мембраны:
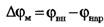
Прогресс в исследовании биопотенциалов обусловлен:
1) развитием микроэлектродного метода внутриклеточного измерения потенциалов;
2) созданием специальных усилителей биопотенциалов (УПТ);
3) выбором объектов исследования крупных клеток (гигантский аксон кальмара). Диаметр аксона кальмара до 0,5 мм (в 100 - 1000 больше, чем у человека).
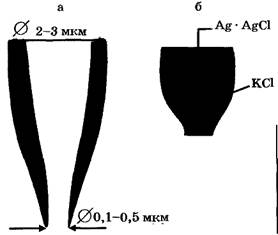
В гигантский аксон кальмара вводится микроэлектрод, не нанеся значительных повреждений. Микроэлектрод представляет собой стеклянную микропипетку с очень тонким кончиком (рис. 1а).
|
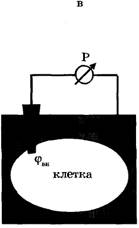
| Рис. 1. Микроэлектродный метод измерения биопотенциалов: а - стеклянная микропипетка; б - стеклянный микроэлектрод; в - схема регистрации мембранного потенциала |
Металлический электрод такой толщины гнется и не прокалывает клеточную мембрану, кроме того он поляризуется. Для исключения поляризации электрода используются неполяризующиеся электроды, например серебряная проволока, покрытая солью AgCl. В раствор КС1 или NaCl (желатинизированный агар-агаром), заполняющий микроэлектрод (рис. 1б).
|
|
|
Второй электрод - электрод сравнения - располагается в растворе у наружной поверхности клетки (рис. 1в). Регистрирующее устройство Р, содержащее усилитель постоянного тока, измеряет мембранный потенциал:
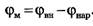
Мембранные потенциалы подразделяются на потенциалы покоя и потенциалы действия.
Потенциал покоя в клетках
Потенциал покоя - стационарная разность электрических потенциалов, между внутренней и наружной поверхностями мембраны в невозбужденном состоянии.
Потенциал покоя определяется разной концентрацией ионов по обе стороны мембраны и диффузией ионов через мембрану.
Если концентрация иона внутри клетки Свн отлична от концентрации этого иона снаружи Снар и мембрана проницаема для этого иона, возникает поток заряженных частиц через мембрану, вследствие чего нарушается электрическая нейтральность системы, образуется разность потенциалов внутри и снаружи клетки 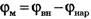 , которая будет препятствовать дальнейшему перемещению ионов через мембрану. При установлении равновесия выравниваются значения электрохимических потенциалов по разные стороны мембраны:
, которая будет препятствовать дальнейшему перемещению ионов через мембрану. При установлении равновесия выравниваются значения электрохимических потенциалов по разные стороны мембраны: 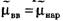 Так как
Так как 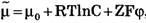 , то
, то
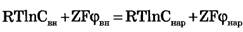
Отсюда легко получить формулу Нернста для равновесного мембранного потенциала:
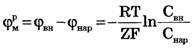
Если мембранный потенциал обусловлен переносом ионов К+, для которого 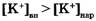 и Z = +1, равновесный мембранный потенциал
и Z = +1, равновесный мембранный потенциал
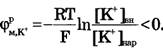
Для ионов Na+:[Na+]вн<[Na+]нap, Z = +1,
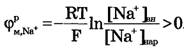
Для ионов Сl-:[Сl-]вн<[Сl-]нар, Z = -1 и
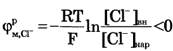
Если в формуле Нернста перейти от натурального логарифма к десятичному, то для положительного одновалентного иона (Z = +l)
|
|
|
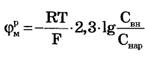
Примем температуру Т = 300 К, тогда
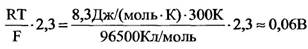
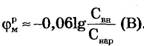
Согласно Бернштейну (1902 г.), причина мембранного потенциала покоя - диффузия ионов калия из клетки наружу.
Примем в формуле Нернста Cвн/Снар≈100, что по порядку величины соответствуют экспериментальным данным для калия  и мембранный потенциал
и мембранный потенциал 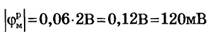 , что несколько больше модуля экспериментально измеренных значений потенциала покоя.
, что несколько больше модуля экспериментально измеренных значений потенциала покоя.
Рассчитано что изменение концентрации ионов в клетке вследствие выхода из клетки 10-17 моль ионов составит 2*10-3 ммоль/л. Это ничтожное изменение концентрации по сравнению с изменением концентрации ионов калия внутри клетки, составляет всего 10-4 % от концентрации калия внутри клетки. Таким образом, чтобы создать равновесный нернстовский мембранный потенциал, через мембрану должно пройти пренебрежимо малое количество ионов по сравнению с общим их количеством в клетке.
В табл. 1 приведены значения мембранного потенциала, рассчитанного по формуле Нернста для различных клеток и для различных ионов, и экспериментально полученные значения потенциала покоя для этих клеток.
Таблица 1. Содержание ионов К+, Na+, C1-, равновесные потенциалы и потенциалы покоя некоторых клеток.
| Объект | Концентрация, ммоль/л | f мB по формуле Нернста | f мВ экспер | |||||||
| [К+] | [Na+] | [С1] | К+ | Na+ | С1- | |||||
| вн. | нар. | вн. | нар. | вн. | нар. | |||||
| Гигантский аксон | -90 | +50 | -30 | -60 | ||||||
| Мышца лягушки | 2,5 | -98 | +60 | -87 | -94 |
Из сравнения рассчитанных и экспериментальных значений мембранного потенциала видно, что потенциал покоя на самом деле ближе к потенциалу, рассчитанному по формуле Нернста для К+.
Вместе с тем, обращает на себя внимание значительное расхождение экспериментальных и теоретических значений. Причины расхождения в том, что не учтена проницаемость мембраны для других ионов.
Одновременная диффузия через мембрану ионов К+, Na+ и С1- учитывается уравнением Гольдмана. Уравнение Гольдмана можно вывести из уравнения Нернста-Планка.
В стационарном случае, когда, возникая на мембране, разность потенциалов - мембранный потенциал - тормозит дальнейший перенос ионов через мембрану, суммарный поток различных ионов становится равным нулю:
|
|
|
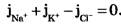
Перед Jcl стоит знак минус, учитывающий отрицательный заряд иона хлора. Однако, так как в создании мембранного потенциала участвуют различные ионы, равновесие при этом не наступает, потоки различных ионов не равны нулю по отдельности. Если учесть только потоки JK+ и JNa+, то 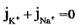 , или
, или 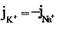 и получим:
и получим:
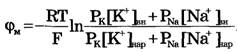
Если учесть еще и поток ионов С1-, то можно получить уравнение для мембранного потенциала, созданного потоками через мембрану трех видов ионов, уравнение Гольдмана:
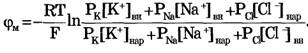
В числителе выражения, стоящего под знаком логарифма, представлены концентрации [К+]ВН, [Na+]BH, но [С1-]НАР, а в знаменателе - [К+]НАР, [Na+]НАР, но [С1-]ВН, так как ионы хлора отрицательно заряжены.
В состоянии покоя проницаемость мембраны для ионов К+ значительно больше, чем для Na+, и больше, чем для С1-:
РК» РNa, РК > Р С1
Для аксона кальмара, например,
РK:PNa:PC1=1:0,04:0,45
Переписав уравнение Гольдмана в виде:
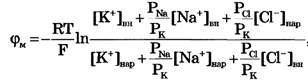
в случае, когда проницаемость мембраны для ионов натрия и хлора значительно меньше проницаемости для калия:
РNa «РК и РС1 «РК
из уравнения Гольдмана получим уравнение Нернста для мембранного потенциала покоя:
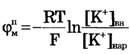
Таким образом, уравнение Нернста - частный случай уравнения Гольдмана.
Мембранный потенциал, рассчитанный по уравнению Гольдмана, оказался по абсолютной величине меньше мембранного потенциала, рассчитанного по формуле Нернста, ближе к экспериментальным его значениям в крупных клетках. И формула Нернста, и уравнение Гольдмана не учитывают активного транспорта ионов через мембрану, наличия в мембранах электрогенных (вызывающих разделение зарядов, а следовательно и возникновение разности потенциалов) ионных насосов, играющих важную роль в поддержании ионного равновесия в мелких клетках. В цитоплазматической мембране работают K+-Na+-ATФaзы, перекачивающие калий внутрь клетки, а натрий из клетки. С учетом работы электрогенных ионных насосов для мембранного потенциала было получено уравнение Томаса (Томас, 1972 г.):
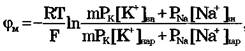
где m - отношение количества ионов натрия к количеству ионов калия, перекачиваемых ионными насосами через мембрану. Чаще всего K+-Na+-ATФaза работает в режиме, когда m =3/2, m всегда больше 1. (Нет ионных насосов, перекачивающих С1-, поэтому в уравнении Томаса отсутствуют члены РС1 [С1-].)
|
|
|
Коэффициент m>1 усиливает вклад градиента концентрации калия в создание мембранного потенциала, поэтому мембранный потенциал, рассчитанный по Томасу, больше по абсолютной величине, чем мембранный потенциал, рассчитанный по Гольману, и дает совпадение с экспериментальными значениями для мелких клеток.
Нарушение биоэнергетических процессов в клетке и работы K+-Na+-ATФазы приводит к уменьшению |φм|, в этом случае мембранный потенциал лучше описывается уравнением Гольд-мана.
Повреждение клеточной мембраны приводит к повышению проницаемости клеточных мембран для всех ионов: к повышению и РК, и PNa, и РС1. Вследствие уменьшение различия проницаемостей абсолютное значение мембранного потенциала |φм| снижается.
Для сильно поврежденных клеток |φм| еще меньше, но сохраняется отрицательный мембранный потенциал φм за счет содержащихся в клетке полианионов - отрицательно заряженных белков, нуклеиновых кислот и других крупных молекул, не могущих проникнуть через мембрану (доннановский потенциал).
Потенциал действия
Посредством электрических нервных импульсов (потенциалов действия) в организме передается информация от рецепторов к мозгу и от нейронов мозга к мышцам. Организм является полностью электрифицированной системой.
Потенциал действия был открыт раньше потенциала покоя. Электрический нервный импульс открыл Луиджи Гальвани, профессор анатомии в г. Болонья. Гальвани открыл, что мышечные сокращения конечностей препарированной лягушки могут вызваться электрическим импульсом и что сама живая система является источником электрического импульса.
В XIX веке утвердилось примитивное представление о распространении электрических токов по нервам, как по проводам. Однако Гельмгольцем (вторая половина XIX века) было показано, что скорость распространения нервного импульса составляет лишь 1-100 м/с, это значительно меньше, чем скорость распространения электрического импульса по проводам до 3×108 м/с. Поэтому к концу XIX века гипотеза электрической природы нервного импульса была отвергнута большинством физиологов. Было выдвинуто предположение о распространении по нервным волокнам химической реакции. На самом деле, как было показано позже, медленное распространение электрического нервного импульса связано с медленной перезарядкой конденсаторов, которые представляют собой клеточные мембраны, через большие сопротивления. Постоянная времени перезарядки мембраны τ = RC велика, так как велики емкость мембраны (С) и сопротивление R нервного волокна.
|
|
|
То, что нервный импульс представляет собой импульс электрического тока, было доказано лишь к середине 20-го века, в основном в работах английского физиолога А.Ходжкина и его сотрудников.
Потенциалом действия (ПД) называется электрический импульс, обусловленный изменением ионной проницаемости мембраны и связанный с распространением по нервам и мышцам волны возбуждения.
Опыты по исследованию потенциала действия проведены (в основном Ходжкиным и его сотрудниками) на гигантских аксона кальмара методом микроэлектродов с использованием высокоомных измерителей напряжения, а также методом меченых атомов. На рис. 2, а показаны схема опытов и результаты исследований.
В опытах по исследованию потенциала действия использовали два микроэлектрода, введенных в аксон. На первый микроэлектрод подается импульс с амплитудой V от генератора Г прямоугольных импульсов, меняющий мембранный потенциал. Мембранный потенциал измеряется при помощи второго микроэлектрода высокоомным регистратором напряжения Р.
  в
в 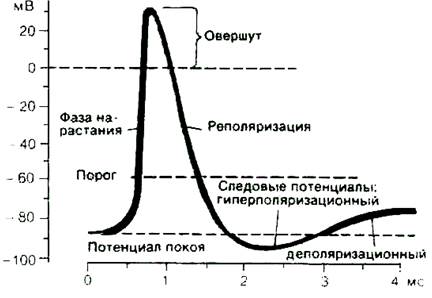
|
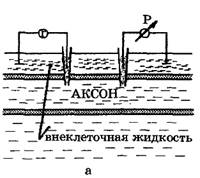
Рис. 2. Исследование потенциала действия: а - схема опыта (Г - генератор импульсов, Р - регистратор напряжения); б - потенциал действия (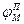 - потенциал покоя, - потенциал покоя, 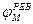 - потенциал реверсии, - потенциал реверсии, 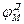 - амплитуда потенциала действия, - амплитуда потенциала действия, 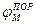 - пороговый потенциал), в – фазы потенциала действия - пороговый потенциал), в – фазы потенциала действия
|
Возбуждающий импульс вызывает лишь на короткое время смещение мембранного потенциала, который быстро пропадает и восстанавливается потенциал покоя. В том случае, когда возбуждающий импульс смещается еще дальше в отрицательную сторону, он сопровождается гиперполяризацией мембраны. Также не формируется потенциал действия, когда возбуждающий импульс положительный (деполяризующий), но его амплитуда меньше порогового значения VПОР. Однако, если амплитуда положительного, деполяризующего импульса окажется больше значения VПОР, φм становится больше 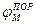 и в мембране развивается процесс, в результате которого происходит резкое повышение мембранного потенциала и мембранный потенциал φм даже меняет свой знак - становится положительным (φВН > φНАР), (рис. 2б).
и в мембране развивается процесс, в результате которого происходит резкое повышение мембранного потенциала и мембранный потенциал φм даже меняет свой знак - становится положительным (φВН > φНАР), (рис. 2б).
Достигнув некоторого положительного значения 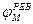 - потенциала реверсии, мембранный потенциал возвращается к значению потенциала покоя
- потенциала реверсии, мембранный потенциал возвращается к значению потенциала покоя 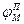 , совершив нечто вроде затухающего колебания. В нервных волокнах и скелетных мышцах длительность потенциала действия около 1 мс (а в сердечной мышце около 300 мс. После снятия возбуждения еще в течение 1-3 мс в мембране наблюдаются некоторые остаточные явления, во время которых мембрана рефрактерна (невозбудима).
, совершив нечто вроде затухающего колебания. В нервных волокнах и скелетных мышцах длительность потенциала действия около 1 мс (а в сердечной мышце около 300 мс. После снятия возбуждения еще в течение 1-3 мс в мембране наблюдаются некоторые остаточные явления, во время которых мембрана рефрактерна (невозбудима).
Новый деполяризующий потенциал V > VПОР может вызвать образование нового потенциала действия только после полного возвращения мембраны в состояние покоя. Причем амплитуда потенциала действия
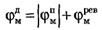
не зависит от амплитуды деполяризующего потенциала (если только V > VПОР). Если в покое мембрана поляризована (потенциал цитоплазмы отрицателен по отношению к внеклеточной среде), то при возбуждении происходит деполяризация мембраны (потенциал внутри клетки положителен) и после снятия возбуждения происходит реполяризация мембраны. Характерные свойства потенциала действия:
1) наличие порогового значения деполяризующего потенциала;
2) закон "все или ничего", то есть, если деполяризующий потенциал больше порогового, развивается потенциал действия, амплитуда которого не зависит от амплитуды возбуждающего импульса и нет потенциала действия, если амплитуда деполяризующего потенциала меньше пороговой;
3) есть период рефрактерности, невозбудимости мембраны во время развития потенциала действия и остаточных явлений после снятия возбуждения;
4) в момент возбуждения резко уменьшается сопротивление мембраны (у аксона кальмара от 0,1 Ом × м2 в покое до 0,0025 Ом × м2 при возбуждении).
Если обратиться к данным для значений равновесных нернстовских потенциалов, созданных различными ионами (табл. 1), естественно предположить, что положительный потенциал реверсии имеет натриевую природу, поскольку именно диффузия натрия создает положительную разность потенциалов между внутренней и наружной поверхностями мембраны.
Можно менять амплитуду импульса потенциала действия, изменяя концентрацию натрия в наружной среде. При уменьшении наружной концентрации натрия амплитуда потенциала действия уменьшается, так как меняется потенциал реверсии. Если из окружающей клетку среды полностью удалить натрий, потенциал действия вообще не возникает.
Опыты, проведенные с радиоактивным изотопом натрия, позволили установить, что при возбуждении проницаемость для натрия резко возрастает. Если в состоянии покоя соотношение коэффициентов проницаемости мембраны аксона кальмара для разных ионов:
PK:PNa:PCI = = 1:0,04:0,45
то в состоянии возбуждения:
PK:PNa:PCI = l:20:0,45
то есть, по сравнению с невозбужденным состоянием, при возбуждении коэффициент проницаемости для натрия возрастает в 500 раз.
Расчеты мембранного потенциала реверсии по уравнению Гольдмана, если в него подставить значения проницаемостей мембраны для возбужденного состояния, совпадают с экспериментальными данными.
Возбуждение мембраны описывается уравнениями Ходжкина-Хаксли. Одно из уравнений Ходжкина-Хаксли имеет вид:
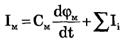
где Iм - ток через мембрану, См - емкость мембраны, 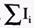 - сумма ионных токов через мембрану.
- сумма ионных токов через мембрану.
Электрический ток через мембрану складывается из ионных токов: ионов калия - IK+, натрия - INa+ и других ионов, в том числе CI-, так называемого тока утечки IУТ, а также емкостного тока. Емкостной ток обусловлен перезарядкой конденсатора, который представляет собой мембрана, перетеканием зарядов с одной ее поверхности на другую. Его величина определяется количеством заряда, перетекающего с одной обкладки на другую за единицу времени dq/dt, а поскольку заряд конденсатора q = СмΔφ = Смφм, то емкостной ток 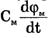
Полный мембранный ток
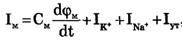
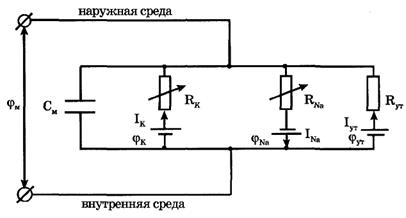
На рис. 3 представлена эквивалентная электрическая схема элемента возбудимой мембраны.
|
| Рис. 3. Эквивалентная электрическая схема элемента возбудимой мембраны |
Каждый ионный ток определяется разностью мембранного потенциала φм и равновесного нернстовского потенциала, создаваемого диффузией ионов данного типа 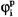 :
:
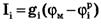
где 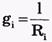 - проводимость (величина, обратная сопротивлению элемента мембраны для ионов данного типа).
- проводимость (величина, обратная сопротивлению элемента мембраны для ионов данного типа).
На эквивалентной электрической схеме элемента мембраны равновесные потенциалы Нернста моделируются источниками напряжений с электродвижущими силами: 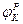 ,
, 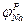 ,
, 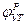 , а проводимости элемента мембраны для разных ионов моделируются резисторами RK, RNa, RУТ.
, а проводимости элемента мембраны для разных ионов моделируются резисторами RK, RNa, RУТ.
Общее уравнение описывающее трансмембранные ионные токи:
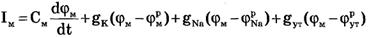
Согласно теории Ходжкина-Хаксли, возбуждение элемента мембраны связано с изменениями проводимости мембраны для ионов Na+ и К+: gK и gNa. Проводимости мембраны сложным образом зависят от мембранного потенциала и времени.
Опыты с фиксацией напряжения. Для доказательства решающей роли ионных токов в генерации нервного импульса были поставлены знаменитые опыты с фиксацией мембранного потенциала φМ = φВН - φНАР (Ходжкин, Хаксли и др.).
Поддержание постоянного напряжения φМ при исследовании токов через возбужденную мембрану позволяло:
1) избавиться от емкостных токов См dφМ/dt;
2) исключить изменение ионных проводимостей gNa и gK при изменении φМ и изучить их изменение в различные фазы развития возбуждения: gj = f (t).
Постоянная разность потенциалов между внутренней и наружной поверхностями мембраны поддерживается при помощи специальной электронной схемы (рис. 4), ключевой элемент которого - операционный усилитель (ОУ). (В основном ОУ представляют собой усилители постоянного тока, охваченные глубокой отрицательной обратной связью по напряжению.)
Между входами в ОУ - разность потенциалов микроэлектрода, помещенного внутрь аксона кальмара (1), и электрода сравнения (2), то есть мембранный потенциал φм = φвн – φнар. На выходе операционного усилителя создается напряжение, компенсирующее изменение трансмембранного потенциала. Это напряжение подается на серебряный проводник (3), расположенный вдоль аксона, чтобы по всему волокну была одна и та же мембранная разность потенциалов. Электронная схема удерживает на выходе (внутри аксона) тот же потенциал, что и на входе ОУ, таким образом удерживается постоянный мембранный потенциал: φм = const. При помощи генератора постоянного напряжения (4) можно "ступенькой" изменить входное напряжение ОУ, например, поднять его выше порогового. Электронная схема будет удерживать это заданное напряжение во время опыта. Амперметр (5) измеряет протекающий при этом через мембрану ток (между электродом сравнения (2) и выходящим электродом ОУ (3) (рис. 4). В опытах с фиксацией напряжения можно исследовать изменение мембранного тока во времени, при развитии возбуждения, задавая разные постоянные значения мембранного потенциала φм.
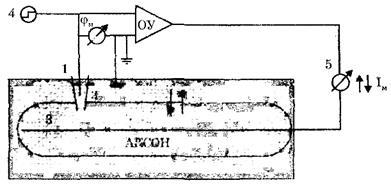
Рис. 4. Схема исследования токов через мембрану с фиксацией мембранного потенциала (1 - микроэлектрод, 2 - электрод сравнения, 3 - серебряный проводник, 4 - генератор постоянного напряжения, 5 - амперметр, ОУ - операционный усилитель)
Будем считать ток, направленный из клетки наружу в окружающий раствор положительным, а внутрь клетки из окружающего раствора - отрицательным.
Обнаружено, что, если поднять мембранный потенциал φм выше порогового (рис. 5а), сначала течет ток внутрь клетки, а затем из клетки наружу (рис. 5 б).
В экспериментах, проведенных Ходжкиным, Хаксли, Бейкером, Шоу, было доказано, что фаза 1 мембранного тока связана с потоком ионов натрия из окружающей, среды (где концентрация натрия больше) в клетку (где она меньше), а фаза два объясняется вытеканием ионов калия из клетки наружу.
В своих опытах Ходжкин и Хаксли изменяли ионный состав окружающего раствора. Было обнаружено, что, если снаружи убирали натрий, первая фаза мембранного тока (ток внутрь клетки) пропадала. Следовательно, на самом деле, первая фаза развития потенциала действия связана с увеличением проницаемости мембраны для ионов натрия. Поток положительных частиц в клетку приводит к деполяризации мембраны - внутренняя ее поверхность заряжается положительно по отношению к наружной.
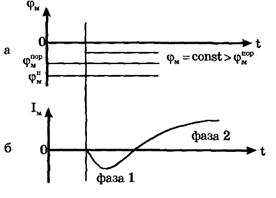
Рис. 5. Результаты исследований мембранного тока методом фиксации напряжения
Во второй фазе резко увеличивается проницаемость мембраны для калия и из клетки наружу выходят положительно заряжённые ионы калия, в то время как натриевый ток уменьшается.
Ионный механизм развития потенциала действия был окончательно доказан в решающем эксперименте Ходжкина, Бейкера и Шоу, в котором аксоплазму препарированного аксона заменили на наружный раствор, а ионный состав наружного раствора сделали таким же, как у нормальной аксоплазмы. При такой замене ионных составов изменила знак разность потенциалов на мембране. Теперь в покое внутренняя ее поверхность была заряжена положительно по отношению к наружной. А потенциал действия оказался отрицательным.
Выдвинута гипотеза, что селективное (избирательное) изменение ионной проницаемости возбужденной мембраны: сначала для Na+, а потом для К+ - объясняется тем, что в мембране имеются специальные ионные каналы (предположительно, это поры, образованные белковыми молекулами). Существуют отдельно натриевые и калиевые каналы, которые открываются и закрываются во время прохождения через данный участок мембраны нервного импульса. В первой фазе - открываются натриевые каналы, во второй фазе - калиевые. Соответственно, сначала закрываются натриевые каналы, а затем калиевые. Открывание и закрывание ионных каналов вызывается изменением мембранного потенциала.
Одно из доказательств наличия в мембране ионных каналов -существование веществ, блокирующих ионные потоки через мембрану.
Так, содержащийся в рыбе фугу тетродотоксин блокирует поступление внутрь клетки натрия и, таким образом, нарушает передачу нервного импульса, что может привести к летальному исходу. Доказано, что тетродотоксин не влияет на проницаемость клетки для калия, значит, ионы натрия и калия на самом деле проходят через разные каналы.
Из-за своего специфического строения молекулы тетродотоксина, по-видимому, застревают в натриевых каналах. Подсчитав число застрявших в мембране молекул тетродотоксина, удалось определить количество натриевых каналов. В разных нервных волокнах позвоночных оно было разным - от 3 до 75 каналов на один квадратный микрометр площади мембраны (для сравнения количество молекул фосфолипидов = 2 • 106 1/мкм2). Был обнаружен и специфический ингибитор калиевых каналов - тетраэтиламмоний.
Если обработать мембрану тетродотоксином, блокирующим натриевые каналы, в опытах с фиксацией мембранного потенциала пропадает первая фаза (рис. 5), а тетраэтиламмоний, прекращающий перенос через мембрану калия, вызывает исчезновение второй фазы.
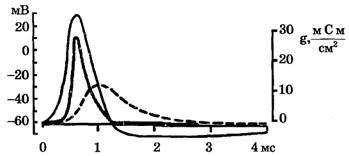
Рис. 6. Изменение проводимости мембраны для ионов калия (gK) и натрия (gNa) во время развития потенциала действия (справа шкала проводимости g, слева - потенциалы φм)
Таким образом, установлено, что формирование потенциала действия вызывается ионными потоками через мембрану: сначала ионов натрия внутрь клетки, а затем - ионов калия из клетки в наружный раствор (рис. 5), что связано с изменением проводимости мембраны для ионов калия и натрия (рис. 6).
Распространение нервного импульса вдоль возбудимого волокна
Если в каком-нибудь участке возбудимой мембраны сформировался потенциал действия, мембрана деполяризована, возбуждение распространяется на другие участки мембраны. Рассмотрим распространение возбуждения на примере передачи нервного импульса по аксону (рис. 7).
I 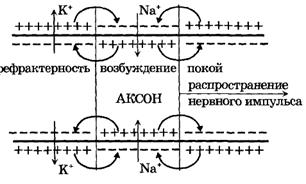
Рис. 7. Локальные токи при распространении нервного импульса по нервному волокну
И в аксоплазме, и в окружающем растворе возникают локальные токи: между участками поверхности мембраны с большим потенциалом (положительно заряженными) и участками с меньшим потенциалом (отрицательно заряженными).
Локальные токи образуются и внутри аксона, и на наружной его поверхности. Локальные электрические токи приводят к повышению потенциала внутренней поверхности невозбужденного участка мембраныи φВН к понижению φНАР наружного потенциала невозбужденного участка мембраны, оказавшегося по соседству с возбужденной зоной. Таким образом, отрицательный потенциал покоя 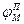 уменьшается по абсолютной величине, то есть повышается. В областях, близких к возбужденному участку, φм повышается выше порогового значения. Под действием изменения мембранного потенциала открываются натриевые каналы и дальнейшее повышение происходит уже за счет потока ионов натрия через мембрану.
уменьшается по абсолютной величине, то есть повышается. В областях, близких к возбужденному участку, φм повышается выше порогового значения. Под действием изменения мембранного потенциала открываются натриевые каналы и дальнейшее повышение происходит уже за счет потока ионов натрия через мембрану.
Происходит деполяризация мембраны, развивается потенциал действия. Затем возбуждение передается дальше на покоящиеся участки мембраны.
Может возникнуть вопрос, почему возбуждение распространяется по аксону не в обе стороны от зоны, до которой дошло возбуждение, ведь локальные токи текут в обе стороны от возбужденного участка. Дело в том, что возбуждение может распространяться только в область мембраны, находящуюся в состоянии покоя, то есть в одну сторону от возбужденного участка аксона. В другую сторону нервный импульс не может распространяться, так как области, через которые прошло возбуждение, некоторое время остаются невозбудимыми - рефрактерными.
Повышение мембранного потенциала - величина деполяризующего потенциала V, передаваемого от возбужденных участков вдоль мембраны, зависит от расстояния х (как это следует из электродинамики) по формуле:
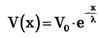
Vo - повышение мембранного потенциала в зоне возбуждения, х - расстояние от возбужденного участка; λ - константа длины нервного волокна, равная расстоянию, на котором деполяризующий потенциал уменьшается в е раз (е-основание натурального логарифма ≈ 2,71) (рис. 8).
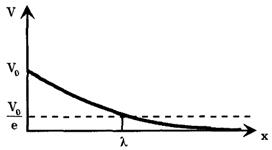
Рис. 8. Зависимость деполяризующего потенциала от расстояния
Константа длины нервного волокна
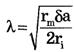
где rm - удельное электрическое сопротивление оболочки волокна, δ - толщина оболочки, а - радиус нервного волокна, rI - удельное электрическое сопротивление цитоплазмы. Чем больше константа длины мембраны, тем больше скорость распространения нервного импульса. Величина λ тем больше, чем больше радиус аксона и удельное сопротивление мембраны и чем меньше удельное сопротивление цитоплазмы.
Большую скорость распространения нервного импульса по аксону кальмара обеспечивает их гигантский по сравнению с аксонами позвоночных диаметр. У позвоночных большая скорость передачи возбуждения в нервных волокнах достигает другими способами. Аксоны позвоночных снабжены миелиновой оболочкой, которая увеличивает сопротивление мембраны и ее толщину.
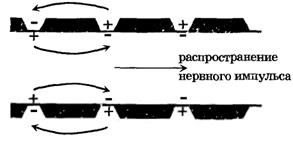
Рис. 9. Сальтаторное распространение потенциала действия по миелинизированному волокну
Возбуждение по миелинизированному волокну распространяется сальтаторно (скачкообразно) от одного перехвата Ранвье (участка, свободного от миелиновой оболочки) до другого. Нервные импульсы проводятся по аксонам в какой-то степени аналогично тому, как передаются электрические сигналы по кабельно-релейной линии. Электрический импульс передается без затухания за счет его усиления на промежуточных релейных станциях, роль которых в аксонах выполняют участки возбудимой мембраны, в которых генерируются потенциалы действия.
|
|
|
12 |


