 |
Приборы и материалы, необходимые для постановки опыта, принципиальная схема опытной установки
|
|
|
|
Реферат
Опыт Бойля
Выполнил
Студент группы 1.1
Азин Кирилл
Ульяновск 2013
Содержание:
1.Введение
2.ПРИБОРЫ И МАТЕРИАЛЫ, НЕОБХОДИМЫЕ ДЛЯ ПОСТАНОВКИ ОПЫТА, ПРИНЦИПИАЛЬНАЯ СХЕМА ОПЫТНОЙ УСТАНОВКИ
3.ОСНОВНЫЕ РЕЗУЛЬТАТЫ ОПЫТА
4.Заключение
5.Источник
Сведения о учёном. (Введение)
Роберт Бойль (англ. Robert Boyle; 25 января 1627 года — 30 декабря 1691 года)— физик, химик и богослов, седьмой сын Ричарда Бойля, графа Коркского, вельможи времён Елизаветы Английской.
Результаты своих опытов Р.Бойль изложил в сочинении «New experiments physico– mechanical, touching the spring of the air» (Оксфорд, 1660 г.). В этой же работе он описывает свой новый насос.

Эксперименты, выполненные Р. Бойлем, позволили ему убедиться в справедливости результатов опытов О. Герике.
Помимо того, кроме уже известных научных фактов Р. Бойль устанавливает несколько новых. В ходе многократно воспроизведенных экспериментов он наблюдал: что ртуть «падает», когда над ртутной ванной барометра выкачивают воздух; что в пустоте течение воды по сифону прекращается; что дым в пустом сосуде сначала несколько поднимается, а потом, подобно всякому тяжелому телу, падает на дно. Им были зафиксированы и некоторые другие эффекты.
Учеными того времени предпринимались попытки объяснить результаты опытов по исследованию свойств воздуха и производимого им давления. Несмотря на множество неопровержимых доказательств существования атмосферного давления, многие не могли понять, как воздух такой легкий и подвижный, может уравновешивать столб ртути значительной высоты (в 28 дюймов!). На этот счет строились различные предположения. Так, например, люттихский профессор Франциск Линус (1595 – 1675) утверждал, что ртуть удерживается в барометре «невидимыми нитями» и, что якобы он сам почувствовал наличие этих нитей, когда закрывал пальцем барометрическую трубку.
|
|
|
Р. Бойль не был согласен с предположением Ф. Линуса. Заинтересовавшись замечательными свойствами воздуха, Р. Бойль выдвинул собственную гипотезу для их объяснения. Он считал, что воздух обладает упругими свойствами. Ученый представлял себе воздух как совокупность «маленьких спиралей», способных сжиматься. По мнению Р. Бойля, именно упругость воздуха уравновешивает давление столба ртути и давление атмосферы. Р. Бойлю было важно доказать ошибочность гипотезы Ф. Линуса и убедить последнего в существовании сопротивления воздуха. Ему пришлось поставить специальный опыт, в ходе которого он хотел установить, как меняется объем данного количества воздуха в зависимости от давления. Результаты, полученные Р. Бойлем, позволили сформулировать ему один из основных законов физики, носящий его имя.
Описание опытов Р. Бойля и формулировка его закона были опубликованы в 1662 году в сочинении « A defense of the doctrine touching spring and weight of the air » («Защита доктрины, касающейся упругости и веса воздуха»)
Закон об «упругих свойствах воздуха» не сохранил имени только первого, открывшего его ученого. Этот закон носит имя еще одного физика - Эдма Мариотта. В 1676 г. французский священникЭ.Мариотт (1620 – 1684 гг.) в своей работе «Опыты о природе воздуха» описывает собственные экспериментальные исследования по сжатию и разряжению воздуха, из которых (независимо от Р. Бойля) он выводит аналогичный закон [8, С. 131]. Теперь этот закон называется законом Бойля - Мариотта. Научный приоритет Р. Бойля не вызывает сомнения, но, следует отметить, что Э. Мариотт глубже осознал смысл полученного им результата. В частности, Э. Мариотт предсказал различные применения данного закона. Из них наиболее важным был расчет высоты местности над уровнем моря по показаниям барометра. Что касается Р. Бойля, то он считал выявленную им в эксперименте закономерность всего лишь еще одним интересным свойством воздуха
|
|
|
ПРИБОРЫ И МАТЕРИАЛЫ, НЕОБХОДИМЫЕ ДЛЯ ПОСТАНОВКИ ОПЫТА, ПРИНЦИПИАЛЬНАЯ СХЕМА ОПЫТНОЙ УСТАНОВКИ
Экспериментальная работа Р. Бойля включала две относительно самостоятельные части. В первой своей части эксперимент был связан с исследованием упругих свойств воздуха при давлениях выше атмосферного, а во второй - при давлениях ниже атмосферного.
Обратимся к характеристике оборудования, которое использовал Р. Бойль на первом этапе экспериментальной работы.
Сам Р. Бойль так описывает свою экспериментальную установку: «Мы взяли длинную стеклянную трубку, которая путем нагревания на лампе была изогнута таким образом, что загнутая часть оказалась параллельной остальной части трубки и, один конец трубки был герметически запаян. Трубка была разделена на дюймы (каждый дюйм был разделен еще на 8 частей) при помощи наклеенной узкой бумажки» (рис. 2, а)

Чтобы убедиться, сохраняет ли его закон силу в области давлений ниже атмосферного Р.Бойль использовал более сложную установку.
«Мы применили, - пишет Р. Бойль, - стеклянную трубку длиной около шести футов. Поскольку она была герметически запаяна с одного конца, то служила нам так же, как если бы мы могли проводить опыт в бадье или в пруду глубиной семьдесят дюймов. Мы также располагали узкой стеклянной трубочкой величиной примерно с лебединое перо, открытой с обоих концов, вдоль всей длины трубки был приклеен узкий листок бумаги, разделенный на дюймы и их восьмые части. Когда эта узкая трубочка опускалась в большую трубку, почти заполненную ртутью, стекло способствовало тому, чтобы последняя сделалась выпуклой у верхнего края трубки. И ртуть, проникая через нижнее отверстие трубочки, заполняла ее до тех пор, пока заключенная внутри ртуть не оказывалась почти на уровне с поверхностью окружающей ртути в трубке» (рис. 5, а). Отверстие на конце узкой трубочки, который выступал над поверхностью ртути, тщательно заделывалось с помощью расплавленного сургуча.

ОСНОВНЫЕ РЕЗУЛЬТАТЫ ОПЫТА
|
|
|
Наблюдения и измерения, выполненные в ходе опыта, позволили Р. Бойлю составить две таблицы (для давлений больших и меньших атмосферного). На первый взгляд, таблицы Р.Бойля кажутся достаточно сложными. На самом деле в структуре таблиц четко отражена идея эксперимента, а представленные в них данные убедительно подтверждают справедливость выдвинутой ученым гипотезы.
В таблице 1 приведены данные опыта, выполненного при давлениях больших атмосферного, а в таблице 2 - при давлениях меньших атмосферного.
Таблица сжатия воздуха
(по Р. Бойлю, числа даны в дюймах
А А В C D E
| 11 1/ 2 10 1/ 2 9 1/ 2 8 1/ 2 7 1/ 2 6 1/ 2 5 3/ 4 5 1/ 2 5 1/ 4 4 3/ 4 4 1/2 4 1/ 4 3 3/ 4 3 1/ 2 3 1/ 4 | 01 7/ 16 02 13/16 04 6/ 16 06 8/ 16 07 14/ 16 10 2/ 16 12 8/ 16 15 1/ 16 17 15/ 16 21 3/ 16 25 3/ 16 29 11/ 16 32 3/ 16 34 15/16 37 15/ 16 41 9/ 16 48 11/ 16 53 11/ 16 58 3/ 16 63 15/ 16 71 5/ 16 78 11/ 16 88 7/ 16 | Прибавив 291/8, получим: п | 29 2/ 16 30 9/ 16 31 15/ 16 33 8/ 16 35 5/ 16 39 5/ 16 41 10/ 16 44 8/ 16 47 1/ 16 50 5/ 16 54 5/ 16 58 13/ 16 61 3/ 16 64 1/ 16 67 1/ 16 70 11/ 16 74 2/ 16 77 14/ 16 82 12/ 16 87 14/ 16 93 1/ 16 100 7/ 16 107 13/ 16 117 9/ 16 | 29 3/ 13 30 9/ 16 31 12/ 16 33 1/ 7 36 15/ 19 38 7/ 8 41 2/ 17 43 11/ 16 46 3/ 5 56 10/ 13 58 2/ 8 60 8/ 23 63 6/ 11 66 4/ 7 73 11/19 77 2/ 3 82 4/17 87 3/ 8 93 1/ 5 99 6/ 71 107 7/ 13 116 4/ 8 | АА – числа, измеряющие объемы короткого колена, которое содержит одно и то же число частиц воздуха, различно сжатого(соответственно в частях и в дюймах) (фактически, объем воздуха в усл. ед.). В – высота столба ртути в длинном колене трубки, который сжимает воздух. С – высота столба ртути в барометре, который уравновешивает давление атмосферы. D – сумма двух чисел В и С, выражающая то давление, под которым находится воздух. Е – какова должна бы быть высота столба согласно гипотезе, что давление и объемы находятся в обратном отношении. |
Таблица разрежения воздуха
(по Р. Бойлю, числа даны в дюймах)
| А | В | С | D | E | Примечание |
| 00 0/ 0 15 3/8 20 2/8 22 5/8 24 1/8 24 7/8 25 4/8 26 0/0 26 3/8 26 6/8 27 1/8 27 4/8 27 6/8 27 7/8 28 1/8 28 3/8 28 4/8 | Вычитая из 29 3/4, будем иметь: | 29 3/ 4 14 3/8 9 4/ 8 7 4/ 8 5 5/ 8 4 7/ 8 4 2/ 8 3 6/ 8 3 3/ 8 30/ 0 2 5/ 8 2 2/8 2 0/ 0 1 7/ 8 1 6/ 8 1 4/ 8 1 3/ 8 1 2/ 8 | 29 3/ 4 14 7/ 8 9 11/ 12 7 7/ 16 5 19/ 20 4 23/ 24 4 1/ 4 3 13/ 32 3 11/ 36 2 39/ 40 2 13/ 43 2 1/ 8 1 55/ 64 1 47/ 72 1 47/ 72 1 33/ 96 1 1/ 18 0 119/ 128 | Атмосферное давление = 29 3/ 4 дюйма А – числа, измеряющие расстояние от уровня ртути до вершины трубки, которая содержит одно и то же число частиц воздуха (фактически, объем воздуха в усл. ед.). В – высота столба ртути, который вместе с давлением заключенного воздуха уравновешивает давление атмосферы. С – давление атмосферы. D – дополнение для В, чтобы получить число С, измеряющее давление, под которым находится заключенный в трубке воздух. Е – каково должно было бы быть давление, согласно принятой гипотезе. |
|
|
|
4. Заключение:
Объяснение закону, установленному Р. Бойлем и Э. Мариоттом может быть дано с позиций молекулярно-кинетических представлений о строении вещества.
Если мы изменим объем данной массы газа, то изменится и плотность газа. Если плотность газа меняется, то во столько же раз меняется и число молекул в единице объема. Если газ не слишком сжат и движения молекул можно считать совершенно независимыми друг от друга, то число ударов N за единицу времени на единицу поверхности стенки сосуда пропорционально числу молекул n в единице объема. Следовательно, если средняя скорость молекул не меняется с течением времени (в макромире это означает постоянство температуры), то давление газа должно быть пропорционально числу молекул n в единице объема, то есть плотности газа.
Если, например, мы уменьшим объем газа в пять раз, то плотность газа тоже увеличится в пять раз. При этом соответственно увеличится и давление газа. Если температура не изменилась, то, как показывает закон Бойля – Мариотта, давление увеличится тоже в пять раз.
Если плотности газа при давлениях р1 и р2 равны ρ1 и ρ2, то можно написать:
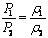
|
При изотермическом процессе давление газа изменяется прямо пропорционально его плотности.
Этот важный результат можно считать другим и более существенным выражением закона Бойля – Мариотта.
Однако, закон Бойля – Мариотта не будет выполняться, если перейти к большим давлениям. И это обстоятельство тоже может быть пояснено на основании молекулярных представлений. С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объем газа. Это обстоятельство увеличивает число ударов молекул о стенку, так как благодаря его действию сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
|
|
|
С другой стороны, в сильно сжатом газе и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул о стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство, а это приводит к тому, что произведение P·V немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство, и произведение P·V заметно увеличивается [ 23 С. 433].
Итак, газы не строго подчиняются закону Бойля – Мариотта. Это проявляется в том, что кривые, изображающие зависимость давления газа от объема при постоянной температуре, отличаются от гипербол. Но если отклонения невелики, то отличие гипербол трудно заметить. Легче обнаружить отклонения от закона Бойля – Мариотта, если воспользоваться иным изображением зависимости давления газа от объема, а именно, откладывать по оси абсцисс давление, а по оси ординат – произведение давления на объем.
Возьмем по ν киломолей водорода, азота и кислорода. Построим для них по опытным данным график зависимости отношения  от P для небольших давлений (0 – 40 бар) (бар = 105Па)при трех значениях температуры (рис. 7). Если закон Бойля – Мариотта соблюдается (
от P для небольших давлений (0 – 40 бар) (бар = 105Па)при трех значениях температуры (рис. 7). Если закон Бойля – Мариотта соблюдается ( 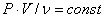 ), то эта зависимость должна изображаться горизонтальной прямой, параллельной оси р. Как видно из рисунка, для всех трех газов получаются прямые линии, но при температуре 373, 15º К (температура кипения воды под давлением 1 атм) только для кислорода прямая
), то эта зависимость должна изображаться горизонтальной прямой, параллельной оси р. Как видно из рисунка, для всех трех газов получаются прямые линии, но при температуре 373, 15º К (температура кипения воды под давлением 1 атм) только для кислорода прямая 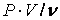 приблизительнопараллельна оси P. Таким образом, при этой температуре (если давление не превышает 40 бар) закон Бойля – Мариотта справедлив только для кислорода, тогда как для водорода и азота наблюдаются отклонения от этого закона.
приблизительнопараллельна оси P. Таким образом, при этой температуре (если давление не превышает 40 бар) закон Бойля – Мариотта справедлив только для кислорода, тогда как для водорода и азота наблюдаются отклонения от этого закона.
5. Источники:
http://mdito.pspu.ru/nfpk/um17/Boil.html
http://ru.wikipedia.org/wiki/%C1%EE%E9%EB%FC,_%D0%EE%E1%E5%F0%F2
|
|
|


